

 |
 |
免疫と糖鎖:グライコワードの視点から |
|||||||||||||||||||||||
|
免疫系は自然免疫と獲得免疫の共同作業により感染や病気から身を守っている。免疫系の典型的な特徴として、膨大な種類の異物に対応できる点、自己・非自己を見分けられる点が挙げられる。それ以外に、同じ骨髄由来でありながら分化・活性化段階の異なる多様な細胞がこの系に関与する点、免疫応答時に細胞の移動を伴う点、正負の様々な制御機構によって系のはたらきが微調整される点なども、他のシステムにはない免疫系ならではの特徴と言えるであろう。 グライコワードでは免疫系に関与する糖鎖とその認識分子に関する代表的な話題や最近の話題からいくつかを取り上げて紹介している。このサイトで紹介される内容をかいつまんで紹介したい。なお、本稿は免疫系自体を体系的に説明するものではないのでご承知おきいただきたい。 |
|||||||||||||||||||||||
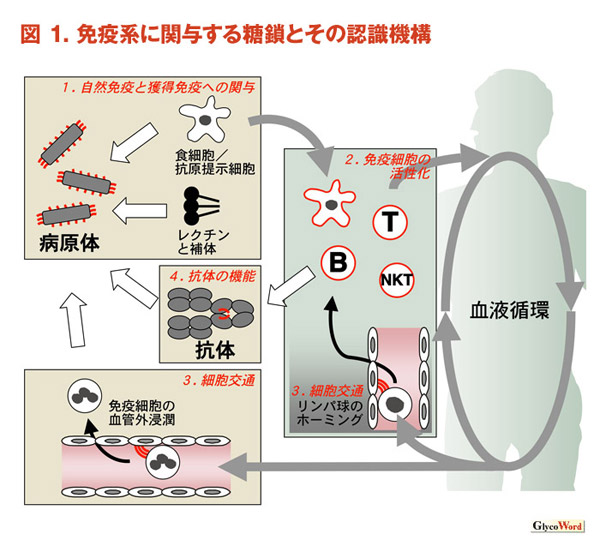
| 1.自然免疫と獲得免疫における糖鎖認識の関与 病原体や異物の認識には多様な糖鎖とその認識分子が関与しており、その多様性は両者が進化の過程でせめぎ合ってきたことを反映するものである。リポ多糖はグラム陰性菌外膜の主要な構成成分であるが、これは複合糖質の一種でありToll-like受容体などパターン認識受容体によって認識される(橋本先生「LPSとToll-like受容体」の稿参照)。侵入した病原体に対し、宿主側は液性と細胞介在性の防御機構を用いてこれを排除するが、どちらの場合もレクチンの結合によってこの引き金がひかれる。補体系は液性の免疫機構であるが、抗体の場合と同様、コレクチンやマンノース結合蛋白質が病原体に対して結合することにより、この系を作動させることができる(川嵜先生「生体防御因子コレクチン」、松下先生「マンノース結合レクチンと補体系」、若宮先生「コレクチンとウイルス」の稿参照)。マクロファージ・樹状細胞は様々な膜結合型レクチン分子を発現している。レクチンによる病原体の認識は、自然免疫の局面では食作用のために重要である。また獲得免疫の開始段階としては抗原の取り込みと提示を効率的に行うために重要である(東「マクロファージ・樹状細胞に発現するC型レクチン」の稿参照)。獲得免疫の応用の一例として癌免疫療法が試みられている。MUC1はこの癌免疫の標的分子として詳細に研究されている(中田先生「ムチンと免疫応答」の稿参照)。 |
|||||||||||||||||||||||
| 2.免疫細胞の活性化に関与する糖鎖とその認識分子 免疫細胞の亜集団はそれぞれ異なる構造の糖鎖やその認識分子を発現しており、細胞特異的マーカー、分化マーカーとしてこれを利用することが多い。さらに、このような分子が情報伝達に関与する場合もある(文献1)。細胞外のレクチンが情報伝達に関与する場合がある。ガラクトシド結合蛋白質として見出されたガレクチン3はT細胞受容体依存的なリンパ球活性化を抑制することが示されている。この際、ガレクチン3は細胞表面に結合し、その表層に格子様構造を形成すると考えられている。これ以外にもガレクチンは可溶性因子として細胞遊走、細胞接着、サイトカイン産生などの生物機能を調節する(佐藤先生「ガレクチンによる免疫制御」の稿参照)。一方、サイトカインには糖鎖結合能を有するものが多く、これが情報伝達能に影響を与えることも知られている(文献2)。複合糖質も情報伝達に関わっている。NKT細胞は、特徴的な糖脂質であるガラクトシルセラミドがCD1という分子とともに提示されることにより活性化刺激を受ける(河野・谷口先生「Vα14NKT細胞による糖脂質抗原認識免疫システム」の稿参照)。複合糖質が抑制的に働く例として、可溶性のムチン分子がマクロファージからのプロスタグランジンE2の分泌を誘導し、その結果免疫系を抑制することが報告されている(中田先生「ムチンと免疫応答」の稿参照)。シグレックはシアル酸含有糖鎖を認識する免疫グロブリン様レクチン群であるが、各々の分子は免疫細胞のうち特定の細胞種に限局して発現する。シグレックの機能については今後の解明に待たれる部分が多いが、Bリンパ球に発現するCD22とリガンドとの結合はBリンパ球の活性化に対して負のシグナルを伝達することが示されている(安形先生「シグレック」、竹松先生「CD22(Siglec-2)のリガンド発現制御」の稿参照)。 |
|||||||||||||||||||||||
 |
|||||||||||||||||||||||
| 3.体内の細胞交通に関与する糖鎖とその認識分子 抗原提示細胞となるための細胞は抗原の侵入を察知するために主に末梢組織に分布している。一方、リンパ球は全身を循環している。抗原提示の際には、両者の効率的な接触を達成するため、抗原提示細胞、リンパ球とも出会いの場であるリンパ節などのリンパ器官へ向けて移動する必要がある。一方、免疫系が実際に作動する際には、免疫細胞は炎症部位へ移動しその場で集積する。レクチンと糖鎖の相互作用はこのような複雑な細胞交通の一部を制御している。セレクチンとそのリガンドとなる糖鎖についてはその構造と機能が盛んに研究されており、糖鎖生物学、免疫学の分野で実り多い成果を収めている(今井先生の稿「接着分子セレクチン」、神奈木先生の稿「炎症とリンパ球ホーミングにおける糖鎖の意義」、平岡先生の稿「糖転移酵素・硫酸転移酵素とL−セレクチンリガンドの構築」参照)。種々の免疫細胞がリンパ器官や末梢組織等へ移動する際に遊走因子として機能するケモカインは一般にプロテオグリカン結合能を有する。ケモカインがこの分子に提示されて部位特異的に分布することが、細胞の方向ある運動の達成に重要であると考えられている(田中先生の稿「プロテオグリカンを介する接着分子とサイトカイン」参照、文献3)。 |
|||||||||||||||||||||||
| 4.抗体の機能をめぐる糖鎖の役割 抗体は液性免疫系における主要な奏功分子であるが、病原体に対して惹起された抗体が生体内や他の異物の類似糖鎖構造を認識してこれを攻撃することにより自己免疫疾患やアレルギーの発症の原因となる場合もある(楠先生の稿「免疫性末梢神経障害と抗糖鎖抗体」参照、文献4)。一方、抗体である免疫グロブリンが自身の発現する糖鎖の変化によって生化学的性状を変え、疾患の原因となる例もある。慢性関節リウマチの発症におけるIgG定常領域のN-グリカン(遠藤先生の稿「リウマチと免疫グロブリンの糖鎖異常」参照)、IgA腎症の発症の原因と考えられているIgAヒンジ領域のO-グリカンなどが例として挙げられる(文献5、6)。逆にIgG上のN-グリカンを人為的に改変することにより抗体依存性細胞傷害活性の増強に成功し、抗体医薬としての機能を改良した例もある(設楽先生の稿「抗体の糖鎖改変によるADCC活性の増強」参照)。 糖鎖とその認識機構は長い進化の過程を経て免疫系にとりこまれてきたが、近年の研究で徐々にその様子が明らかになってきた。免疫系における糖鎖の機能についての理解が、様々な免疫疾患に対する新しい治療法の開発の一助となることを期待したい。 |
|||||||||||||||||||||||
| 東 伸昭(東京大学大学院薬学系研究科) | |||||||||||||||||||||||
|
|||||||||||||||||||||||
| 2007年6月4日 | |||||||||||||||||||||||
|
|
|||||||||||||||||||||||
|
|||||||||||||||||||||||