| 接着分子セレクチン |  |
|
 |
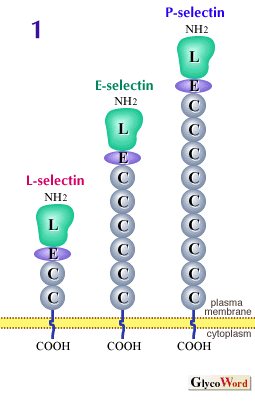
白血球の血管外浸潤は、炎症局所における生体防御機構やリンパ球のホーミングにおいて生理的に重要であると共に、炎症性疾患の病態形成においても重要である。セレクチンは、白血球と血管内皮細胞との接着に関与する細胞表面の分子で、白血球がいわば高速道路である血液循環から目的地である組織実質へ降りる(血管外に浸潤する)際に必要な分子である。C−型レクチンに属し、分子構造の共通性から細胞接着分子のひとつのファミリーを形成する(C型レクチンの項参照)。細胞外にあるアミノ末端からカルシウム依存性レクチン(C−タイプレクチン)ドメイン(L)、上皮増殖因子と相同性のあるドメイン(E)、補体制御分子と相同性のある複数のドメイン(C)、細胞膜貫通ドメインおよびカルボキシル末端の短い細胞質ドメインから構成される(図1)。 | |
|
|  | |
|
|
現在までに、3種類のセレクチンが知られている。L-セレクチンは、ほとんど全ての白血球に発現している。E-セレクチンは、サイトカイン刺激による転写活性化の結果血管内皮細胞上に発現する。一方、P-セレクチンは、もともとは活性化血小板の表面に見いだされたものであるが、血管内皮細胞上にも発現が誘導される。P-セレクチンの場合は、あらかじめ細胞内の顆粒に膜貫通型タンパクとして蓄えられており、刺激に伴って細胞表面に移動する。セレクチンの細胞接着活性は、カルシウム依存性のレクチン活性による糖鎖リガンドの認識に基づいている。原則的には、L-セレクチンのリガンドは血管内皮細胞上に、E- およびP-セレクチンのリガンドは、白血球上に見いだされる。
全てのセレクチンは、シアリルルイスXおよびシアリルルイスaをもつ糖鎖に特異的な結合活性を示すが、オリゴ糖レベルでの結合親和性は高くない。従ってセレクチンの糖鎖リガンド認識には、糖鎖を多価の形(multivalent)で提示する分子の役割が重要である。糖鎖提示分子としては、L-セレクチンのリガンド(1)として血管内皮細胞由来のGlyCAM-1, CD34, Sgp200, MAdCAM-1 が知られている。これらは、シアル酸/フコース/硫酸基を含むO-結合型糖鎖のクラスターをL-セレクチンに提示しうるムチン様糖鎖提示分子である。糖鎖上のシアル酸と硫酸基が機能的に必要であることが直接証明され(2)、ムチン型糖鎖の硫酸修飾による特異性の獲得は糖鎖生物学的に興味のある課題である。GlyCAM-1 の場合硫酸修飾されたシアリルルイスX構造の存在が明かとなっている。
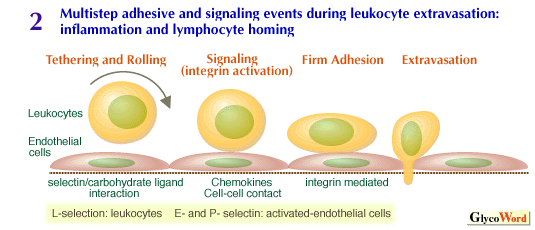
P-セレクチンのリガンドとしては、もともとは好中球から得られた(現在では、ほとんど全ての白血球に存在が認められている)ムチン様糖鎖提示分子PSGL-1が知られている。PSGL-1の場合、糖鎖部分に加えてアミノ末端近くのチロシン残基の硫酸化が、P-セレクチンとの高アフィニティー結合に必要とされている。またPSGL-1は、L-セレクチンやE-セレクチンにも結合することが報告されている。E-セレクチンに対する糖鎖提示分子としては、ESL-1が報告されており、この場合はN-結合型糖鎖の関与が指摘されている。セレクチンの生物学的な機能としては、以下のように考えられている(図2)。 | |
|
 |
|
|
炎症局所の後毛細血管細静脈やリンパ組織における高内皮細静脈を流れてきた白血球は、セレクチンと糖鎖リガンドとの間で結合と解離を繰り返して減速する。この過程を、tethering またはローリング(rolling)と呼ぶが、フローチェンバーの底にP-セレクチンを吸着させ、そこに好中球を人工的に流す実験系を用いて、ビデオカメラにより試験管内でローリングが初めて観測された(3)。生体内では、原則的に白血球と血管内皮細胞間でセレクチンと糖鎖リガンドとの間の相互作用によってローリングが起こるが、血管内皮に接着した白血球の上に白血球が2次的にローリングする現象も知られている。この現象は、好中球のL-セレクチンとPSGL-1に提示された糖鎖との相互作用に基づいている。
ローリングによって減速した白血球は、シグナルを受容し、白血球上のインテグリン分子と、血管内皮細胞上の免疫グロブリンスーパーファミリーに属する接着分子(例えばICAM-1, VCAM-1)との間のタンパク−タンパク相互作用に基づく強固な細胞接着を起こす。この過程は、白血球へのシグナル伝達の結果インテグリン分子のリガンドに対する結合親和性の上昇による。シグナルの性格としては、可溶性因子の一種であるケモカインの作用によることが見いだされてきたが、細胞同士の直接接触によるシグナル伝達(例えば、L-セレクチンやPSGL-1を介する)の可能性も指摘されている。従って、セレクチンや糖鎖リガンド分子は、細胞接着分子としてだけではなく細胞間のシグナル伝達にも役割を果たしているのかも知れない。 | |
|
| 今井 康之(静岡県立大学・薬学部・微生物学教室) | |
|
|
| References | (1) | Imai, Y et al. J. Cell Biol. 113, 1213-1221, 1991 |
| (2) | Imai, Y et al. Nature 361, 555-557, 1993 |
| (3) | Lawrence, M B Springer, T A. Cell 65, 859-873, 1991 |
| | |
| |
| 1998年 3月 15日 |
|
| |
|
|
|
|



