
氏名:浦島 匡
国立大学法人帯広畜産大学、農学博士
1986年東北大学博士取得後、帯広畜産大学畜産学部酪農化学教室に赴任、ミルクオリゴ糖の研究に従事。1991年文部省在外研究員としてシドニー大学生化学部門にて、Dr. Michael Messerの下でタマーワラビー(有袋類)の乳腺における糖転移酵素の研究に従事。以後、Messerと共同で単孔類、有袋類、いくつかの種の有胎盤類のミルクオリゴ糖の化学構造の比較研究を行う。哺乳類への進化過程で、現在の乳成分がどのように獲得されたかに興味をもち、とくにミルクタンパク質αラクトアルブミンの獲得がミルクオリゴ糖とラクトースの発生と生理的意義の変化にどのように影響を及ぼしたかの探索を生涯の研究テーマにしている。2003年より帯広畜産大学教授。現在、日本酪農科学会会長、日本糖質学会評議員、日本糖鎖コンシーシアム幹事。

氏名:佐藤 祥子
ラヴァル大学医学部・医学部付属研究所、薬学博士
千葉大学薬学部卒業。1987年より東京大学医科学研究所大学院で木幡教授の指導を受ける。その間ロンドンの国立医学研究所にてR. Colin Hughes博士の下でガレクチン-3研究行う。1994年東京大学博士号取得。ついでスタンフォード大学のDr. Ron Kopito研究室でポスドク研究員として、遺伝性嚢胞性線維症への化学療法に関する研究を行った。1999年よりカナダ・ラヴァル大学医学部感染症研究センター糖質生物学研究室主任研究員、ラヴァル大学医学部准教授。2010年同大学同部教授。2003年以降同部門Bioimaging platformの長兼任。

氏名:小林(仁尾)純子
北海道大学 大学院医学研究院 組織細胞学教室、獣医学博士
北海道大学獣医学部卒。2006年に北海道大学大学院獣医学研究科にて博士号を取得し、同年に北海道大学大学院医学研究院組織細胞学教室の助教となる。博士課程在学時より組織学が専門の岩永敏彦教授の指導のもと、さまざまな臓器におけるガレクチン発現細胞の解析を行ってきた。2010年より2年間、日本学術振興会海外特別研究員として英国エジンバラ大学のProf. W. Colin Duncan研究室でヒトの黄体と卵管のガレクチンに関する研究を行った。北海道大学に復職後、2018年に講師となる。

氏名:平林 淳
東海国立大学機構名古屋大学、理学博士
1982年東北大学修士取得後、帝京大学薬学部生物化学教室(笠井献一教授)に赴任、動物レクチンの研究に従事。1999年、GlycoXV(東京)にてグライコミクスを提起、2002年産業技術総合研究所(つくば)に異動、NEDO「糖鎖エンジニアリング」プロジェクト等に参画。2006年糖鎖医工学研究センター・副センター長、2012年幹細胞工学センター・首席研究員等を歴任。現在、東海国立大学機構名古屋大学・糖鎖生命コア研究所特任教授、日本糖質学会理事、日本糖鎖科学コンソーシアム副会長、香川大学および横浜市立大学客員教授。
本編「ミルクオリゴ糖とガレクチン」(Glycoforum. 2021 Vol.24 (2), A3)の中で、ラットミルク中のオリゴ糖のほとんどは3’-SLと6’-SLであるのに対し1,2、齧歯目のローランドパカ(Cuniculus paca)のミルクはそれ以外にもより複雑なミルクオリゴ糖を含んでいることを紹介した1。このことから直観されるのは、実験動物のミルクオリゴ糖は多様性を失い、単純化しているのでは、という考えである。一方、最近極微量ではあるが、ラットやマウスの乳にも硫酸化した3’-SLなど他のオリゴ糖も発見されている3。ミルクオリゴ糖の構造多様性はどのようにして決定しているのであろうか。「番外編」第2弾はこの点に絞って議論してみたい。
構造決定されたパカミルクオリゴ糖は図 1に示した様に、3’-SL、6’-SLの他、GalNAcβ1-4(Neu5Acα2-3)Galβ1-4Glc(GM2 四糖)、Neu5Acα2-3Galβ1-3GalNAcβ1-4Galβ1-4Glc(GM1b五糖)、Neu5Acα2-3Galβ1-3(Neu5Acα2-6)GlcNAcβ1-3Galβ1-4Glc(disialyllacto-N-tetraose;DSLNT)、 Neu5Acα2-3Galβ1-3GalNAcβ1-4(Neu5Acα2-3)Galβ1-4Glc(GD1a 六糖)、Galβ1-3Galβ1-4Glc (3’-GL)である。同定数は7種と決して多くないが、その陣容は非常にユニークである注1)。
注1)著者の一人(浦島)は、パカミルクオリゴ糖の研究では思わぬ失敗に出くわしたことがある。精製過程のミルクオリゴ糖をイオン交換クロマトグラフィーで分画後、弱アルカリ性の緩衝液に溶かしたまま冷蔵庫に放置したため、一部のオリゴ糖の還元末端が異性化反応を起こしたのである。このため、オリゴ糖の定量値に不具合が生じ、また試料も消失したため、論文投稿を断念した経緯がある。これは、塩基触媒(アルカリ性条件下)で起こるLobry de Bruyn転位によるものと考えられる。すなわち、アルデヒド基を有する還元末端のグルコース残基が1,2-エンジオール中間体を介し、フルクトースやマンノースに異性化したのであろう。一般に教科書等で述べられるLobry de Bruyn転位は単糖レベルでの現象にとどまっている。オリゴ糖レベルでは、原理的に同様の転位(異性化)が起こることは予想されるものの、実験データとしての報告例はない。ある意味貴重な観察かもしれない。

まずDSLNTだが、これはヒトミルク中にも発見される代表的な酸性ヒトミルクオリゴ糖の一つである4, 注2)。
注2)未熟児に深刻な症状をもたらす壊死性腸炎(NEC)への罹患率は、母乳栄養児の方が人工栄養児に比べて低いことは知られていたが、NECを誘導したラットを使用したin vivo試験で、DSLNTが特異的にその予防・治療効果をもつ成分であることが示唆された5。
浦島は、ヒト以外の多くの動物のミルクオリゴ糖において、Galβ1-3GlcNAcを含むI型オリゴ糖よりもGalβ1-4GlcNAcを含むII型の方が優先的であることを報告しているが6、このDSLNTに見られるようにパカミルクではヒト同様にI型優先的であるようだ。
一方、GM2 四糖、GM1b 五糖、GD1a六糖はガングリオ系列の糖脂質糖鎖構造と同一である。ガングリオ系列のミルクオリゴ糖としては、GM2四糖はバンドウイルカ7、キリン8、アカゲザルに9、GM1b五糖がヤギに10、それに加えてアシアロGM2三糖とアシアロGM1四糖がウシ10、スイギュウ10、ヤギ10、ライオン10で発見されているが、ネオラクト系列やラクト系列のものと比較するとどちらかと言うとまれなケースである。図 2に齧歯目動物の系統樹を示した。齧歯目動物は地球上で最も繁栄している哺乳動物種の一つであるようだが、ミルクオリゴ糖はほとんど研究されていない。
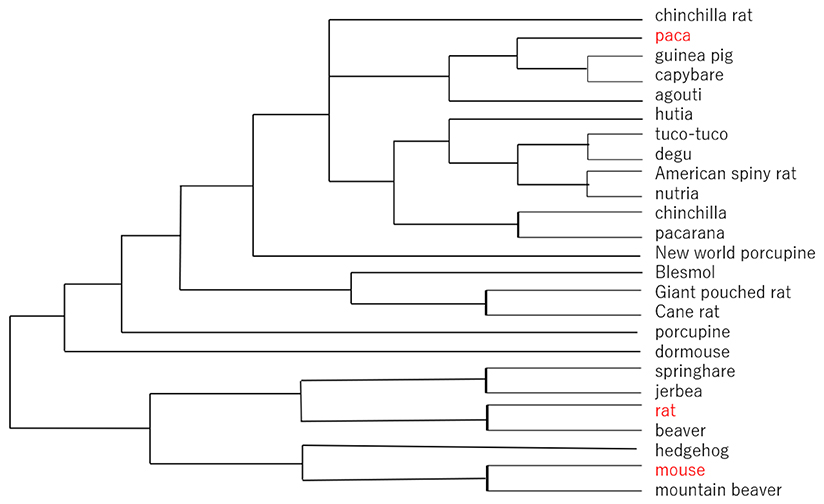
冒頭で述べたように、ラットなどの実験動物ではミルクオリゴ糖の構造が単純化している可能性が伺える。この点をもう少し検証してみよう。人工的に繁殖したラットと、ミルクオリゴ糖の成分を比較するには、野生のラット(ドブネズミ)が最適である。しかし、これは簡単になしうる実験ではない。
運良く回収された上記パカ(野生)のミルクオリゴ糖の結果を見る限り、ラットでは3’-SLと6’-SL以外が失われていることが予想される。ヒトに飼育されることにより、衛生環境も栄養環境もよくなり、複雑なミルクオリゴ糖が必要なくなったのであろうか。 ラットのミルクではシアリルラクトースの濃度は、分娩後4〜8日で16〜14 g/L (26〜22 mM)、シアリルラクトース/ラクトース割合は0.61〜0.51と驚くほど高い11。乳腺内でシアリルトランスフェラーゼ活性が高まることによって、他のオリゴ糖の生合成が抑えられた可能性がある。
一方、実験動物ではないが、長年にわたり人間と共同生活をするようになった飼い犬でも同様の現象が観察されている。すなわち、家犬のミルクオリゴ糖では2’-FL、3’-SL、6’-SLくらいしか発見できない12, 注3) 。これに対し、アライグマ、クマ、ミンク、スカンクなど他の食肉目種のミルクオリゴ糖の構造はとても複雑である13。
注3)A型四糖GalNAcβ1-3(Fucα1-2)Galβ1-4Glcは犬種によっては含まれるようである12。
したがって、まだ十分なデータがそろっている状況ではないが、実験動物や家畜のように人工的なケアが長年続いて繁殖された動物のミルクでは、シアリル化の亢進などによって構造が比較的単純化する傾向があるのはおそらく間違いない。シアリル化はラクトースから分岐や伸長が起こるのを停止させるため、構造単純化には効率的な戦略と言える。同様にH型フコシル化もラクトース骨格からの伸長や分岐を抑制する働きがある。
構造単純化の理由として考えられるのは、衛生環境の改善により多様な微生物と接する機会が減ることである。シアリル化やフコシル化が糖鎖の伸長や分岐を抑制するのであれば、これらの糖鎖修飾を担う酵素が、外界の環境の変化の影響を感じ取って、ミルクに含まれるオリゴ糖の構造を変化させるように適応進化しているのかもしれない注4)。
注4)このような例はミルクオリゴ糖以外の糖鎖生合成でも認めることができる。人工環境下で飼育され続けている養蚕(天然のカイコ)では、フィブロインなどの絹糸生産をカイコの専用組織である中部絹糸腺が担うが、ここには昆虫型のコアフコース構造(Fucα1-3GlcNAc)が一切認められない14。調べられた他の組織では、コアフコースを発現しているので、「絹糸生産に無関係なコアフコースの責任酵素は機能せずともよい」、という命令がいつの時代かに下されたのだろうか。天蚕(養蚕の先祖にあたる野生型のカイコ)における絹糸腺を調べてみれば、この回答が得られるかも知れない。
本編「ミルクオリゴ糖とガレクチン」の中で、ヒトミルクオリゴ糖(HMOs)コア骨格の推定生合成経路を掲載した1。しかし、ここで注意しなくてはならないのは、HMOsの生合成に関わる糖転移酵素の遺伝子は、直接乳腺細胞からクローニングされているわけではない点だ。中でも、後述の有袋類で優先的となるコア構造、3’-GL(Galβ1-3Galβ1-4Glc)の合成を担うβ3Gal-Tについては遺伝子の存在自体が未解決だ(図 3の”unidentified 1”)。
すなわち、ヒトをはじめとするミルクオリゴ糖の生合成地図は責任酵素(遺伝子)の同定という意味では多くが未遂なのである。泌乳期乳腺でミルクオリゴ糖の生合成に関わる糖転移酵素活性についての研究は、唯一有袋類タマーワラビーから回収した乳腺のホモゲネートを酵素源として、生化学的な方法によってβ3Gal-T、β4Gal-TおよびIGnTの活性に対して行われているのみである15,16。
多くの動物種のミルクオリゴ糖の構造多様化は、そのコア骨格の生合成に関わるIGnT(β6GlcNAc-T)の多様化によるところが大きい。本編「ミルクオリゴ糖とガレクチン」の図 2に掲載したHMO生合成経路において、実はそこに入れていないマイナーな経路の存在の可能性を指摘しておきたい1。
たとえば、HMOsの中にNeu5Acα2-3Galβ1-3[Galβ1-4(Fucα1-3)GlcNAcβ1-6]Galβ1-4Glcというラクト-N-ノボペンタオース 1 [Galβ1-3(Galβ1-4GlcNAcβ1-6)Galβ1-4Glc, novoLNP1]をコア骨格とするオリゴ糖が痕跡量ながら見出されている17。novoLNP1は、既知のIGnTとは基質特異性の異なる、未同定のβ6GlcNAc-Tによって合成されている可能性がある注5)。
注5)筆者の一人浦島は、タマーワラビーの乳腺組織にこのタイプのβ6GlcNAc-Tの活性を発見した。彼は、1991年、シドニー大学において、Michael Messerの下で同乳腺ホモゲネートを酵素源、基質として3’-GLまたGalβ1-3Galβ1-3Galβ1-4Glc(DGL)、ドナーにはUDP-GlcNAcを使用してIGnT活性に関する研究を行った16。この酵素の特徴は3’-GLのみならず、DGLをもアクセプターにすることができ、非還元末端から2番目のGalにβ1-6GlcNAcを転移して各々Galβ1-3(GlcNAcβ1-6)Galβ1-4GlcとGalβ1-3(GlcNAcβ1-6)Galβ1-3Galβ1-4Glcを生成する。またそれを前駆体としてβ4Gal-Tの働きによって生成するGalβ1-3(Galβ1-4GlcNAcβ1-6)Galβ1-3Galβ1-4Glcは、実際に有袋類ブラッシュテイルポッサムならびにイースタンクオールの乳に発見されている18, 19。乳腺細胞から分子生物学的な手法を使用して、ミルクオリゴ糖の生合成に関わる糖転移酵素の遺伝子やその複製、発現調節に関する研究は、現時点でも未解決課題として残っている。
すなわち、(いわば正統的な)IGnTがGlcNAcβ1-3Galβ1-4Glc(ラクト-N-トリオース-Ⅱ)を基質にするのに対し、後者は3’-GL(Galβ1-3Galβ1-4Glc)に対し非還元末端から2番目のGalにGlcNAcをβ1-6結合で転移する「ラクト-N-ノボテトラオース合成酵素」である(図 3の”unidentified 2”)。
この検証には、IGnT活性を有する酵素遺伝子を同定し、本酵素が、ラクトースにおけるガラクトース3位に結合した単糖(GlcNAcかGal)を識別しうるかを調べればよい。一方にのみ特異性を示した場合は、まだ未同定の他方の酵素が存在することになり、両方に特異性を示した場合は、一つの酵素が二役をこなしていることになる。
novoLNP1やその誘導体は、ヒトと異なり有袋類では主要な分岐型オリゴ糖であり、また多くの有胎盤類のミルクにも含まれる。実際、その存在はウシ20,21、ウマ21,22、ヤギ21、ヒツジ21、ブタ21、ラクダ21,23、フサオマキザル(新世界ザル)24のミルクにも確認され、有袋類と一部の有胎盤類に共通のミルクオリゴ糖であることが明らかとなっている。
有胎盤類であっても、ウマの初乳ではnovoLNP1の方がラクト-N-ネオテトラオース(LNnT)やラクト-N-ネオヘキサオース(LNnH)よりも優先的であり、ウシ、ヤギ、ヒツジ、ブタ、ラクダ初乳ではnovoLNP1とLNnTの濃度は近い21。一方、有袋類の乳では有胎盤類で主要なLNnTやLNnHは発見されていない。この事実から導かれる一つの仮説は「有袋類乳腺ではiGnTが不在、もしくはほとんど機能していない(未成熟)」ことである。
すなわち、ミルクの中でnovoLNP1をコアとするオリゴ糖が優先的か、あるいはLNnTやLNnHをコアとするオリゴ糖が優先的かは、母核となる「3’-GL」また「ラクト-N-トリオース-Ⅱ」の合成を担う「β3Gal-T」と「iGnT」のいずれが支配的かによって決まることになる(図 3)。
有胎盤類でもnovoLNP1が比較的多くみられることは、β3Gal-Tの方が進化的に先に登場した可能性を仄めかす注6)。3‘-GL合成の責任酵素、β3Gal-T(図 3の”unidentified 1”)の同定が待たれる。
注6)LNnT・LNnH、あるいはnovoLNP1、いずれの系列のオリゴ糖が優先的かについては、生物種によって異なる。大まかな観察ではあるが、有胎盤類の中で偶蹄目ではおおよそ半々、食肉目や霊長目ではLNnT・LNnHの方が優先的、奇蹄目ではnovoLNP1の方が優先的である。
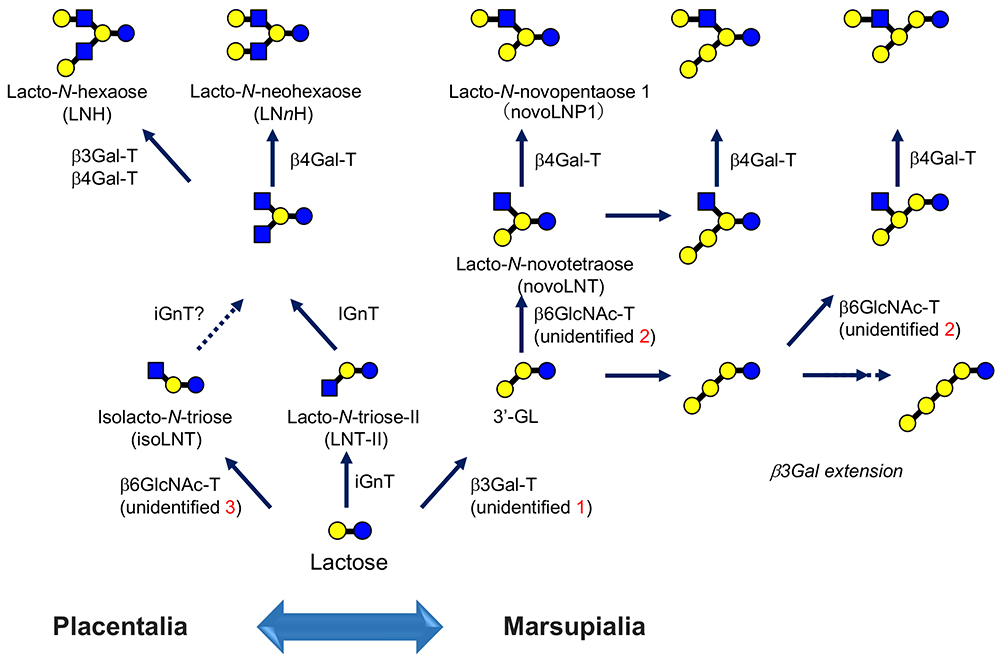
基質特異性の異なるβ6GlcNAc-Tには、実はもう1種類の存在が予想される(図 3の”unidentified 3”)。Galβ1-4GlcNAcβ1-6Galβ1-4Glc(イソラクト-N-ネオテトラオース)は、筆者(浦島)が最初にウマ初乳に発見したが25、その存在はウシ21、ヤギ21、ヒツジ21、ラクダ21、ブタ21、スイギュウ10、ライオン10にも広がっている。
この構造はGlcNAcβ1-6Galβ1-4Glc(イソラクト-N-トリオース)を前駆体として生合成されるが、既知のIGnTはラクト-N-トリオース-Ⅱ(GlcNAcβ1-3Galβ1-4Glc)を基質として、あくまでも「β1-6分岐」をつくる酵素であって、ラクトースを基質としてβ1-6鎖を形成することはできない。よって、イソラクト-N-トリオースはラクトースを基質とすることのできる「第3のβ6GlcNAc-T」(イソラクト-N-トリオース合成酵素)によって合成されている可能性がある。
以上、述べてきた3種類のβ6GlcNAc-T(IGnT、ラクト-N-ノボテトラオース合成酵素、イソラクト-N-トリース合成酵素)の関わりによって生合成されたコア骨格に、β4Gal-Tがガラクトースをフィル・インして2型ラクトサミン単位が生成する。ここにさらにiGnTやIGnTが働くことによって糖鎖は伸長、ないし分岐を繰り返し、さらに複雑なコア骨格が作られる。
また、β3Gal-Tやβ4Gal-Tの活性の強さによって、I型とII型のオリゴ糖割合が決定され、非還元末端には各種のフコシルトランスフェラーゼ、α3ガラクトシルトランスフェラーゼ、α3N-アセチルガラクトサミニルトランスフェラーゼの働きで、H抗原(Fucα1-2Gal)、ルイスa [Galβ1-3(Fucα1-4)GlcNAc]、ルイスx [Galβ1-4(Fucα1-3)GlcNAc]、A抗原 [GalNAcα1-3(Fucα1-2)Gal]、B抗原 [Galα1-3(Fucα1-2)Gal]、α-Galエピトープ(Galα1-3Gal)など、多彩なエピトープ構造を配した一連のミルクオリゴ糖ができあがる。
ミルクオリゴ糖の化学構造から予想される糖転移酵素遺伝子のcDNAを、乳腺細胞からクローニングすることは今後の課題であることは言うまでもない。そして、そのことがゲノム生物学というチャンネルを通し、ミルクオリゴ糖の関わる数多の生物現象(各種レクチンと免疫調節、腸内細菌におけるプレバイオティクス、ウイルス等微生物感染に対する生体防御、等々)の解明に大きく貢献するだろう。ミルクオリゴ糖を合成する各責任酵素(遺伝子)が同定されれば、基質特異性や比活性が明確となり、生成物予測や工業生産への道が開かれ、分子改編やインフォマティクスの援用も可能になる。
ミルクオリゴ糖は、栄養物質としての側面と情報分子としての側面を併せ持つ、ある意味モデル分子である点が強みである。プロバイオティクスとして注目されることが多いが、ガレクチンなどを標的とした阻害剤(創薬原体)としても潜在的な価値は高い。ウシ乳には無視できるくらいの濃度でしか含まれないミルクオリゴ糖、しかもヒト型のオリゴ糖を人工的に調製し、育児用調整乳などに利用しようという試みが加速している。現状ではごく限られた分子種しか利用されていないが、基礎的な知見はいずれ実用的に産業にも役立てられるようになると確信している