
氏名:小林(仁尾)純子
北海道大学 大学院医学研究院 組織細胞学教室、獣医学博士
北海道大学獣医学部卒。2006年に北海道大学大学院獣医学研究科にて博士号を取得し、同年に北海道大学大学院医学研究院組織細胞学教室の助教となる。博士課程在学時より組織学が専門の岩永敏彦教授の指導のもと、さまざまな臓器におけるガレクチン発現細胞の解析を行ってきた。2010年より2年間、日本学術振興会海外特別研究員として英国エジンバラ大学のProf. W. Colin Duncan研究室でヒトの黄体と卵管のガレクチンに関する研究を行った。北海道大学に復職後、2018年に講師となる。

氏名:浦島 匡
国立大学法人帯広畜産大学、農学博士
1986年東北大学博士取得後、帯広畜産大学畜産学部酪農化学教室に赴任、ミルクオリゴ糖の研究に従事。1991年文部省在外研究員としてシドニー大学生化学部門にて、Dr. Michael Messerの下でタマーワラビー(有袋類)の乳腺における糖転移酵素の研究に従事。以後、Messerと共同で単孔類、有袋類、いくつかの種の有胎盤類のミルクオリゴ糖の化学構造の比較研究を行う。哺乳類への進化過程で、現在の乳成分がどのように獲得されたかに興味をもち、とくにミルクタンパク質αラクトアルブミンの獲得がミルクオリゴ糖とラクトースの発生と生理的意義の変化にどのように影響を及ぼしたかの探索を生涯の研究テーマにしている。2003年より帯広畜産大学教授。現在、日本酪農科学会会長、日本糖質学会評議員、日本糖鎖コンシーシアム幹事。

氏名:平林 淳
東海国立大学機構名古屋大学、理学博士
1982年東北大学修士取得後、帝京大学薬学部生物化学教室(笠井献一教授)に赴任、動物レクチンの研究に従事。1999年、GlycoXV(東京)にてグライコミクスを提起、2002年産業技術総合研究所(つくば)に異動、NEDO「糖鎖エンジニアリング」プロジェクト等に参画。2006年糖鎖医工学研究センター・副センター長、2012年幹細胞工学センター・首席研究員等を歴任。現在、東海国立大学機構名古屋大学・糖鎖生命コア研究所特任教授、日本糖質学会理事、日本糖鎖科学コンソーシアム副会長、香川大学および横浜市立大学客員教授。

氏名:佐藤 祥子
ラヴァル大学医学部・医学部付属研究所、薬学博士
千葉大学薬学部卒業。1987年より東京大学医科学研究所大学院で木幡教授の指導を受ける。その間ロンドンの国立医学研究所にてR. Colin Hughes博士の下でガレクチン-3の研究を行う。1994年東京大学博士号取得。ついでスタンフォード大学のDr. Ron Kopito研究室でポスドク研究員として、遺伝性嚢胞性線維症への化学療法に関する研究を行った。1999年よりカナダ・ラヴァル大学医学部感染症研究センター糖質生物学研究室主任研究員、ラヴァル大学医学部准教授。2010年同大学同部教授。2003年以降同部門Bioimaging platformの長兼任。
通常、レクチンと糖の親和性はµMオーダーであるが、ミルク中には、オリゴ糖が10 mM以上、ラクトースにいたっては100 mMを超える濃度で糖が豊富に含まれる。この濃度は、レクチンの解離定数の観点からみると衝撃的な濃さであり、ガレクチンを含む多くのレクチンの糖結合活性は阻害されてしまうだろう。この阻害活性の生物学的な意味は何であろう?また、消化管内や体内でのミルクオリゴ糖濃度はどうなっているのだろう?と、いくつもの疑問がわいてくる。
そこで、今回は、ミルクオリゴ糖が生体内でどう利用され、どのような役割をはたすか、また、消化管に豊富に発現するガレクチンの機能との関係について、推測、妄想、議論を深めたい。そして、哺乳類がラクトース生合成能を獲得し、乳児の栄養源として利用したことが『哺乳類の成功の鍵』といわれる理由について、改めて考察してみたい。
本編『ミルクオリゴ糖とガレクチン』(Glycoforum. 2021 Vol.24 (2), A3)1で述べたとおり、ミルク中には高濃度のラクトースやミルクオリゴ糖が含まれる。ミルク中のラクトースは、小腸上皮細胞が産生するラクターゼによりガラクトースとグルコースに分解されて吸収され、エネルギーとして利用される。ミルクオリゴ糖、特にヒト母乳中に見られるような複雑なミルクオリゴ糖を分解する酵素は、少なくともヒトの消化管上皮には見つかっていない2,3。ミルクオリゴ糖の大部分は小腸で消化をうけずに大腸まで運ばれ、腸内細菌により利用される。
母乳栄養児では、ビフィズス菌が最も優勢な腸内細菌である。ミルクオリゴ糖は、ビフィズス菌や乳酸桿菌など生体にとって有用な腸内細菌に積極的に利用され、これらの菌の増殖促進や定着にかかわるプレバイオティクスとして働く。京都大学の片山らや新潟大学の北岡らは、ビフィズス菌がミルクオリゴ糖を分解する酵素をもつことを報告している注1)。また、ビフィズス菌の定着とともに乳児便中のミルクオリゴ糖やその代謝産物の量が減少するが4、このことは、これらの菌による利用が増加することを反映している。一方で、ミルクオリゴ糖は、シアル酸を介して腸上皮細胞に接着する有害細菌やウイルスの感染を阻害する作用をもつことも知られている注2)。
重要なことだが、後に考察するようにミルクオリゴ糖の一部は血中に吸収され、尿中に排泄される。
注1)離乳前の子の消化管で優勢なビフィズス菌にはBifidobacterium breve, B. bifidum, B. longum subsp. infantis, B. kashiwanohenseがあるが、これらの菌はミルクオリゴ糖を代謝する酵素を有する5,6。離乳とともにこれらのビフィズス菌は減少し、成人型の菌種(B. adolescentis, B. longum subsp. longum, B. catenlatum)へとおきかわる。また、ビフィズス菌にかわって、バクテロイデス菌やクロストリジウム菌が優勢となり、取り込まれた食物繊維や消化管上皮細胞が産生するムチンの分解にあずかる。離乳後にこれらの菌より産生される短鎖脂肪酸は、消化管上皮のイオン分泌を適正化するとともに上皮細胞の栄養源となる。代表的な短鎖脂肪酸には、酢酸、乳酸、酪酸がある。ビフィズス菌は主に酢酸を、クロストリジウム菌は主に酪酸を産生する7。新生マウスの腸ではビフィズス菌がつくる酢酸が正常な腸の蠕動運動の形成に重要であることが示されており、その作用メカニズムには非神経細胞由来のアセチルコリンが関与するらしい8。ミルクオリゴ糖と腸内細菌との関わりについては、グライコフォーラム“ヒトミルクオリゴ糖シリーズ (Human Milk Oligosaccharides)”を参照されたい。
注2)ミルクオリゴ糖により細胞への接着や侵入、増殖の抑制が報告されているものには、カンピロバクター菌、原虫であるEntamoeba histolytica、大腸菌、B群レンサ球菌、ノロウイルスやロタウイルスなど 小児に感染性胃腸炎や髄膜炎をひきおこす病原性微生物がある9。多くのものは細胞表面のシアル酸を認識して細胞内に侵入することから、シアル酸を含むミルクオリゴ糖はこれらの病原微生物の感染防御に役立つのだろう。シアル酸は酸性条件下でオリゴ糖から容易に解離しやすい。成人の胃は強酸性(pH 1.5-2)であるが、乳幼児は胃粘膜の発達が充分ではないため成人よりも酸性度は低い(pH 6-8)。 胃を通過する間にミルクオリゴ糖のシアル酸がはずれる可能性は乳幼児では低いと言える。
消化管は口から肛門までひとつながりの管で、食道、胃、小腸(十二指腸、空腸、回腸)、大腸にわけられる。胃では、とりこまれた食物を胃液と混ぜ合わせて粥状にし、小腸へと送る。胃につづく十二指腸では肝臓からの胆汁と膵臓からの膵液の作用により、食物を分解し、つづく空腸と回腸で栄養分を吸収する。大腸では主に水分と電解質を取り込み、不要物は便として体外に排出される。
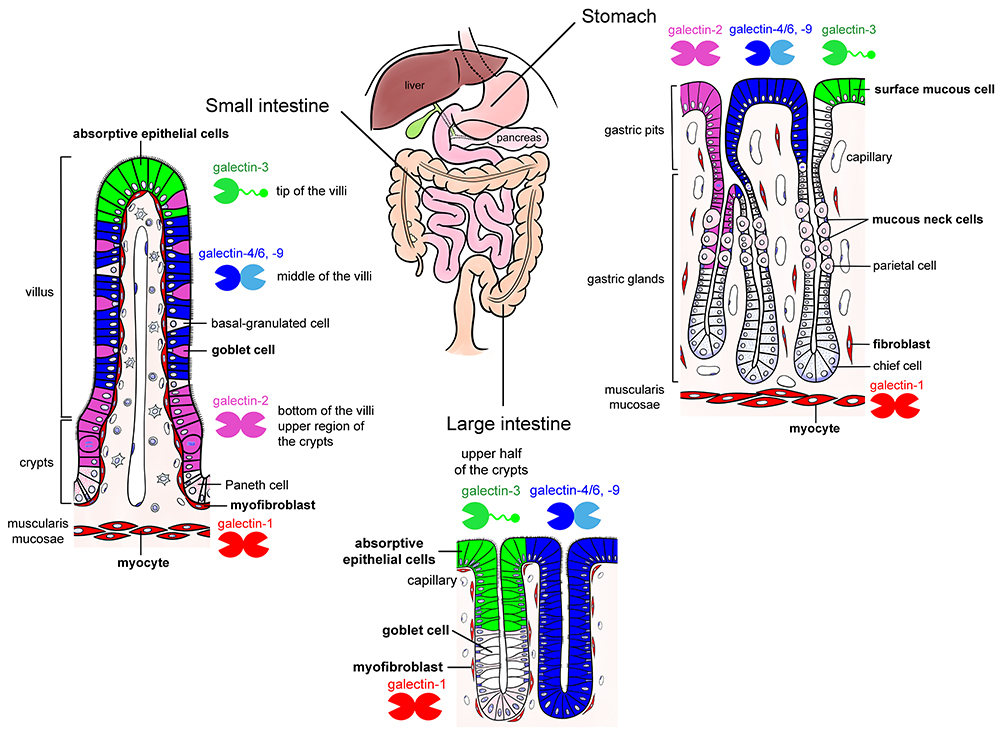
消化管の粘膜上皮は生体内で最も豊富にガレクチンを含む器官といっても過言ではない。本稿の著者のひとり(小林)は、マウスの消化管では少なくとも6つのガレクチン(galectin-2, -3, -4/6, -7, -9)が粘膜上皮に部位および細胞特異的に発現することを報告した10(図 1)。しかし、消化管粘膜上皮に発現するガレクチンの機能はよくわかっていない。粘膜上皮の分化や増殖の制御、および、感染防御における役割が示唆されている注3)。
注3)複数のガレクチンを発現する胃や腸では、粘膜上皮の分化により発現するサブタイプが変化する。例えば、小腸上皮細胞では陰窩(増殖帯があるところ)と絨毛の基部にgalectin-2が、絨毛の中央部にはgalectin-4/6およびgalectin-9が、絨毛の先端部にgalectin-3が発現する。この発現分布は、上皮の成熟にガレクチンが関与する可能性を示唆するがその機能やリガンドとなる複合糖質は明らかとなっていない。胃粘膜上皮の粘液産生細胞(表層粘液細胞と頚粘液細胞)は、ムチン型の糖タンパク質を分泌し、いずれもガレクチン(galectin-2, -3, -4/6, -9)を発現する。表層粘液細胞より産生される表層粘液はMUC5ACを、頚粘液細胞や幽門腺細胞より産生される腺粘液はMUC6をコア蛋白とする。信州大の中山らが作製した腺粘液の糖鎖末端にN-アセチルグルコサミンをα1,4結合で転移する酵素であるA4GnTの遺伝子欠損マウスでは、胃幽門粘膜が加齢とともに肥厚し、過形成から異形成、そして胃がんを発症する11。A4GnTの欠損はガレクチンが認識するN-アセチルラクトサミン構造を露出させることから、ガレクチンとの相互作用が粘膜上皮の増殖や癌化に影響することが考えられる(東京大学 角田茂ら、未発表データ)。近畿大学の朴らは胃粘膜上皮細胞より産生されるgalectin-3がピロリ菌の感染防御に関与することを報告している12。このほか、がんや炎症性腸疾患におけるガレクチンの関与が示唆されている13。
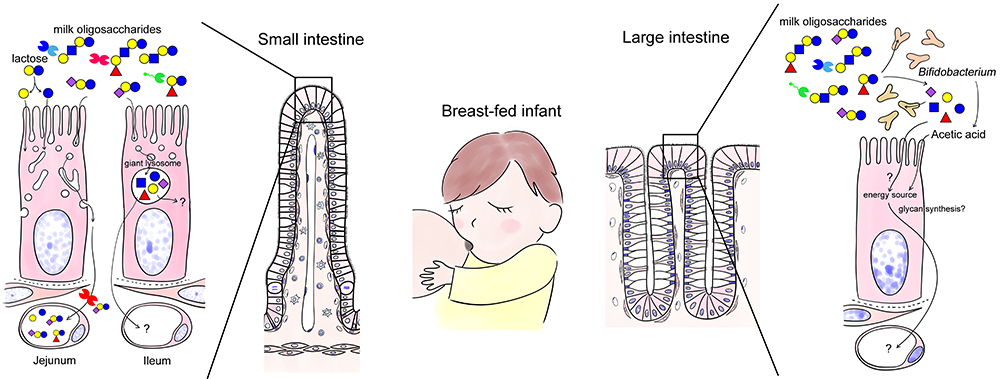
新生児(仔)や乳児(仔)の小腸上皮細胞は特殊で、管腔内の分子を積極的に細胞内に取り込む仕組みが発達している。この仕組みにより、母乳中の抗体など 巨大なタンパク分子を分解することなく取り込み、利用することができる14。ここでは、母乳由来のラクトースやミルクオリゴ糖と消化管に発現するガレクチンとの関係を考えてみたい。
前述のとおり、大部分のミルクオリゴ糖は未消化のまま大腸まで運ばれ、腸内細菌によって利用される。しかし、血中や尿中に、少なくとも1~3%のミルクオリゴ糖が消化されない状態で検出される注4)。摂取するミルクオリゴ糖全体の量に比べれば少ないが(乳中の濃度に比較して子の血漿では0.1%、尿では4%)、子の体内に取り込まれて機能することも充分に考えられる15。
ここで注目しておきたいのは、乳中のミルクオリゴ糖の濃度が非常に高いため、数%であっても100 µMを超える濃度となる点である。この濃度の高さでは、乳児体内に存在する多くのレクチン活性は阻害される可能性が高い。ヒトミルクオリゴ糖にはセレクチンのリガンドとなるシアリルルイスX構造を含むものがあり、Bodeらは、シアル酸を含むヒトミルクオリゴ糖が、白血球上のセレクチンと炎症刺激された血管内皮細胞の接着を阻害することから、炎症抑制に機能する可能性を報告している16。
注4)Giessen大学のKunzらは、13Cラベルしたガラクトースを飲んだ妊婦の母乳中および子の尿中の13C標識ガラクトースを解析し、子の尿中のオリゴ糖にその存在を確認している17。また、GoehringらとRuhaakらは、母乳栄養児の血液中にミルクオリゴ糖が存在することを報告している18,19。
ミルク中に含まれるラクトースはガレクチンが結合する糖鎖構造で、ラクトースを基本としてつくられるミルクオリゴ糖の多くはガレクチンと相互作用する20(ただし、ガラクトースの6位のシアル酸修飾やルイス構造をもつものにはガレクチンは結合しない。詳しくは本編「ミルクオリゴ糖とガレクチン」1を参照)。
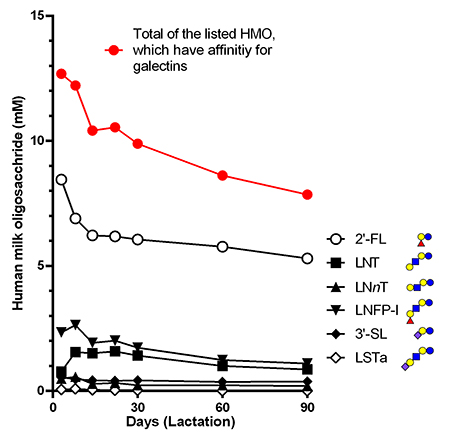
浦島らにより報告されているヒト乳中のミルクオリゴ糖のうち1、ガレクチンに親和性のあるもののミルク中のモル濃度を算出すると、合計12 mM(初乳)~8 mM(生後90日)となる(図 2)。乳中のラクトースの濃度は45 g/L(ウシ)もしくは70 g/L(ヒト)なので、モル濃度に換算すると130-200 mMという高濃度である。ガレクチンのラクトースやオリゴ糖に対する解離定数(0.01~0.1 mM)21を考えると、100倍に希釈されてもガレクチンを充分に阻害できる濃度であることがわかる。
つまり、ラクトースやミルクオリゴ糖は、ガレクチンの“剥離剤”として機能するだろう。しかしながら、その“剥離剤”が生物学的にどのような意義があるかは全く研究されていない。
はじめに述べたが新生児(仔)や乳児(仔)の小腸上皮細胞は盛んに管腔内の栄養素やタンパクをとりこむ“貪食能が旺盛な-phagocyticな”細胞である。取り込まれた分子の挙動は空腸と回腸で異なるようだ22。空腸では取り込んだ抗体などの巨大分子を消化することなく側基底側の細胞膜へと運ぶが、回腸では取り込まれた物質を核上部に存在する巨大ライソゾームに集めて消化する(図 3左)。ミルクオリゴ糖は、抗体と同じ経路をたどって血中に取り込まれると予想される(図 3左のJejunum)。
ヒト大腸がん細胞株であるCaco-2細胞にヒトミルクオリゴ糖を投与すると、中性の(シアル酸がついていない)ヒトミルクオリゴ糖は取り込まれて側基底側に移動するが、酸性の(シアル酸がつく)ものは移行しない23。ミルクオリゴ糖の大部分は未消化のまま大腸までとどくとされるが、ラットでは3’-sialyllactose(3’-SL)や6’-SL、2’-fucosyllactose(2’-FL)などは小腸で吸収され、血液循環に入るようだ24,25。
回腸で取り込まれたミルクオリゴ糖が、巨大ライソゾームで消化される可能性も考えられる(図 3左のIleum)。Jantscher-Krennらは、ラットにヒトミルクオリゴ糖を投与して、消化管の各部位におけるミルクオリゴ糖の濃度を測定している24。空腸中の濃度をみると、時間経過とともに2’-FLやlacto-N-tetraose(LNT)、 lacto-N-neotetraose(LNnT)などのミルクオリゴ糖は減少し、Lacto-N-fucopentaose-I(LNFP-I)、LNFP-II、sialyl lacto-N-tetraose b(LSTb)は増加する。一方、ガラクトオリゴ糖(ラクトースにガラクトースを人工的に結合させたもので、プレバイオティクスとして利用されている)の一部は小腸で消化され、血中に取り込まれることはない。ラットとヒトでは違うかもしれないが、糖鎖の構造により小腸で取り込まれたり消化されたりしやすいものとそうでないものがあるようだ。
摂取されたミルクオリゴ糖がガレクチンの発現に影響を与えることはあるだろうか?ミルクオリゴ糖を投与すると消化管粘膜のバリア機能が高くなり(タイト結合が強固になり)、ムチン発現量が増加する26。壊死性腸炎は、腸の発達が未熟な状態で生まれた超低体重児で多くみられる疾患で、腸への血流障害に加えて細菌感染がおこることにより腸が壊死してしまう。母乳は壊死性腸炎の予防に役立つことが知られており、これはヒトミルクオリゴ糖(特にdisialyl-lacto-N-tetraose; DSLNT)が腸上皮のバリア機能を強化することによると考えられる27。
ヒト大腸がん由来のHT-29細胞を用いた解析では、細菌由来の抗原であるCpGモチーフと2’-FLを添加すると、galectin-3, -4, -9の発現が増加する28。ガレクチンの消化管上皮におけるサブタイプ特異的な発現分布は胎生期から確立されているが29、発現の強さには新生マウスと成熟マウスでは違いがあるようだ(小林、未発表データ)。ミルク由来のラクトースやミルクオリゴ糖は、細胞外でガレクチンとリガンド糖鎖(これもまた未同定である)との結合を阻害する一方で、消化管粘膜上皮におけるガレクチンの発現を誘導もしくは抑制する可能性が考えられる。さらに妄想を広げれば、細胞内のガレクチンは、正常な消化管粘膜上皮の発達、さらに損傷したライソゾーム膜の修復やオートファジーに関与することから30、感染への抵抗性向上に寄与するかもしれない。
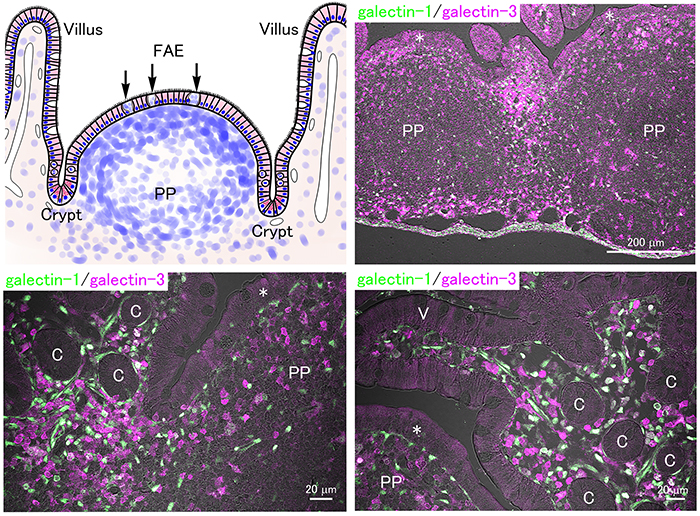
消化管は、食物からの栄養素を吸収するとともに、免疫細胞を多く含む免疫器官としても機能する。上皮下の粘膜固有層に存在する免疫細胞や回腸に存在する集合リンパ小節であるパイエル板が粘膜免疫に中心的な役割をはたす。マウスのパイエル板の胚中心は離乳後に急速に発達することから31、哺乳中は母乳由来のIgAに頼り、子の免疫機能は抑制状態なのだろう。パイエル板の濾胞上皮にはM(Microfold)細胞という特殊な細胞(こちらもphagocyticな機能を有する)が存在し、管腔内の物質を上皮下に存在する免疫細胞にうけわたして免疫応答を発動する。
成熟マウスの小腸では、粘膜固有層やパイエル板の中に、多くのガレクチン陽性の免疫細胞が見出される(図 4)。血漿中のミルクオリゴ糖濃度はそれほど高くないが(乳中の0.1%-つまり0.1 mM程度)、上皮細胞やM細胞を介して取り込まれたミルクオリゴ糖の粘膜固有層やパイエル板における局所の濃度は、ガレクチンの相互作用を阻害するには充分高いと言ってよいだろう。しかし、この可能性について直接的に解析した報告はない。
胎生期や新生児期の免疫システムはTh2液性免疫であるが、出生後にTh1細胞性免疫に移行する。この移行には小児期の細菌およびウイルス感染が大切で、将来のアレルギーリスクの低下に関与する(この説を衛生仮説という32)注5)。
ヒト初乳中のミルクオリゴ糖が、胎児の腸管粘膜によるサイトカインネットワークをTh1に誘導することが報告されている33-35。
注5) 衛生仮説とは、乳幼児期の衛生環境が個体の免疫系の発達に影響を及ぼして、その個体がアレルギーになりやすいかどうかを決めるという概念で、1989年に英国の疫学者Strachanが提唱した。乳幼児期に微生物にさらされることは、正常な免疫系の発達に必要であり、それが不十分であると将来のアレルギー疾患の発症につながる。
成熟マウスでは、galectin-1またはgalectin-3が欠損しているマウス、および、ガレクチンが結合しやすい糖鎖の合成が低下しているマウスでは、免疫システムがTh1に傾く傾向がある36-39。つまり、ミルクオリゴ糖がガレクチンを阻害することで乳幼児の免疫バランスをTh1に傾けさせることが充分に考えられる。
ごく最近、ミルクオリゴ糖を代謝できる酵素をもつビフィズス菌と乳幼児の循環血中の腸管特異的T細胞とその他の免疫細胞との関係を解析した広範な分析結果が報告された34。この分析では、腸内のビフィズス菌のミルクオリゴ糖代謝酵素の発現と、制御性T細胞などの免疫抑制系の免疫細胞の数に正の相関関係があり、さらに、Th2やTh17型の免疫応答を抑制してTh1や制御性T細胞の応答を強めるサイトカインであるIL-27の増加とも強い相関があることを報告している。
ミルクオリゴ糖を利用できる遺伝子をもつビフィズス菌を乳幼児に投与すると、全身の炎症、特にTh2およびTh17免疫反応が抑制される34。したがって、母乳栄養児では、ミルクオリゴ糖はビフィズス菌の定着を助け、免疫バランスをTh1や抑制性の免疫応答へと傾けさせるのであろう。
興味深いことに、この研究では、成人の末梢ナイーブCD4 T細胞をもちいたin vitroでのT細胞誘導において、ビフィズス菌が産生するインドール-3-乳酸(ILA)が、galectin-1およびしばしばTh1と関係する転写因子であるCXCR3の発現を誘導させることを明らかにした。このことから、ビフィズス菌によるTh1免疫応答への誘導に関わる因子のひとつとして、galectin-1を提案している34。
しかしながら、galectin-1は、Th2に免疫応答を傾けさせることが過去に報告されている。なぜなら、galectin-1は、Th1細胞やTh17細胞にアポトーシスを誘導するが、α2,6シアル酸修飾をうけた糖鎖をもつTh2細胞にはアポトーシスを誘導しないからである37。さらに、ILA処置されたTh0、Th2、およびTh17細胞で観察されたようにgalectin-1の転写上昇があったとしても34、in vivoの消化管においてはミルクオリゴ糖が細胞外でのガレクチンのレクチン活性を阻害することが予想される。とは言え、乳幼児期の免疫システムの発達におけるミルクオリゴ糖の機能に関する研究分野がますます発展し、増加すれば、ミルクオリゴ糖、ビフィズス菌、ガレクチンと母乳による免疫制御との関係がごく近い将来に明らかになることだろう。
初乳中のミルクオリゴ糖濃度は非常に高く、その後、徐々に減少する。ミルクオリゴ糖の組成も異なり、初乳中にはガレクチンが結合できる2’-FLが多く(20-40%を占める)、次いでガレクチンが結合できない6’-SLが優位になり、その後、ガレクチンが結合できる3’-SLへと変化するらしい40。
したがって、未解決な問題ではあるが、ミルクオリゴ糖が直接的もしくは間接的に免疫細胞におけるガレクチンの発現や機能を制御することで、哺乳期の免疫バランスを調節することが充分に考えられる。
消化管には、上皮にも粘膜下の免疫細胞にも豊富にガレクチンが存在するが、その機能はほとんど解明されていない。ミルクオリゴ糖は消化管粘膜の増殖や分化および機能的な変化に関与するが、これらの現象にガレクチンが関与することはないだろうか。特に、新生児(仔)期の消化管粘膜上皮の発達、腸内環境の最適化、粘膜免疫の制御に重要な役割を果たすことが予想される。余談ではあるが、尿中のミルクオリゴ糖濃度が非常に高いことも注目に値する(乳中の4%)。尿に触れる移行上皮はgalectin-3を発現するため10、ここでもガレクチンとの相互作用が予想される。
母乳に大量に存在するミルクオリゴ糖が、ガレクチンの“剥離剤”として、乳幼児体内でどのような役割を果たしているかが解明される日が来ることを願ってやまない。
さて、素朴な疑問であるが、なぜラクトースが大量にミルクに含まれるようになったのであろう。栄養源として最も利用しやすいグルコースではなく、糖転移酵素の基質特異性を変化させてまで(Glycoforum. 2021 Vol.24 (3), A6)41ラクトースとしてミルク中に分泌する必要があるのだろうか。“ラクトースの獲得は哺乳類成功の鍵”といわれるが、なぜ哺乳類はラクトースを選択したのだろうか。この点について議論したところ、論点として指摘しうるところがいくつか見えてきた。
もしもミルクに含まれる糖質がグルコースであったならば、雑多な細菌による感染を招きやすいはずだ。ビフィズス菌などの生物にとって友好的な腸内細菌はラクトースやミルクオリゴ糖をよく利用し5、ビフィズス菌が産生する酢酸が大腸菌やウェルシュ菌などの有害細菌の増殖を抑制するらしい。ラクトースやミルクオリゴ糖は、適切な(生物にとって有益な)腸内環境へと導く役割があるのだろう。
第二に、高濃度のグルコースは細胞にとって「害」になる可能性も指摘しうる。血中のグルコース濃度が高いと糖化反応が生じ、終末糖化産物が作られる。しかし、グルコースの糖化反応性は、グルコースにガラクトースなどの他の糖が転移し、グリコシド化されることで、有意に低下することがある注6)。グルコースをラクトースに再合成することにより数%という高濃度であっても身体に毒性をおよぼす危険性がなくなるのである。
注6)Shinoharaらは、糖化(メイラード反応)を、グルコースやガラクトースなどの単糖と、グルコースがさまざまな結合様式で修飾された二糖で比較した42。ガラクトースの糖化活性はグルコースよりも高く、αおよびβ1,6結合で修飾されたグルコースでは糖化活性が増加することを示した。一方で、α/β1,2、α/β1,3およびα/β1,4結合で修飾されたグルコースでは比較的糖化のリスクが低い。β1,4結合をもつラクトースの糖化活性はグルコースよりも低いことから43、ラクトースは安定な(生体にとって害の少ない)糖と言えるかもしれない。
第三に、以前より言われているように、浸透圧をあげることなく大量の糖を子に与えることができる点でも、ラクトースやミルクオリゴ糖は有効である。
最後に、グルコースのパートナーになぜガラクトースが選ばれたのであろうか?あえて妄想を深めれば、成長にあたり急激に必要とされる糖タンパク質、プロテオグリカン、糖脂質の合成に必須のガラクトースをグルコースと同時に供給するためであるのかもしれない。周知のように、乳中ラクトースは、小腸上皮ラクターゼにより分解されてグルコースとガラクトースとなる。吸収されたこれらの糖は門脈をとおって肝臓に運ばれ、そこで代謝される注7)。しかし、確認した報告はないが、一部分は消化管上皮の糖鎖生合成に利用されるかもしれない。
注7)肝臓におけるガラクトースを代謝する酵素(galactose-1-phosphate uridyltransferase、galactokinase、galactose epimerase;ルロワール経路とよばれる)の欠損や門脈の循環不全は、乳幼児に嘔吐、黄疸、下痢および知的障害をひきおこすガラクトース血症を発症させる。
ラクトースやミルクオリゴ糖を獲得したのは生物進化上の偶然であったと思われるが、選抜淘汰に有利に働いたことは間違いない41。生物というものは完璧に合理的なものではなく、なにかゆらゆらとしながら有利な方へと進化してゆくのだろう。これも一種の生命の“wobbling”(よろめき)といえる。
謝辞原稿作成にあたり、有益な情報ならびに議論へのヒントを与えて下さいました篠原康郎先生(金城学院大学)、矢島高二先生ならびに矢島昌子先生(すでに退職されているが、過去の所属は北海道大学 創成科学共同研究機構 明治乳業「乳の価値創造研究」寄付研究部門)に感謝申し上げます。
この原稿をガレクチンの多くの謎に挑戦し続けたHans-Joachim Gabius先生に捧げます。