
氏名:浦島 匡
国立大学法人帯広畜産大学、農学博士
1986年東北大学博士取得後、帯広畜産大学畜産学部酪農化学教室に赴任、ミルクオリゴ糖の研究に従事。1991年文部省在外研究員としてシドニー大学生化学部門にて、Dr. Michael Messerの下でタマーワラビー(有袋類)の乳腺における糖転移酵素の研究に従事。以後、Messerと共同で単孔類、有袋類、いくつかの種の有胎盤類のミルクオリゴ糖の化学構造の比較研究を行う。哺乳類への進化過程で、現在の乳成分がどのように獲得されたかに興味をもち、とくにミルクタンパク質αラクトアルブミンの獲得がミルクオリゴ糖とラクトースの発生と生理的意義の変化にどのように影響を及ぼしたかの探索を生涯の研究テーマにしている。2003年より帯広畜産大学教授。現在、日本酪農科学会会長、日本糖質学会評議員、日本糖鎖コンシーシアム幹事。

氏名:佐藤 祥子
ラヴァル大学医学部・医学部付属研究所、薬学博士
千葉大学薬学部卒業。1987年より東京大学医科学研究所大学院で木幡教授の指導を受ける。その間ロンドンの国立医学研究所にてR. Colin Hughes博士の下でガレクチン-3研究行う。1994年東京大学博士号取得。ついでスタンフォード大学のDr. Ron Kopito研究室でポスドク研究員として、遺伝性嚢胞性線維症への化学療法に関する研究を行った。1999年よりカナダ・ラヴァル大学医学部感染症研究センター糖質生物学研究室主任研究員、ラヴァル大学医学部准教授。2010年同大学同部教授。2003年以降同部門Bioimaging platformの長兼任。

氏名:小林(仁尾)純子
北海道大学 大学院医学研究院 組織細胞学教室、獣医学博士
北海道大学獣医学部卒。2006年に北海道大学獣医学研究科にて博士号を取得し、同年に北海道大学大学院医学研究院組織細胞学教室の助教となる。博士課程在学時より組織学が専門の岩永敏彦教授の指導のもと、さまざまな臓器におけるガレクチン発現細胞の解析を行ってきた。2010年より2年間、日本学術振興会海外特別研究員として英国エジンバラ大学のProf. W. Colin Duncan研究室でヒトの黄体と卵管のガレクチンに関する研究を行った。北海道大学に復職後、2018年に講師となる。

氏名:平林 淳
東海国立大学機構名古屋大学、理学博士
1982年東北大学修士取得後、帝京大学薬学部生物化学教室(笠井献一教授)に赴任、動物レクチンの研究に従事。1999年、GlycoXV(東京)にてグライコミクスを提起、2002年産業技術総合研究所(つくば)に異動、NEDO「糖鎖エンジニアリング」プロジェクト等に参画。2006年糖鎖医工学研究センター・副センター長、2012年幹細胞工学センター・首席研究員等を歴任。現在、東海国立大学機構名古屋大学・糖鎖生命コア研究所特任教授、日本糖質学会理事、日本糖鎖科学コンソーシアム副会長、香川大学および横浜市立大学客員教授。
本稿はグライコフォーラムVol. 24 (2)に 掲載の「ミルクオリゴ糖とガレクチン」(浦島、平林;以下、本編という)のspin-off、いわば「番外編」である。本編では賄いきれなかったテーマの延長上にある、さらなる議論や未解決課題について、ざっくばらんに、かつ自由、闊達な立場で著者らの仮説(妄想)を展開しようと思う。フォーラムという建付けをご理解の上、お付き合いいただきたい。
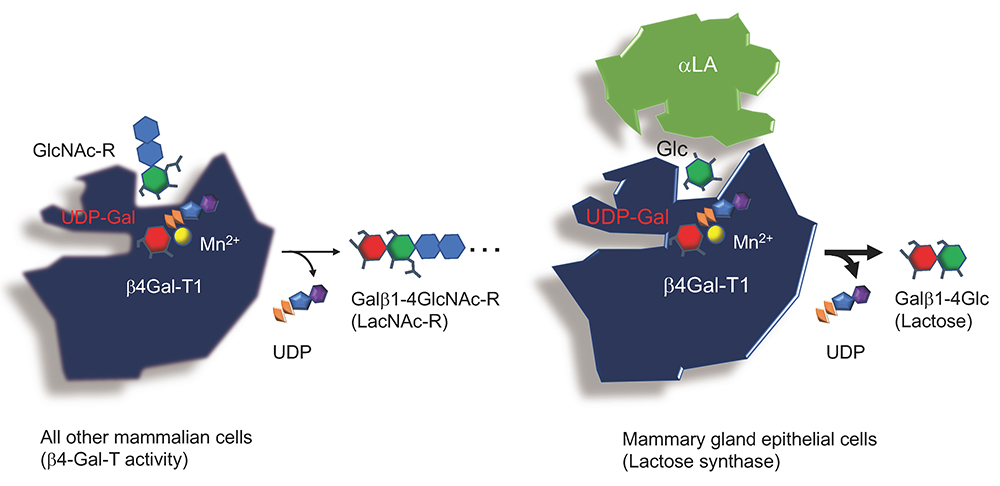
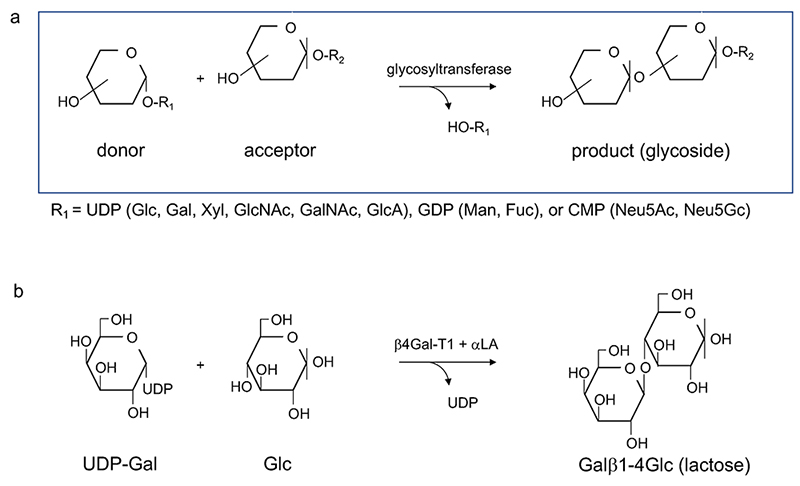
本編で述べたように、哺乳類のミルクに含まれるラクトースは、乳腺細胞内でα-ラクトアルブミン(αLA)とβ4ガラクトシルトランスフェラーゼ-1(β4Gal-T1)が会合し、β4Gal-T1のアクセプター基質がN-アセチルグルコサミン(GlcNAc)からグルコース(Glc)に変更されることによって生合成される(図 1)。
このことは、β4Gal-T1と基質との親和性に必要な立体配置は厳密なものではなく、β4Gal-T1がαLAのような他のタンパク質と会合することによって変化し、GlcNAcよりもGlcとの親和性が増したことを示している。つまり、β4Gal-T1の基質への親和性の“よろめき”(wobbling)が哺乳類新生児(仔)のエネルギー獲得の大きな一助となったともいえる。 以下、このよろめきの背景について、順を追って考察を進めてみたい。
糖転移酵素は糖を段階的に転移していく酵素の総称である。一般に転移される糖(ドナー、供与体)は単糖で、糖ヌクレオチドの形で反応に参加する。これに対し、転移を受ける方はアクセプター(受容体)と呼ばれ、オリゴ糖やグリコシドなどである(図 2)。 糖転移酵素の基質特異性は一般に高いことが知られており、この特異性の高さと糖鎖構造の多さを埋める機構として、ひとときは抗体と同様、分子内組み換えが起こることも示唆された(所謂Roseman 仮説)1,2, 注1)。
しかし、20世紀末になりそれまでは困難であった糖転移酵素のクローニングが次々に達成されていき、ことの実態が次第に明るみになっていった。また、これに追随するようにX線結晶解析などによる構造解析がなされ、糖転移のメカニズムが分子レベルで解明されていったのである。その結果、一連の糖転移酵素のアミノ酸配列と立体構造に基づく分類が可能となった。
それらを総合し経験則として言えることは、以下のとおりである。1)糖転移酵素の近縁ファミリーは糖転移に関する結合様式(α1-6結合、β1-3結合など)によって、最も厳密に区別されること、2)次に厳密なのはドナー特異性に基づく分類であり、3)最も厳密性に欠けるのがアクセプター特異性となる。
以上のルールは、構造生物学的にも十分説明が可能な観察事実である。また、興味深いことに、ドナー特異性に比べアクセプター特異性が甘い点は、一部のグリコシダーゼに観察される糖転移(trans-glycosylation)活性にも共通する性質である。ここには、おそらく、グリコシド結合の合成・分解に共通した原理が存在するのだろう。
注1)Rosemanは分子生物学の勃興以前に、糖鎖生合成の全容解明に向け大きな功績を残した研究者として知られるが、1961年にヤギ初乳にSiaα2-3(6)Galβ1-4GlcNAcα1-UDPおよびSiaα2-3(6)Galβ1-6GlcNAcα1-UDPという2種のオリゴ糖ヌクレオチドの存在を発表した3。ついで木幡は1966年にヒト乳にFucα1-2Galβ1-4GlcNAcα1-UDPの存在を発表した4。木幡はヒト乳にオリゴ糖ごと転移する酵素の探索を試みたが、発見できず今日に至っている。50年の時を経て、筆者の一人(浦島)は、ヒツジの初乳に2種のオリゴ糖ヌクレオチドNeu5Gcα2-6Galβ1-4GlcNAcα-UDPとNeu5Gcα2-3Galβ1-4GlcNAcα1-UDPを発見した5。このように、ときどきミルクの中にオリゴ糖ヌクレオチドを発見したという発表はあるものの、いつも再現よく分離できるとは限らず、その存在には個体差があるようである。浦島のグループはウシ、ヤギ、ヒツジの初乳から再びオリゴ糖ヌクレオチドの分離を試みたが成功せず、ウシ初乳からはUDP-GlcとUDP-Galが、ヤギとヒツジ初乳からはそれらに加えてUDP-GlcNAcとUDP-GalNAcしか分離できなかった6。オリゴ糖ヌクレオチドに関わった研究者は一様に努力しても報われず、50年以上の時を経ても依然としてミステリーのままである。
αLAとの会合によってβ4Gal-T1のアクセプター特異性がよろめくことは広く知られた事実であるが、おもしろいことにαLAの濃度によってはβ4Gal-T1のドナーもよろめくようである。
R. Cummingsらのグループは、牛乳に由来するβ4Gal-T1をαLAの存在下でUDP-GalNAcをドナー、GlcNAcをアクセプターとして反応させたところ、GalNAcが転移されることを発見した7。かれらは牛乳糖タンパク質の糖鎖末端に存在するGalNAcβ1-4GlcNAc(LacdiNAc)構造の生合成への関わりを予想しているようであるが、実際、牛乳の脂肪球膜に含まれるビューチロフィリンの糖鎖構造中にそのような単位が見出されている8,9。
本構造は、ウシ初乳糖タンパク質の網羅的なグライコーム分析からも発見されているが、ヒト乳の中にはほとんど検出されないようである10。また、痕跡量の遊離LacdiNAcや、関連二糖であるGalNAcβ1-4Glcもウシ初乳の中に発見されている11,12。このような糖鎖の生合成に、αLAとの会合によるβ4Gal-T1のドナー変換が関与するかどうかは興味深い点ではあるが、ミルク中でのLacdiNAc型糖鎖の存在が種特異的であることから、関与していたとしても、おそらく限定的な影響しかもたらさなかったであろう。
β4Gal-T1の研究をライフワークとするP.K. Qasbaのグループによれば、β4Gal-T1は、もともとガラクトース転移活性の0.3 ~ 0.4%の強さで、GlcNAcにGlcを転移する能力をもつが、このグルコース転移能はαLAとの会合によって約30倍高まるという13。一方、Glcβ1-4GlcNAcという糖鎖は発見されていないので、実際に生体中ではそのようなドナー修飾は起こっていないと思われる。しかしながら、αLAとの会合によってβ4Gal-T1の特異性が、アクセプターのみならず、ドナーまでよろめくという発見は「一遺伝子・一酵素説」の原則注2)を大きく揺るがす事象である。
注2)ビードルとテータムが1941年に主張した説で、一つの遺伝子が一つの酵素(タンパク質)の合成を支配しているとする説14。その後、分子生物学の発展により、例外事象も数多く発見されているが、原理的に遺伝学の根本をなす考えである。アカパンカビを用いて行ったアルギニン要求株の培養実験から導き出された。
以上、αLAとの結合によってβ4Gal-T1の基質特異性がよろめくことを述べたが、アクセプターやドナーを取り込むポケットにどのような変化が生ずるのかについては詳細に調べられている。
RamakrishnanとQasbaは、X線結晶解析とドッキングシミュレーション解析から、UDP-Gal存在下でβ4Gal-T1のコンホメーションはαLAとの会合によって変化するが、このような変化はドナーをUDP-GalNAcやUDP-Glcに変更しても起こることを明らかにしている15, 注3)。これら一連の事実から、もはや、アクセプター基質へのよろめきにとどまらず、厳密と言われたドナー特異性への神話さえも崩れかけていることがわかる。
ここで、一つの疑問が生じる。果たしてこのことは、β4Gal-T1、すなわち哺乳類の成功と密接にかかわる「ラクトース合成」に限った例外的な事象なのだろうか。また、このような基質(ドナー、アクセプター双方)に対し嗜好性シフトを誘起する分子はαLAのみなのだろうか。
たとえば、β4Gal-Tと構造が類似するとされる無脊椎動物のβ4GalNAc-Tやムチン型糖鎖の最初の転移に関与するppGalNAc-Tにそのような性質はないのだろうか。あるいは、αLA以外の比較的低分子のタンパク質や、非タンパク質性の生体分子の中に、糖転移酵素と会合することで、基質特異性を変換することのできる分子はないだろうか。
もしかして、我々は糖転移酵素の基質特異性について、人知れず先入観を抱いてしまってはいないか。ここで、多少の無謀は承知で、以下の仮説を提言する。
もし、上記仮説が正しいのであれば、β4Gal-T1以外にも基質特異性変化の分子スイッチをもつ転移酵素が存在するはずである。一方、そのような酵素が見つからない場合(これは否定の証明になるので実際は困難だが)、乳腺上皮におけるラクトース合成は奇跡的な事象であり、哺乳類成功の有力要因としてその株を上げることになろう。
注3)ドナー基質であるUDP-GalとGalNAcの差異は2位N-アセチル基の有無であるのに対し、UDP-GalとGlcの違いは4位水酸基の配向性の違い、すなわちアキシャル型(Gal)かエクアトリアル型(Glc)かの差である。結晶構造解析によると、いずれの糖の4位水酸基も同一酵素の同一残基(Glu317)によって賄われている点は注目に値する15。一般に、ガラクトース結合性レクチン(本シリーズのテーマであるガレクチンなど)がガラクトースとグルコースを同等に認識することはなく、そのため、4位水酸基に対する認識は複数のアミノ酸側鎖による厳密なネットワーク支配が効いているのが実情である。これに対し、少なくともβ4Gal-T1のドナー基質UDP-Galの4位水酸基への認識はGlu317によるほぼ「一枚岩」であり、厳密さに欠ける点を指摘しておく。
上述の経験則では、糖転移酵素の基質特異性で最も厳密さが要求されるのが、1)結合様式であり、つぎに2)ドナー特異性、そして、最も厳密性に欠けるのが3)アクセプター特異性ということであった。
このルールによれば、β4Gal-T1はαLAとの複合体形成により、Glc以外の基質にもガラクトースを転移する可能性がある。また、提案仮説で述べたように、αLA以外の成分との相互作用によっても、基質特異性の変化が起こるかもしれない。実は第一の可能性を支持する観察がある。一部の哺乳類のミルクに含まれるガラクトシル-myo-イノシトールである(図 3)。
イノシトールには9つの異性体が存在し、最も自然界に広く存在するのはmyo-イノシトールで、組成はいずれもグルコースと同じC6H12O6である。しかし、官能基であるアルデヒド基もケト基も持たないため、炭水化物(carbohydrate)の定義を満たさない。いわば「似て非なるもの」である(1,2,3,4,5,6-シクロヘキサンヘキサオールとも)注4)。
注4)興味深いことに、すべてのイノシトールは不斉炭素をもつが、鏡像異性体(D/L-体)をもつのはchiro-イノシトールのみである。myo-イノシトールはグルコースの5位の酸化(ケト化)、ケト・エノール互変異性、分子内アルドール縮合を介し、ピラノース環がシクロヘキサン環へと変遷する16。一方、なぜ、本分子がGlcの代わりにβ4Gal-T1のアクセプター基質になるのか、その恩恵(生物機能)は何なのかは現時点では明らかにされていない。
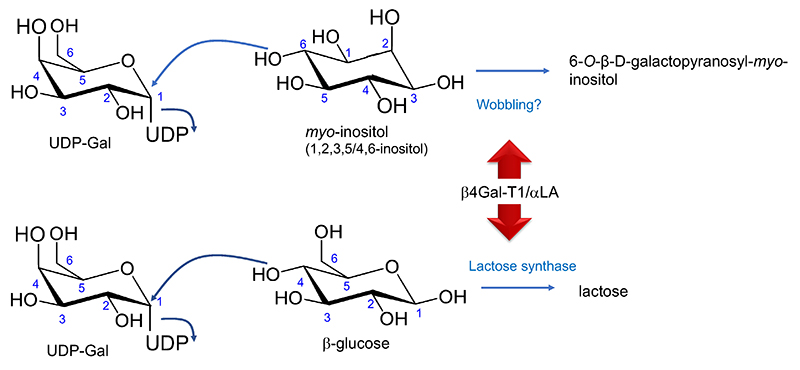
さて、ラットのミルクには、ガラクトシル-myo-イノシトール(6-O-β-D-galactopyranosyl-myo-inositol)が泌乳開始後18日の乳で0.25 µmol/mL (8.55 mg/100 mL)という高濃度で含まれるという報告がある17。この物質は最初にラット乳腺抽出液から見つかり18、その後ラットミルクにも発見されたが、他の組織には発見されなかった17。したがって、乳腺に取り込まれたmyo-イノシトールに対し、αLAとの相互作用によって親和性がよろめいたβ4Gal-T1によってつくられた可能性が高い(図 3)。この物質は実際に、αLAの存在下でラット乳腺のゴルジ膜を酵素源としてmyo-イノシトールにUDP-GalからGalを転移させることによって合成されている19。
齧歯類やイエウサギのミルクには、ラクトース以外に(ガラクトシル-myo-イノシトールではなくて)myo-イノシトールが高濃度(~30 mg/100 mL)含まれるが20、それは食餌に由来すると考えられる。myo-イノシトールを含まない食餌を与えた場合には、その含量は10 mg/100 mLにまで低下する19。食餌中のmyo-イノシトールは小腸で吸収され、循環することによって乳腺にも運ばれ、血液から血糖が取り込まれるのと同様に乳腺細胞に取り込まれたのであろう。
αLAとの相互作用によって変化したβ4Gal-T1の基質親和性ポケットにGlc同様にmyo-イノシトールが入り込むことができるかどうか、αLAとβ4Gal-T1、そしてミオイノシトールを含む結晶のドッキングシミュレーションによって明らかになるであろう。なお、ガラクトシル-myo-イノシトールは、東北大学農学研究科の斎藤忠夫教授のグループによって、ブタ初乳にも検出されている(斎藤忠夫ら、未発表データ)。
多くの哺乳動物のミルクオリゴ糖の分析を行った経験から、還元末端がGlcでも他の糖でもなく、アグリコンをもつグリコシドのようなものに巡り合うことがある。ナマケグマのミルクの中にもA型抗原 [GalNAcα1-3(Fucα1-2)Gal] を含みながら、 そのような化合物が検出された(浦島 匡、未発表データ)。ナマケグマの食餌に由来する物質に対して、同様にβ4Gal-T1の“よろめき”によって作られたのであろうか。
ひとつ、ラクトースと明確に異なる点は、ガラクトシル-myo-イノシトールには還元性もアミン類との反応性もないことである。GPIアンカータンパク質にもイノシトールが使われているが、その存在理由は分かっていない。謎の残る物質である。
生命の営みが生み出す多様性の引き出しには際限がないようだ。しかも、その仕組みは、従来規範としてきた「鍵と錠」や「一遺伝子・一酵素」という枠には収まらない。今回のスピンオフ劇場で我々が膨らませた妄想は、αLAのようなトリガーによる酵素タンパク質の分子スイッチの存在が、まだ他にもたくさんあるという可能性だ。ゲノムから予測される諸タンパク質群の機能が、現物の生体物質の組成や量比をもれなく説明できるかどうかを調べれば、その検証は行えるはずだ。すなわち、もし、タンパク質(酵素)の機能から予測しえない化合物や、生成量が観察されれば、そこには未同定の遺伝子や、今回論じた「分子スイッチ」が隠されているかもしれない。
αLAとの相互作用によるβ4Gal-T1の“よろめき”の結果、ドナーやアクセプターの分子スイッチによって、ラクトース以外の化合物もシミュレーション的には合成されることが明らかになった。その中でラクトースのみが哺乳類に普遍的に存在し、乳児への栄養源の付与という重要な機能をもたらした。本分子スイッチの発明が哺乳類進化に有利な影響を与えたことは間違いない。酵素分子の“よろめき”によって合成可能になった成分の中で、その後どのような選抜淘汰が働いたか探索することは、進化生物学に新たな視点を提供するであろう。
謝辞 原稿作成にあたり、有益な情報ならびに議論へのヒントを与えてくれた木下タロウ博士(大阪大学)、小林憲正博士(横浜国立大学)、成松久博士、佐藤隆博士、久保田智巳博士(産業技術総合研究所)、Olav Oftedal博士(Smithsonian Environmental Institute)に感謝する。