
氏名:浦島 匡
国立大学法人帯広畜産大学、農学博士
1986年東北大学博士取得後、帯広畜産大学畜産学部酪農化学教室に赴任、ミルクオリゴ糖の研究に従事。1991年文部省在外研究員としてシドニー大学生化学部門にて、Dr. Michael Messerの下でタマーワラビー(有袋類)の乳腺における糖転移酵素の研究に従事。以後、Messerと共同で単孔類、有袋類、いくつかの種の有胎盤類のミルクオリゴ糖の化学構造の比較研究を行う。哺乳類への進化過程で、現在の乳成分がどのように獲得されたかに興味をもち、とくにミルクタンパク質αラクトアルブミンの獲得がミルクオリゴ糖とラクトースの発生と生理的意義の変化にどのように影響を及ぼしたかの探索を生涯の研究テーマにしている。2003年より帯広畜産大学教授。現在、日本酪農科学会会長、日本糖質学会評議員、日本糖鎖コンシーシアム幹事。

氏名:平林 淳
東海国立大学機構名古屋大学、理学博士
1982年東北大学修士取得後、帝京大学薬学部生物化学教室(笠井献一教授)に赴任、動物レクチンの研究に従事。1999年、GlycoXV(東京)にてグライコミクスを提起、2002年産業技術総合研究所(つくば)に異動、NEDO「糖鎖エンジニアリング」プロジェクト等に参画。2006年糖鎖医工学研究センター・副センター長、2012年幹細胞工学センター・首席研究員等を歴任。現在、東海国立大学機構名古屋大学・糖鎖生命コア特任教授、日本糖質学会理事、日本糖鎖科学コンソーシアム副会長、香川大学および横浜市立大学客員教授。
哺乳動物の乳/初乳は通常主要な糖質としてラクトース(Galβ1-4Glc)以外に、各種ミルクオリゴ糖を含んでいる。その大半はラクトース骨格を還元末端側に含み、多くはガラクトース(Gal)、N-アセチルグルコサミン(GlcNAc)、フコース(Fuc)、N-アセチルまたN-グリコリルノイラミン酸(Neu5AcまたNeu5Gc)、またN-アセチルガラクトサミン(GalNAc)を構造内に含んでいる。例えばヒト乳には、12〜13 g/Lの濃度注1)の、250種類以上のミルクオリゴ糖が含まれ、そのうち現在までに170種類近くの化学構造が決定されている1。本稿ではミルクオリゴ糖の概要紹介とともに、ガレクチンにまつわる未解決問題を解決するための独自の探索ツールとしてのミルクオリゴ糖の利用可能性を展望する。
注1) ヒトミルクオリゴ糖(HMOs)の中で、主要なオリゴ糖であるラクト-N-フコペンタオース-Ⅰ(LNFP-I)の分子量853を平均分子量とすると、14~16 mMに相当、また、HMOsの多くがガレクチンに親和性を有する構造である(詳しくは論文1を参照)。ガレクチンのHMOsに対する解離定数(Kd)はおおむね10-4 Mのオーダーであることにも留意。
脊椎動物間で哺乳類を定義する特徴は「乳を分泌する動物」であるが、この性質は進化過程である時期に突然獲得されたわけではない。祖先である単弓類が獣弓類、キノドン類、哺乳形類、哺乳類へと進化したことは分類学的に受け入れられ、現在の乳成分は乳腺や乳腺細胞の形成とともに段階的に獲得された。例えばカゼインという牛乳などにおいて最大の優先的なタンパク質は、歯のエナメル質タンパク質を祖先として獲得されたと仮定されている2。乳腺細胞内ゴルジ体でβ4ガラクトシルトランスフェラーゼ1(β4Gal-T1)と会合して、ラクトースの合成に関与するα-ラクトアルブミン(αLA)は、卵白に含まれ、細菌の細胞壁ペプチドグリカンを加水分解する酵素c-タイプリゾチームを祖先として獲得された。リゾチームと進化的に関連するαLAがβ4Gal-T1と会合することによって、そのアクセプター特異性がGlcNAcからGlcに変化することがなぜ起こりえたのか不思議である。偶然の変化によって獲得された同タンパク質が、重要な機能をもたらしたことによって正の選抜淘汰を潜り抜けたと考えられる。
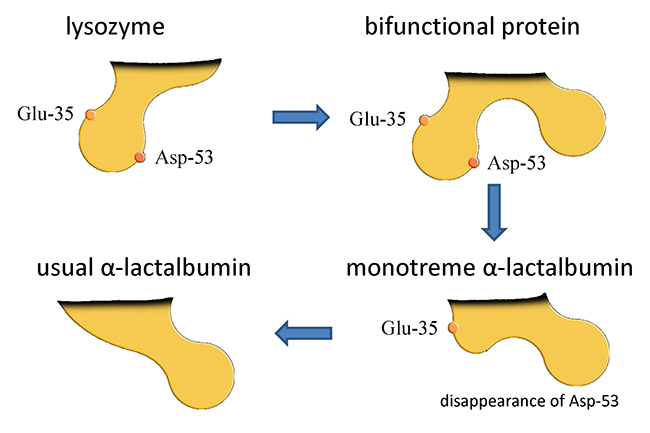
リゾチームには2カ所の触媒活性中心がある。ほとんどの種のαLAはリゾチームからの進化過程でそれを失っているが、現存の2種の単孔類、カモノハシとハリモグラのαLAは、それら2箇所のうち1箇所に相当するものを保持している。この観察に基づいて、ある時一時的にリゾチームとαLAの両方の機能をもつタンパク質が存在したと仮定される(図 1)3。αLAの出現によってラクトースの生合成が開始されたと推測されるが、実は事はそう単純ではない。乳首の不在や卵生の繁殖方法などいくつかの哺乳類祖先の原始的特徴をもつ単孔類の乳において、ミルクオリゴ糖はラクトースよりも優占的なことから予想されるように、祖先動物の乳または乳様分泌物でもミルクオリゴ糖が優占的な糖質であったと仮定される3,4。ミルクオリゴ糖は乳腺細胞内でラクトースを基質として、各種の糖転移酵素が糖ヌクレオチドから単糖を転移することで生合成されることが知られている。カモノハシとハリモグラ乳におけるαLAは、低濃度(=低発現)である。その低発現は、これらの単孔類でのラクトースの緩やかな合成速度に関係しているらしく、αLAに対する乳腺内糖転移酵素の相対的に高い発現は、カモノハシとハリモグラ乳におけるラクトースに対するミルクオリゴ糖の優占性をもたらしたと予想される注2)。
注2)ある生物種においてラクトースが優占的になるか、ラクトースがさらに修飾されたオリゴ糖の割合がより高くなるかは、多くの因子が絡む事象であり一概に論ずるのは難しい。しかし、共通祖先から単孔類と有袋類・有胎盤類の分化、続く有袋類と有胎盤類の分化という生物進化の過程で、ラクトース合成に関わる事象で明らかに変化したこととして、1)αLAの変異によるβ4Gal-T1との親和性獲得(複合体形成)、2)β4Gal-T1・αLA複合体のグルコース基質に対する親和性向上(Km低下)、3)αLAの発現量向上(以上の相乗効果でラクトース生産量はαLAを獲得した共通祖先と比べ約1000倍上昇)が挙げられる。さらに乳仔におけるラクターゼの機能向上が加味されることで、乳仔のエネルギー源が確保され、哺乳類というニッチの確立に貢献したと考えられる。一方、ヒトなどでラクトースに加えオリゴ糖が増産され、構造的多様性が増大化する要因としては、4)iGnTなど、ラクトースを基質とする糖転移酵素の乳腺上皮における発現上昇、5)それら酵素のラクトース親和性、ないし転移活性の向上、6)基質ラクトースのゴルジ内滞留時間の増長、7)UDP-GlcNAcなどのドナー基質の供給量上昇、8)関連輸送体の機能向上、などが考えられるが、いずれも推測の範囲を出ていない。今後の研究が待たれるところである。
有胎盤類においては、祖先からの進化過程でαLAの発現レベルが上昇し、大半の種の乳でラクトースがミルクオリゴ糖よりも優先的になった。授乳中の有胎盤類の乳仔では、乳中のラクトースの大部分は小腸上皮微絨毛で酵素ラクターゼの作用によってグルコースとガラクトースに加水分解される。これらの単糖は能動輸送によって細胞内に輸送され、グルコースは循環系に入るが、ガラクトースは肝臓でグルコースに変換されてから同様に循環系に入ってエネルギー源として利用される。このように、小腸ラクターゼ活性の獲得によってラクトースは乳仔へのエネルギー源として利用されるようになった。
一方、単孔類といくつかの種の有袋類はこの微絨毛ラクターゼに加え、ミルクオリゴ糖の消化に必要なフコシダーゼやシアリダーゼなどの微絨毛グリコシダーゼの活性を欠いていることが示されている。例えば、単孔類ハリモグラの乳は主要な糖質としてフコシルラクトースやシアリルラクトースを含むが、その消化には特異的なグリコシダーゼによるフコースやシアル酸の遊離が必要であろう。有袋類の一種、タマーワラビーの乳では、主要な糖質はβ1-3結合ガラクトシド構造を有しているが、その消化には特異的なβ-ガラクトシダーゼが要求される。微絨毛ラクターゼの不在から、これらの種の乳仔においてはインタクトなミルクオリゴ糖はピノサイトーシスかエンドサイトーシスによって小腸細胞内に入り、ついでおそらくオートファジーと同様のメカニズムによってリソソームに輸送された後、リソソーム酵素によって単糖に加水分解されるであろう。この仮想的なメカニズムによって、単孔類や有袋類のミルクオリゴ糖が授乳中の乳仔に、どのようにエネルギー源として利用されうるかという問題の解決がなされるであろう。
ヒトや有胎盤類の乳仔では、フコシダーゼやシアリダーゼなどの微絨毛グリコシダーゼ活性の不在から、大半のミルクオリゴ糖は小腸では消化を受けないことが受け入れられている。ヒトミルクオリゴ糖の主要部分は大腸に到達し、そこでビフィドバクテリウムのような常在性の有用腸内細菌によって代謝される。その最終生産物の多くは、エネルギー供給のために吸収されうる有機酸である。ヒトミルクオリゴ糖がビフィドバクテリウムによって代謝される経路は、近年おおよそ解析された5。ビフィドバクテリウムによるHMOsの消化には、Bifidobacterium bifidumによる菌体外加水分解とタイプⅠ(Galβ1-3GlcNAc)HMOs特異的経路による代謝と、Bifidobacterium longum subsp. longumなどのゲノムに発見されるHMOs 1クラスター(HMOsを取り込むトランスポーターと各種グリコシダーゼ遺伝子が集まったゲノム内の領域)の関わる代謝経路の二つがある。HMOs 1クラスター内の遺伝子によってコードされるβ-ガラクトシダーゼは、タイプⅡ LacNAc(Galβ1-4GlcNAc)に対する基質特異性しかもたないが、同クラスターの外側に存在する遺伝子がコードするβ-ガラクトシダーゼはタイプⅠLacNAc(Galβ1-3GlcNAc)を加水分解しうる6。ヒトのミルクオリゴ糖は霊長類含む他種と異なり、タイプⅠオリゴ糖がタイプⅡオリゴ糖よりも優先的という特徴をもつが、上の事実から、ヒトの腸内に定着するビフィドバクテリウムは、タイプⅠHMOs を資化する代謝系を獲得するように適応したことが予想される。これは、ヒト母乳においてミルクオリゴ糖の濃度が他種のものよりも高い事実と共に、ヒトとヒトの腸内に定着する腸内細菌との共生進化を示しているといえよう7。一方、HMOsはビフィドバクテリウム以外に、バクテロイデス、ユーバクテリウムによっても資化されることが発見され、離乳後の腸内フローラ形成にも関わっていることが明らかになった8。
HMOsはまた有害微生物に対する感染防御や、免疫調整機能、腸管バリア機能の強化などの機能をもつことが期待されている。HMOsによるロタウィルスなどの病原性微生物への感染防御機構は、従来上皮細胞とウィルス株、そしてHMOsを添加して培養した後に、細胞に付着したウィルスの量がHMOs添加によって低下することを観察した実験結果に基づいて、付着阻止によるものと予想されてきた。一方で、ウィルスの株によってはこのような実験によってむしろ付着量が増加し、一筋縄ではいかないらしい9。それよりも、HMOsの存在でウィルスに対するIgGレベルが上昇し、免疫強化によって感染制御が達成されるのかもしれない9,10。
一方、HMOsの上皮細胞受容体への接着がキーとなり、細胞内に情報が伝達されて糖鎖合成系が変化し、細胞表層の複合糖質や細胞表層ムチンなどの糖鎖構造の修飾が起こることも予想されている11。そのような変化によって腸管バリア機能が強化され、多くの国で未熟児に深刻な壊死性腸炎への予防効果が高まるかもしれない12。HMOsによるこのような機能(感染防御、免疫調整、腸管バリア機能強化など)のメカニズムは十分に解明されていないが、そのような効果が実際に発揮されるとしたら、HMOsと内在性レクチンとの相互作用の関与が予想される。実際、NollらはHMOsの糖鎖アレイを用いた網羅的解析で、ガレクチン13やDC-SIGN14とHMOsの一部が結合することを示している。ガレクチンの結合特異性については次節で述べる。
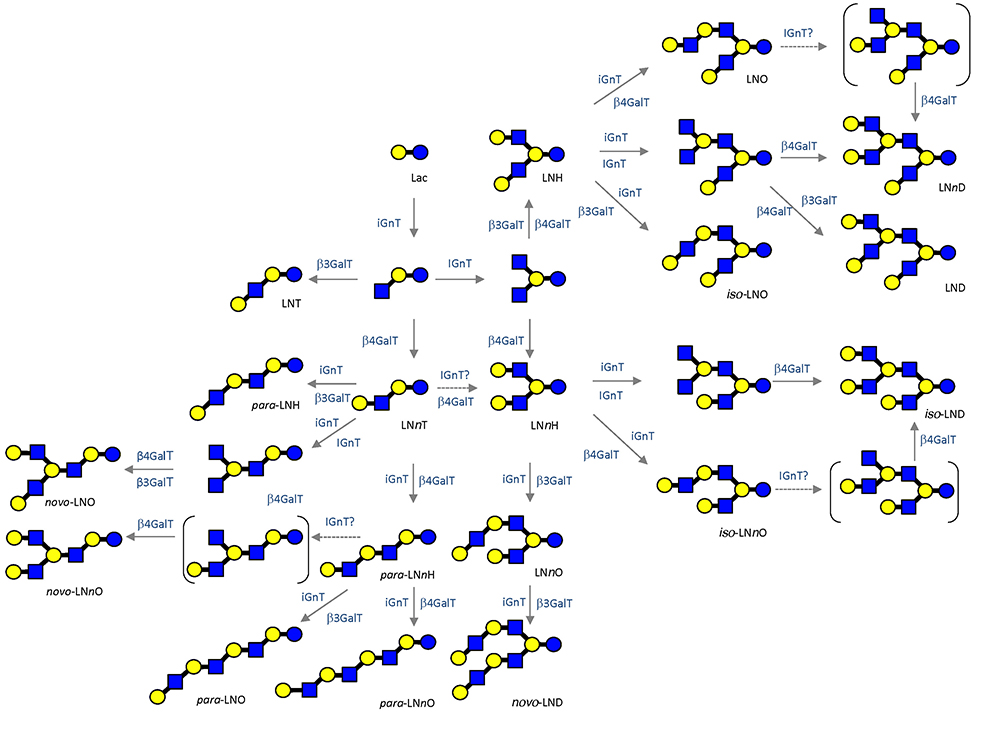
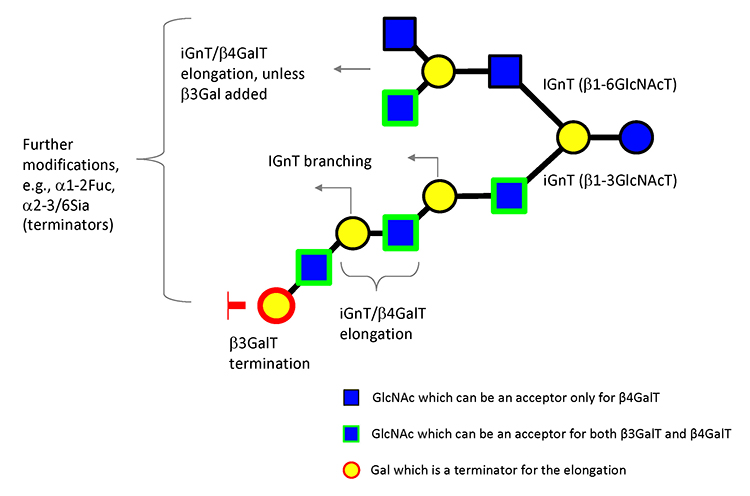
現在までに170種類近くが構造決定されているHMOsであるが、これらは各種ガレクチンがどのような糖鎖構造に対して親和性をもち、またガレクチンと生体複合糖質との相互作用が感染や免疫に対してどのような関わりをもっているかを調べるツールとして活用できる1。ミルクオリゴ糖は乳腺細胞内でラクトースをコア骨格として生合成されるが、ラクトースから先の伸長、分岐、末端修飾等は、糖タンパク質や糖脂質の生合成系にも関与する糖転移酵素系の働きによると予想される。結果として生成するHMOsの化学構造は複合糖質、とくに糖脂質の糖鎖構造に類似している。図 2に19のHMOsコア骨格の予想される生合成経路を示した1。コア骨格にはタイプⅠLacNAc (Galβ1-3GlcNAc)、タイプⅡ LacNAc (Galβ1-4GlcNAc)が含まれ、それぞれにフコースが付加することで、ルイスa(Galβ1-3[Fucα1-4]GlcNAc), b(Fucα1-2Galβ1-3[Fucα1-4]GlcNAc)、x(Galβ1-4[Fucα1-3]GlcNAc)など複合糖質の糖鎖に広く見いだされる糖鎖エピトープが形成される。HMOsと各種ガレクチンとの相互作用を解析すれば、抗感染薬や免疫調整薬などの創薬へのヒントが得られるであろう。例えば、各種のガレクチンには以下のような基本認識ルールが証明されている。すなわち、ガレクチンはタイプⅠ、Ⅱいずれにも結合するが、βガラクトシドの4, 6位が修飾されたものには結合せず、Glc(NAc)の3位ないし4位が修飾されたもの(ルイス系)にも結合しない(図 3の灰色で示した二糖部分)。一方、βガラクトシドの3位が修飾されたものは、ガレクチンによってはその修飾の影響で格段に高い親和増強を示すものがある。このことは、特に生理機能との観点、ガレクチン阻害薬開発の観点から重要である13。このような基本ルールは、ラクトサミン骨格(分岐と反復、タイプⅠ/Ⅱ)にフコースやシアル酸修飾が起こったとき、ガレクチンが結合できなくなる、あるいは結合が増強されることを意味している(図 3)15,16。この知見を得て、HMOsはガレクチン機能への有用なツール、創薬への足掛かりとして利用できる。そして分離精製・構造決定されたより広範囲なHMOsとの相互作用を研究することで、より緻密なガレクチン阻害薬の設計が可能になるであろう17。
一方、HMOsは一部吸収されて体内循環することが証明されているので18、循環過程でガレクチンやセレクチンとも相互作用することが予想される。ヒトに特徴的なタイプⅠHMOsの優先性は内在性ガレクチンの特異性と関連し、例えば、乳児の生存に有利なホメオタシスに影響を及ぼす可能性はないだろうか。最近、HMOsの主成分であるLNFP-Iとバクテリア模倣物として知られるCpG DNAの同時刺激によって、小腸上皮からのガレクチン遊離が促進されることが報告されている19。ヒトの初乳中にはガレクチンと結合しうるHMOsが多く存在するばかりでなく、その実行濃度(消化管上皮到達時、数mM〜数10 mMオーダーを想定)を考えると、乳児消化管上皮に発現したガレクチンとの相互作用は不可避に思える。また、ガレクチンは一様にHMOsに結合するのではなく、シアル酸やフコース修飾の有無、その結合様式の違い、さらにはタイプⅠ、タイプⅡ LacNAc構造に対する嗜好性など、分子種ごとに異なる性質を示す。これらの知見は、消化管上皮に多く発現するガレクチンの、乳児における機能を考えるうえで重要なヒントを与えるかもしれない。

ミルクオリゴ糖が腸内細菌叢の形成や免疫調整などにどのように関わるか、ラット、マウスなどの実験動物を使用した試みも期待される。ラットのミルクオリゴ糖はNeu5Acα2-6Galβ1-4Glc (6’-SL)がほとんどを占め、極めて単純である20。一方、シアリルラクトースの濃度は分娩後4〜8日で16〜14 g/L(26〜22 mM)、シアリルラクトース/ラクトースの割合は0.61〜0.51と驚くほどに濃度もラクトースに対する割合も高い21。前節で述べたように、ガレクチン一般はシアリルラクトースのうち3’-SLにのみ結合する(6’-SLには結合しない)。加えて、前者への結合力がサブmMオーダーであること(ガレクチン3の場合、Kd=0.56 mM)を考えた場合、消化管上皮に発現するガレクチンが3’-SL などのMOsと相互作用し、何らかの生理機能を発揮する可能性がある。授乳中のラット小腸組織にはリソソーム由来と考えられる強いノイラミニダーゼ活性が検出されるので、乳中のシアリルラクトースの少なくとも一部は、ピノサートーシスまたエンドサイトーシスによって細胞内に輸送されてから、リソソーム内消化を受けると予想される22。シアリルラクトースのどの程度の割合が吸収されるかは不明であるが、吸収されるものと大腸に移行するものとの割合を測定することは、シアリルラクトースとガレクチンとの相互作用を検討するためにも重要である。
一方、同じく齧歯目のパカの乳にはそれ以外の複雑なオリゴ糖が発見されたので(浦島ら、未発表データ)、ラット、マウスの場合は実験動物として選抜が進められた結果、ミルクオリゴ糖も単純化したものと思われる。神戸大学の大澤教授のグループは授乳ラットの糞便から分離したEnterococcus gallinarumが、3’-SLをN-アセチルノイラミン酸とラクトースに加水分解することを発見した20。このことは、同菌種がミルクオリゴ糖の代謝を通じて腸内フローラ形成の鍵となっていることを示唆する。ヒトの場合、複雑なミルクオリゴ糖の代謝を通じてビフィドバクテリウムを中心とするフローラが形成されるが、上の事実はヒト固有のミルクオリゴ糖と腸内フローラの獲得を示唆していて、大変興味深い。一方、ガレクチンは上皮細胞に多く分泌される。例えばガレクチン-3は上皮細胞の上部側(アピカル)、ガレクチン-4は側底側(バソラテラル)に多く分泌される23。ラット腸管において、シアリルラクトースがこれらガレクチンとの相互作用によって、腸管免疫調整などのどのような生物機能を担っているか、in vivo含めた今後の研究が期待される。
一方ミルクオリゴ糖には、動物種間での多様性が広く観察される。HMOsにはA抗原(GalNAcα1-3[Fucα1-2]Gal)、B抗原(Galα1-3[Fucα1-2]Gal)またα-Gal(Galα1-3Gal)などの単位は見つかっていないが、クマなどの他の動物種のミルクオリゴ糖には広範囲に見いだされる24。有袋類のミルクオリゴ糖にはユニークなGalβ1-3残基が直鎖につながったガラクタン様構造が発見されている24。このような変わったミルクオリゴ糖も5節で述べた基本認識ルールを満たすため、各種ガレクチンとの親和性解析に利用される。このガラクタンは中央アジアで深刻な感染症を引き起こす原虫Laishmania majorの表層エピトープ構造と共通するが、実際、ガレクチン3や9との親和性が確認されたので、同原虫が宿主に進入するのに、それらを標的とすることが予想された25。この発見から原虫感染予防薬へのヒントが見えてくるかもしれない。
このように、ラクトースやミルクオリゴ糖は哺乳類の乳腺の進化によって獲得された後、多様に発展し、各生物群に特徴的な構造バリエーションを拡大させてきた。一方、これら構造多様化したミルクオリゴ糖は、ガレクチンを含む一連の内在性レクチンと相互作用することで、腸内細菌や乳児にとってさらに有利な機能を発揮するようになったのかもしれない。進化と機能の全容を解明することは、また糖鎖創薬という新たな産業を産み出すヒントにもなるであろう。