
Hans-Joachim Gabius
Hans-Joachim Gabiusは、ドイツ、ゲッチンゲンにあるマックスプランク実験医学研究所においてF. Cramerの指導の下、アミノアシルtRNAシンテターゼが持つプルーフリーディングのメカニズムに関する化学的・生化学的研究で1980年に修士号、1982年にPhDを取得した。1981年には、カリフォルニア大学サンディエゴ校のJ. Abelsonのラボで多くの時間を過ごし、tRNAのスプライシングを研究した。ゲッチンゲンのマックスプランク研究所で1983年に腫瘍レクチン学(tumor lectinology)の研究を開始した後、カリフォルニア大学サンディエゴ校のS. H. Barondesのグループでのポスドク期間(1984年~1985年)、およびマールブルグでの創薬化学の准教授(1991年)の職を経て、ルートヴィヒ・マクシミリアン大学ミュンヘン、獣医学部の生理化学研究所長(1993年)となった。糖鎖科学に関する書籍の編集にいくつも携わっており、The Sugar Code: Fundamentals of glycosciencesという教科書が2009年に出版されている。実績として、700以上のPubMedエントリ、30,000近い引用数、および89というh-factorをこれまでに積み上げている。
レクチンは、糖鎖にコードされた情報を生理活性に変換するプロセスにおいて中心的な役割を担っている。様々なレクチンは糖鎖認識ドメイン(CRD)の折り畳み構造に基づいて分類されるが、個々の構造単位は、一連の糖鎖と相互作用する以外にも多くの機能を有しているようだ。特定のアミノ酸配列エレメントはCRDの機能プロファイルを拡張することができるようであり、このことはガレクチンのCRDにおいて原理証明されている。つまり、特定の配列が、活性や立体構造、四次構造に対する分子スイッチとして機能するだけでなく、さらに、タイプの異なる結合パートナーに対して相補的領域を提供することも可能になる。その結果、CRDは思いも寄らない多機能性を獲得できるのだ。このような可能性をさらに検討・検証することで、「なぜガレクチンが、シグナル配列を持たずに分泌されるタンパク質の小さなグループに属しているのか」といった、重要な未解決問題の答えが得られるかもしれない。CRDが糖との結合に必要な部分以外にも、多様な構造エレメントで構成されている可能性を教えてくれる貴重な事例研究である。また、公衆衛生上重要な知見として、 コロナウイルス(SARS-CoV-2を含む)の宿主接着分子(ウイルス―スパイクタンパク質)にガレクチン様の折り畳み構造が含まれることが挙げられる。宿主遺伝子の一部をウイルスが取り込んだとすれば、上記議論は、我々を襲うパンデミックの脅威に対抗する革新的な治療法を見出す契機となるかもしれない。
遺伝コードという概念の登場によって、生化学的なオリゴマーやポリマーは、分子の相補性によって「読み出されるメッセージ」として捉えられるようになった(認識過程)。遺伝コードの場合、生命が持つ第一のアルファベットであるヌクレオチドが、複製、DNAからRNAへのコピー、タンパク質の生合成を可能にするコーディングプラットフォームを構成する。生命が持つ第2のアルファベットはアミノ酸であり、核酸(遺伝子)の配列に「書かれている」情報が、タンパク質の配列へと「翻訳」される。このように遺伝コードは、ヌクレオチドをベースとしたメッセージを有している言語を、タンパク質というクラスの言語へと変換するのである。
自然界には、あらゆるところに存在し、量的にはこれらの分子を上回っている第3のクラスの生体分子(アルファベット)が 複合糖質である1。糖というアルファベットは、糖関連の酵素機構にオリゴ糖や多糖を生産させるための分子基盤となっている。これらの糖類は、細胞内で複合糖質として産生され、糖鎖としてタンパク質や脂質と結合していることが多い。また、多くの直鎖状および分岐状の糖鎖は、細胞外から到達しやすい細胞表面や細胞外マトリックスに存在しているため、分子間相互作用を担いやすい。核酸やタンパク質と同様に、これらの生体分子も糖をベースとして生物学的な情報を保存・伝達するシグナルシステムを構成できる。このシステムにおいても、分子の相補性が情報のフロー(糖鎖の場合、糖鎖コードという言語から、実際に細胞生物学的な効果を引き起こす認識プロセスに至るまで)に関与することになる。
当初は、次の引用文にまとめられているとおり、「糖鎖の特異的認識に基づく生物学的現象は、核酸やタンパク質の現象に比べて、(まだ)あまり注目されておらず2」、「糖鎖の機能が、個体や分子レベルの生物学および生化学のあらゆる側面に深く根ざしていることがわかってきたのは、ここ数年になってからのこと3」である。なぜこのような事態になっているのか、不思議に思う読者もいるかもしれない。その答えは「ゲノミクスやプロテオミクス、機能プロテオミクスが著しく発展したこの時代に、糖鎖生物学が他の分野に大きく遅れをとっているのはなぜか、と同僚からよく訊かれる。答えは簡単で、複合糖質がタンパク質や核酸よりもはるかに複雑かつ多様であり、研究が難しい4」ということである。しかし、これほどまで構造が複雑なのは「自然の気まぐれ」によるのだろうか。それとも糖鎖を「多目的なツール」にしつらえる鍵だからなのだろうか5。
実際、細胞に存在する数多の糖鎖構造(グライコーム)は、生化学的なフィンガープリントにも似て一見神秘的でさえある6-9。しかし、糖鎖コードという概念を通して見直すと、そこには機能的に重要な意味が秘められていることに気付く。核酸やタンパク質と比べ、特段の化学構造上の特性を備える糖である。さらに、タンパク質生合成を担うリボソームに相当するほどに洗練された細胞内小器官であるゴルジ体という糖鎖合成エキスパートの組立ラインの中で、最小限数の糖「文字」を使って「(オリゴ糖の)メッセージを書く」ことができるのである。このことは、生化学的コードとして糖鎖が最適であることを示している。ペプチドとは対照的に、糖鎖を設計する場合には単に糖の配列だけでなく、アノマーの立体配置(α/β)や各グリコシド結合の接続位置といった、他の構造パラメータの利用も駆使できる。サイズ的な小ささに比して構造的多様性が豊富という特性は、細胞表面に異なる意味を持つ多種多様なシグナルの提示を容易にする。このことは、糖鎖が多目的なツールとなるための前提条件なのである。糖鎖とタンパク質の間に分子相補性があることで、暗号の「選択」および糖鎖にコードされた情報の「読み取り」というプロセスが生じる(このはたらきが「レクチン(lectin)」という語の語源であり、ラテン語の動詞legereに由来10)する。この認識が接着や増殖といった細胞活動の基盤となっている11-14。
「レクチン」に関する現在の定義は、単に糖鎖に結合するタンパク質である。そしてこの結合活性は、糖鎖認識ドメイン(CRD)と呼ばれるモジュールが担っている15。生理学的に重要な点は、この構造単位が別のタイプのモジュールとパズルのように組み合わさり、ハイブリッド(マルチモジュールタンパク質)を形成することである。この形のタンパク質は、レクチンの中でも、C型レクチンやガレクチン、シグレックなどの分子家系(ファミリー)によく見られる。構造的に多様な組み合わせが存在することで、機能的にも多様な扉が開かれる。その結果、例えば、炎症時にはたらく強力な細胞接着分子(セレクチン)に特徴的な分子レベルの長い触手(柄)を構築したり、コレクチンやフィコリン、ガレクチン-3(Gal-3)において可逆的な自己会合を生じる分子のりとして機能するコラーゲン様リピートを利用したりできるようになっているのだ2,16-19。
「CRD」という語は、糖鎖結合領域を構成するフォールディングの特性によって構造的に定義されている。重要な点は、単に構造的な単位としてだけでなく、機能的な実体を担うと解釈されていることが多いことだ。CRDを文字通り「一連の糖鎖に対する受容体」と厳密にドグマ(教義)的に捉えるのは適切ではない。CRDの機能をくまなく探求する際に、はじめからこのような制限を設けてしまうと、レクチン(ガレクチン)の機能を見逃がしてしまうことになりかねないからだ。ここでは代わりに、このドメインが、生物機能に関わるCRD内の様々な残基/領域をパズルのように組み合わせ、そして一体化する、多目的用途を生み出すプラットフォームであるとの考えを提唱しよう。
明らかに、(レクチンまたはガレクチンの)CRDは、i)糖鎖リガンドとの接触部位以外にも(かなり)多くの部位で構成されており、ii)糖鎖との結合以外にも(かなり)多くの機能を有していると考えられる。ここではまず、原理証明した事例として、ガレクチンCRDについて紹介する。次に、CRD内に分子スイッチが存在することを示す最初の事例を示し、最後に「選択」と「読み取り」の多様性が見られる例を示す。単にタンパク質と接触するだけでなく、2種類のカウンターレセプター(糖鎖およびタンパク質)に同時に結合したり、これらの部位が共同で機能したりすることも可能なのである。
ガレクチンファミリーの構造的基盤を成しているのは、6つ(S1-S6)および5つ(F1-F5)のβ-ストランドが織りなす2枚の逆平行β-シートから構成されるβ-サンドイッチ(ゼリーロール)モチーフである20,21。代表例を図1 Aに示したように、このユニットが2つ結合することでホモダイマーとなり、(プロトタイプの)ガレクチンの特徴である格子形成や生物シグナルを伝える架橋が形成される22。Sequence signatureと呼ばれる保存された7つのアミノ酸のセットは、ガレクチンを見分ける際の共通部分だが、実際、古典的な糖リガンドであるラクトースとの構造的な分子相補性を担っている。結合部位におけるそれらの空間的な位置は、まるで糖鎖で鍵をかけるための錠前としてあつらえたかのような配置になっている(図1B、C)。戦略的とも思えるのは、中央のTrp残基がラクトースを構成する2つの糖のうちガラクトースのB面とC-H/π 結合を形成することができ、さらにアキシャルな4'-ヒドロキシル基およびガラクトース環外のCH2OH(C6'位)への水素結合が、C6'位に置換がなければだが、このエピマーを(マンノースおよびグルコースと区別して)特異的な認識を確実にしていることだ(したがって、ガラクトース残基へのα2,6-シアル酸付加はこの認識を阻止する)。ファミリー内のタンパク質(ほとんどの場合)に見られるこれら保存アミノ酸の周りには配列上のバリエーションがあるが、これは糖鎖結合領域の構造の個性に関わっている。構造と親和性の関係をフロンタルアフィニティークロマトグラフィー23などにより体系的に探索することで、このレクチンファミリーに属するタンパク質について、前述の配列変化に起因する糖鎖結合プロファイルの特色が明らかにされている。さて、ガレクチンの精製や構造解析、さらに配列比較や特異性に関するアッセイへと研究を進める上でたいへん重要であった知見がある。それは、組織抽出物中のβ-ガラクトシド依存性赤血球凝集活性を維持するには、還元剤(ジチオスレイトール)の存在が不可欠であるという観察結果である。この活性は、デンキウナギおよびラットの臓器について最初に記述されたが、さらにニワトリの胚(胸筋)において顕著であった24-26。この先駆的な研究がきっかけとなり、化学的な変化に基づくガレクチンCRDの分子スイッチが発見され、さらに詳細が調べられることになったのである。
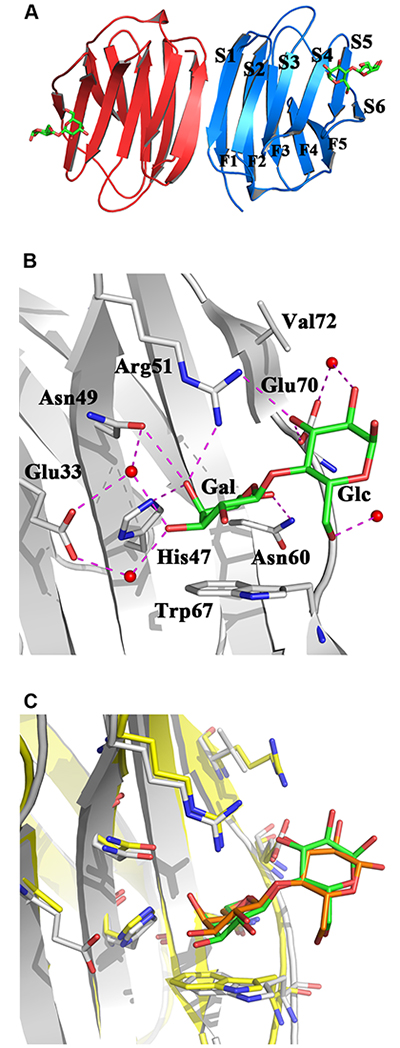
赤血球凝集素としての活性(ガレクチンが赤血球の間に架橋を作ることで凝集させる作用)が酸化により失われる現象の分子基盤を探していくと、どうやら説明の方法は1つではなさそうだということがわかってきた。最初に精製されたガレクチンであるエレクトロレクチン(デンキウナギElectrophorus electricus由来)にはCys残基が無いが、分子中心にあるTrpがオキシインドールへと酸化されることが、このガレクチンが酸素に対して脆弱である原因とされている27。興味深いことに、オキシインドールの生成およびβ-ガラクトシド結合活性の大きな低下は、どのガレクチンにも認められるわけではなく、これら2つのプロセスの関連は未解明である。哺乳類および鳥類におけるプロトタイプの(ホモダイマーを形成)ガレクチンでは、Cys残基が関与しているようであり、関与のしかたもおそらく異なっている。すなわち、Gal-1および-2に関しては、分子内にジスルフィド架橋が生じることや、スルフヒドリル基がスルフェン酸やスルフィン酸、さらにはスルホン酸へと酸化されることが原因と考えられている28-31。しかし、化学変化に基づく分子スイッチがこのような形で提唱されてはいるが、メカニズムの詳細はまだ完全には明らかになっていない。例えば、互いにかなり離れているスルフヒドリル基同士、特にGal-1のCys2/Cys130間にどうやってジスルフィド架橋が形成されるのか、そしてこの変化がどのようにホモダイマーの解離やラクトースに対する結合性の喪失を引き起こすのかは未解明である。真に注目すべきは、ガレクチン間において、それぞれのCys残基は特異的な形で作用する可能性が高いということである。ひとつ言えることだが、ヒトGal-1の場合、糖鎖との結合にCys残基は必要ない32,33。エレクトロレクチンにCysがないと述べたが、Cys不要という点ではこのタンパク質にも同様のことが言える。関連して、high-mobility group box 1(HMGB1)タンパク質のようなアラーミンとの類似性は(そして、注目すべき点として、ガレクチンは、アラーミン34,35のように非古典的な形で分泌された後、自然免疫における役割を担っている)、何かしら両者につよい関連性があることを語りかける。つまり、スルフヒドリル基の様々な酸化状態は、「アラーミン、化学誘引、または寛容という相互に相いれない3つの機能にライセンス付与する」のではないか36。さらに付け加えることとして、ニワトリのガレクチン(CG)-1Bに関する事例を挙げよう。このレクチンでは、CRD内(Cys2-Cys7)やCRD間(Cys7-Cys7')においてシスチンを生成するため、分子の形状を大幅に変化させることが可能だ30。このようにCys残基は、レクチン活性のスイッチや、四次構造、全体の形状などの性質を明らかにする上で、改めて注目されているのである。
Cys残基に加えて、アミノ酸の化学的な性質に基づいた別のタイプの分子スイッチがつい最近発見された。ヒトGal-7に関するNMR分光学的シグナルのアサイン過程で、2つの立体構造異性体の存在が明らかになったのである。これらの異性体の起源は、Pro4を含むペプチド結合のシス/トランス異性化に起因している37。現時点では、このタイプのスイッチ(すなわち、シス/トランス異性化)が、一連のオリゴ糖(または別のタイプのリガンド;以下を参照のこと)に対する結合特性に影響を与えるかどうかについてはまだわかっていない。このような場合には、アロステリックエフェクターのように、シス/トランス異性体間の平衡がシフトすることで、結合パートナーに対する親和性が調節されるのだろう。ガレクチンのアロステリーの事例は、マンノースとコンジェリンP(マアナゴConger myriasterから見つかった第3のガレクチン)38に対して初めて見出された。しかし、その後の事例、ヒトGal-3 39のCRDのケースでは、糖鎖以外のリガンドとして合成化合物(カリックス[4]アレーン)への結合が見出されたのである。興味深いことに、この場合の結合部位はガレクチンがβ-ガラクトシドと結合するS面ではなく、空間的に離れた反対側のF面が担っていたのである39。これまでの研究が重視してきたのは糖鎖結合に関することなので、このF面が注視されることはなかった。今後は新たなリガンド結合部位として記されることになろう。ガレクチン間における配列の多様性が、上で述べたsequence signatureと関係していることも同様に重要である(図1B、Cに示した結晶構造中の7つのアミノ酸に関する情報、および図2Aに示したアラインメントを参照)。β-ガラクトシド特異的な結合の喪失を補うように、新たな受容体の特性がCRDに生じる可能性がある。実際、ガレクチンは現在、複数クラスの生体分子に対して特異性を持つタンパク質として認知されつつある。このように、ガレクチンのCRDには互いに協調可能な2つの部分があり、さらにラクトースに対する接触部位は、タンパク質のカウンターレセプターに相補的な領域へとも変換可能なのである。
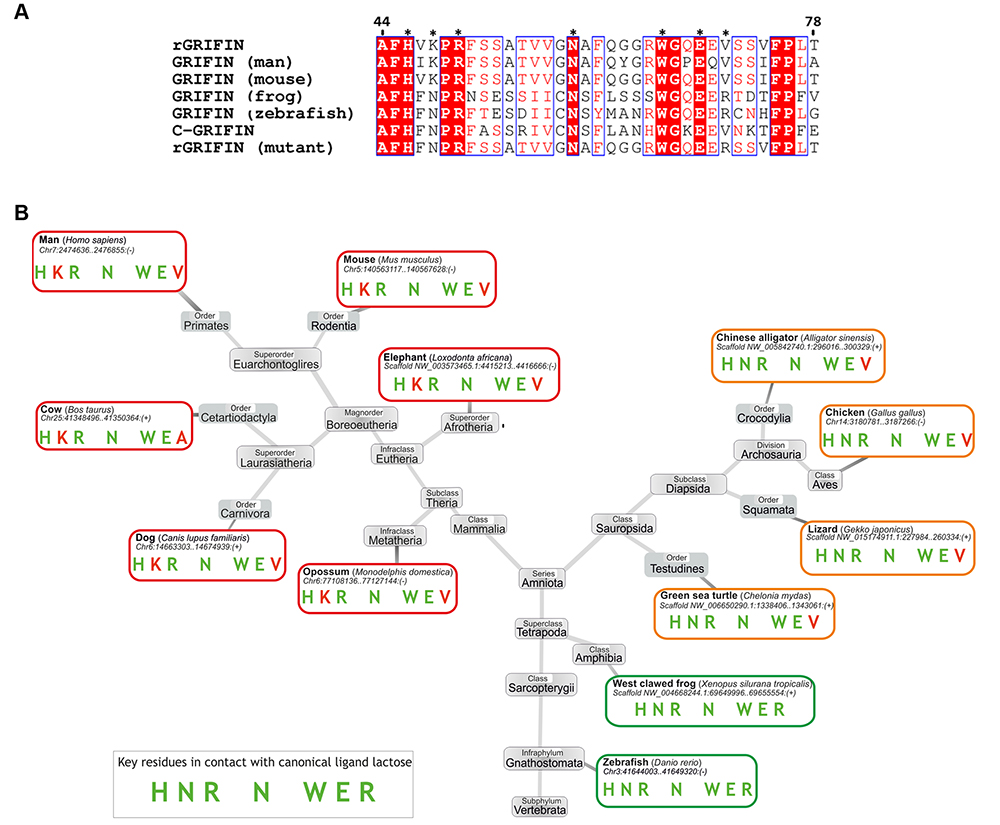
ガレクチンによるタンパク質結合解析は、Gal-3がヒト白血病T細胞に対してアポトーシス誘導への抵抗性を示すという観察から始まった。特にガレクチン配列の中に見られるNWGRモチーフとBcl-2ファミリー(アポトーシスの抑制に関与)と呼ばれるタンパク質メンバーとの間に、抗アポトーシス活性と配列類似性が認められたことが端緒となり、Bcl-2、Gal-3間にラクトースによって阻害される接触関係の存在が示された40,41。ガレクチン-タンパク質間の特異的な関係については他にも報告例がある。たとえば、溶液中においてケモカインCXCL12とGal-3が複合体を形成する様子が、詳細な構造解析で示されている42。また結晶中において、Gal-8のC末端側のCRDが、オートファジー受容体NDP52と複合体を形成する様子も調べられている43,44。さらに、目の水晶体に存在するガレクチン(GRIFIN)は、クリスタリンと相互作用して、水晶体の「生物学的なガラス」形成に寄与しており45、原子レベルでの研究が待たれている(注:図2に示すように、このガレクチンは、哺乳類においてsequence signatureからの逸脱が見られるが、鳥類ではそのような逸脱は見られない)。相互作用のパートナーの素性や、オートファジー、免疫調節、タンパク質の密なパッキングといった関与するプロセスの数々から、ガレクチンが関わる基本機能がどういった次元のものであるかが理解できよう。次の段落では、細胞内においてガレクチンが担っている、膜の完全性の保護者(guardian)としての驚くべき役割を紹介する。
興味深いことに、ガレクチンはその生合成が細胞質で起きることが、内膜の完全性を監視する役割を担う宿命とつながっている様だ。内膜の損傷により、正常であれば腔内に(隠れて)存在するはずの糖タンパク質の糖鎖の露出が起きた時、ガレクチンはその露出した糖鎖を認知することで、細胞内小胞の損傷を感知し、それに基づいて助けを求める。露出した糖鎖と結合することで橋渡し役として機能し、オートファジー/修復機構の構成要素(例えば前述のNDP52など)と複合体を形成し、ガレクチンを糖鎖リガンドに加え、タンパク質性カウンターレセプターと戦略的かつ協調的に会合させるのだ46,47。CRD上にある2つの部位を介して2種類の結合パートナーとのブリッジングを起こすという現象としては、細胞外で、Gal-3のF面にケモカインが、S面に糖鎖が結合するという上述の前例もある42。このように、細胞内および細胞外におけるタンパク質(および糖鎖)のカウンターレセプター認識に関する研究は今後、成長領域となろう。
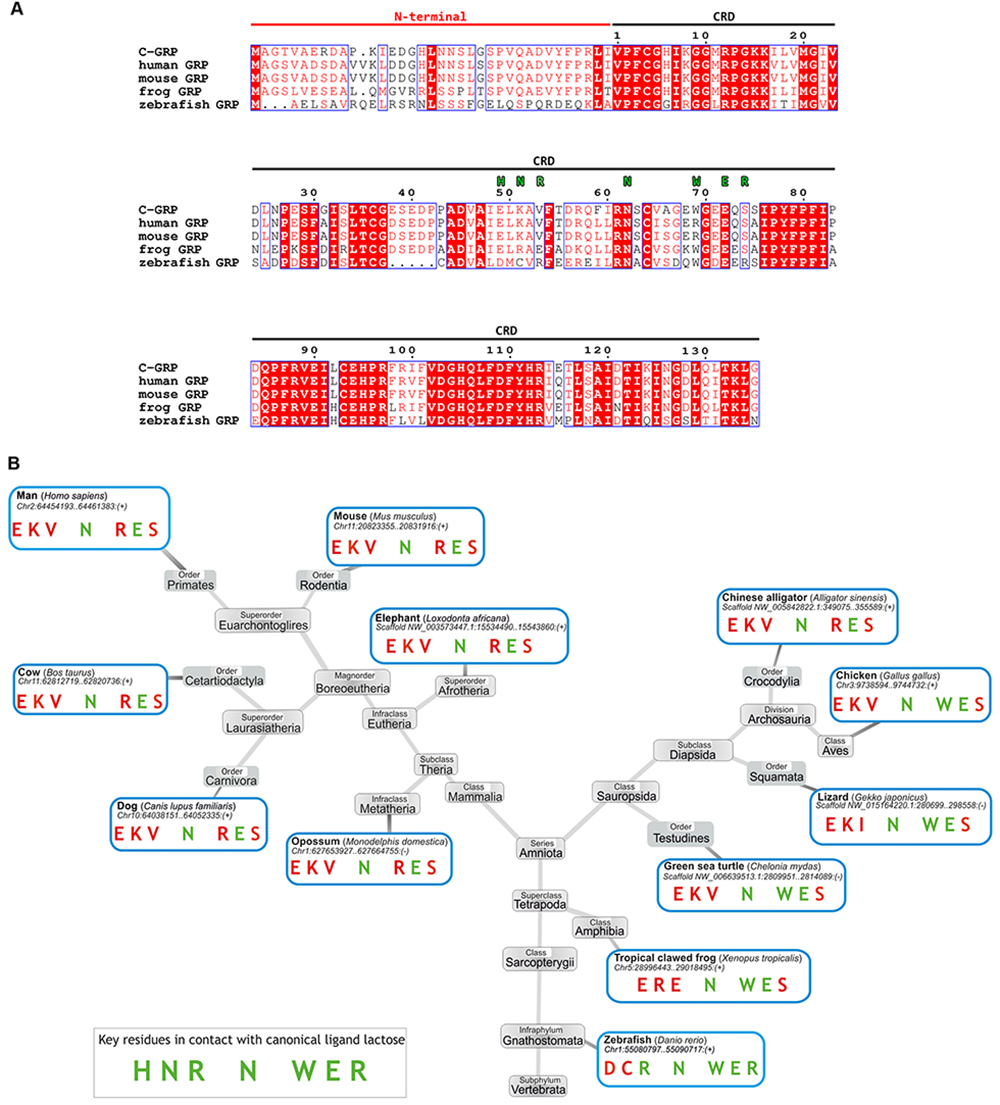
この文脈においては、とりわけガレクチンファミリーの新メンバーに(いわゆる)signature sequenceの相違が認められるケースが多く、ガレクチンCRDのもつ生物機能にも幅が膨らみそうだ48。興味深いことに、キノコのガレクチン(Coprinopsis cinereaのガレクチン関連レクチン3)においては、TrpからArgへの置換によってラクトースへの結合性が失われ、その代わりにキトオリゴ糖およびジ-N-アセチル化ラクトサミン(LacdiNAc)に対する結合能が高くなることが明らかにされている49。このような結合能の喪失と(GalNAcに対する)新たな結合能の獲得は、キノコ(Agrocybe cylindracea)のガレクチンACGにおけるPro45でのシス/トランス異性化によっても引き起こされる50,51。脊椎動物でも、TrpからArgへの置換がガレクチン関連タンパク質(GRP)において見られる。これに関する系統関係を図3に示した52。このような性質が、このファミリーのタンパク質にとって何を意味するのかは、まだ明らかではない。特筆すべきは、GRPの配列が様々な動物種間でこの上なくつよく保存されていることである。このことは、「自己や他のタンパク質、さらに特定のリガンドと重要な相互作用に関わる多面性のあるタンパク質をコードする遺伝子で一般に認められるように、コード配列全体が非常に強い正の選択下にあることを示唆している」48。では実際、この特別なCRDが何とどのように相互作用しているのか。これを明らかにすること、すなわち上記、正の選択が生じる理由をぜひとも解き明かしていきたいものだ。
ウイルスや原生動物にガレクチンと同じ折り畳み構造を持つタンパク質を探すといった研究にも同様のことが言える。例として、ロタウイルスが持つウイルス表面のスパイクタンパク質VP4のN末端フラグメント(VP8*)に対する結晶解析が挙げられる53。ウイルスの宿主細胞に対する接着、およびそれに引き続く膜の通過の際に利用されるこのモジュール型受容体は、「宿主由来のガレクチン様CRDが祖先型の膜相互作用タンパク質に挿入されて」誕生したと考えられる(53)。ウイルスの宿主接着因子に関する研究では、次のような知見もある。ガレクチン様のβ-サンドイッチ構造に配列上の変異が生じ、さらに異なる宿主の(糖)タンパク質リガンドに対する結合特性が変化するという事象は、同様に、様々なコロナウイルスのスパイクタンパク質にも認められるのだ。この観察から、ガレクチンの折り畳み構造がこのタイプの接着因子の構造単位として利用されているのではないか、という仮説が導き出される54。これは、ガレクチンに限ったケースではなくCRD一般に広く認められる事象である。なぜなら、哺乳類レクチンの中でもうひとつの大きなファミリーであるC型レクチンのCRDに関し、寄生性細菌やウイルスの接着因子/インベイシン構造との類似性が明らかにされているからだ。「これらは、ハイジャックされた宿主タンパク質、あるいはそれを模倣したタンパク質であり、動物宿主との相互作用に関与している」とのことだ55。ウイルスの脅威に対抗するために、ガレクチンに関する研究から得られた経験を生かすならば、上記仮説に基づき(コロナ)ウイルスの(ガレクチン様)宿主接着分子と細胞側のカウンターレセプターとの間のコンタクトを妨害する有効なアプローチを探すべきだろう56。
糖が内包する情報の「読み手」(レクチン)について構造的特徴を調べていった結果、折り畳み構造の全体像が明らかになった(各構造の一覧については57-59参照)。定義上、それらに共通する特性は糖鎖リガンドへの結合である。ガレクチンのほか、C型レクチン23,55やマンノース-6-リン酸受容体(P型)相同性(MRH)ドメインを持つレクチン60のような他のタイプの糖鎖受容体に見られるように、糖鎖に対する特異性は、遺伝子重複およびその後の多様化によって一ファミリーであっても相当に幅広い。また、配列が多様化するなかで、糖鎖結合モチーフがタンパク質結合モチーフへと変わることもある。さらに、ガレクチンのF面において示されているように、CRDの他の部位がこの特性を持つこともあり、結果としてタンパク質および糖鎖結合という生産的かつ協調的にはたらく2つの魅力的な機能を持ったタンパク質が生まれるのである。さらに、Cysの酸化やシス/トランスプロリルペプチド結合の異性化などによる分子スイッチは、結合特性にも影響を与えそうだ。ガレクチンに関する事例の代表的なものを示すことで、CRDが糖質への結合を超えた機能を持っている可能性に気付いてもらい、その仮説を探ってもらおうと考えた。この意味において、本稿で示した情報は、包括的な理解を得るための研究の方向性を提示するものである。総合的なレベルに理解を深めるため、以下のことが具体的に必要である。化学的変化に基づく分子スイッチが出現するというコンセプトの検討、その分子的性質と動作様式の体系的な解明、CRDの接触およびカウンターレセプターの同定、そしてパズルのようなCRD内構築様式と各ガレクチン機能相関の評価である。ガレクチンの細胞内および細胞外の使命の数々や、簡潔にまとめられた研究の現状報告61、および特異性を生み出す分子レベルの鍵62を解き明かすことは、今後も刺激的で非常にやりがいのある挑戦であり続けるだろう。そして、このような「ガレクチンに関する未解決問題」に答えることは、間違いなく「ガレクチン研究史におけるエポックメイキングな出来事」の過程に敷かれるマイルストーンとして認知されるだろう63。
謝辞およびコメント
示唆に富んだ議論をしてくれたB. Friday博士、A. Leddoz博士、およびA.W. L. Nose博士に感謝の意を表する。文献が十分に網羅されていない点についてはお詫び申し上げる(コンセプトの概要とその展望に焦点を合わせるためである)。