
氏名:甲野 裕之
国立高等専門学校機構 苫小牧工業高等専門学校教授 博士(理学)
1993年北海道大学工学部応用化学科卒業、1995年北海道大学大学院工学研究科修士課程修了、北海道総合研究機構・工業試験場、ブルカージャパン(株)を経て、2007年苫小牧高専准教授、2019 年同校教授。構造多糖類(主にセルロースとキチン・キトサン)の機能化とその構造機能相関の関係解明に従事。受賞:セルロース学会林治助賞(2017)、応用糖質科学会技術開発賞(2020)など。
キトサンからヒドロゲルを合成するには、物理架橋法、もしくは化学架橋法が用いられるが、合成の簡便さと構造安定性の点で化学架橋法に優位性がある。多糖を分子間架橋するには、グルタルアルデヒド、エピクロロヒドリン、等が広く使用されているが、環境および生体毒性の点で懸念がある。またクチナシ果実から得られるゲニピン1をはじめ、天然物架橋剤は存在するものの、コストの点で産業利用には限界がある。近年、多糖2‒5やオリゴ糖6,7を酸化して得られるポリアルデヒドが架橋剤として利用できることが報告され、その生体安全性等も確認されつつある8,9。本稿では、安価な砂糖(スクロース)を酸化開裂して得られる酸化スクロース(OS)に焦点をあて、OSの分子構造とOSを用いたキトサンおよびその誘導体を原料としる多糖ヒドロゲルの特徴について紹介する。
ヒドロゲルは、親水性高分子が化学的または物理的に架橋された三次元ネットワーク構造を持ち、構造を維持したまま水や生理食塩水を大量に吸収して、構造内部に保持することができる。水分を多く含み、天然組織と同様の柔軟性を持つことから、薬物・遺伝子送達、組織工学、治癒、化粧品製造などの生物医学・医薬プロセスに広く使用されている10‒13。ヒドロゲル調製に採用されている様々なマトリックスの中で、キトサンとその誘導体は非毒性、生体適合性、生分解性、生理活性、抗菌特性、粘着性など優れた素因を有しているため、生体材料として世界的な注目を集めている。最近では生体に注入可能なキトサンヒドロゲルが注目を集め、埋め込み手術の代替として、簡便かつ低侵襲なインジェクタブルキトサンヒドロゲルが有効な手段となりつつある14,15。ヒドロゲル合成と洗浄過程では非毒性かつ生体安全性が保証される必要があり、特に高反応性な架橋剤の安全性が重要となってくる。
酸性条件下で多糖やオリゴ糖に対して過ヨウ素酸酸化を行うと、炭素‒炭素結合が酸化開裂し、高分子アルデヒドが生成する。例えばセルロースの場合、モノマーであるグルコース残基のC2‒C3結合が酸化開裂して2,3-ジアルデヒドセルロ―ス2が生成する。同様なポリアルデヒド誘導体がアルギン酸ナトリウム、デキストラン、ヒアルロン酸、ペクチンから得られることが報告されている3‒5。しかし多糖ポリアルデヒドは、その構造中にアルデヒド基を大量に有しているが、高分子かつ傘高い骨格構造であるため、架橋反応に関与するアルデヒド基は極めて少ない。よって一般的に架橋効率が低く、反応後生成物中に未反応アルデヒド基が残存する。一方、スクロースを酸化開裂して得られるOSは、低分子量かつ水に対して高い溶解度を持ち、既存の化学架橋剤と同様の方法で架橋化が達成できる。現在までにコラーゲン、ゼラチン、トウモロコシたんぱく質であるゼインの架橋化により、これら構造たんぱく質の物理・化学的特性の向上が報告された8,16,17。OSは揮発性が無く、環境毒性を示さない。またOSで架橋化した足場たんぱく質の細胞培養研究によって、OSの生体適合性と生体安全性が立証された8。
OSはスクロース水溶液に過ヨウ素酸ナトリウムを添加することで合成できる(図 1)。副生成物として生じたギ酸、ヨウ素酸ナトリウムをイオン交換樹脂処理、バリウム塩添加による沈殿操作で除去し、精製後の水溶液を凍結乾燥することで、白色粉末のOSを得ることができる。
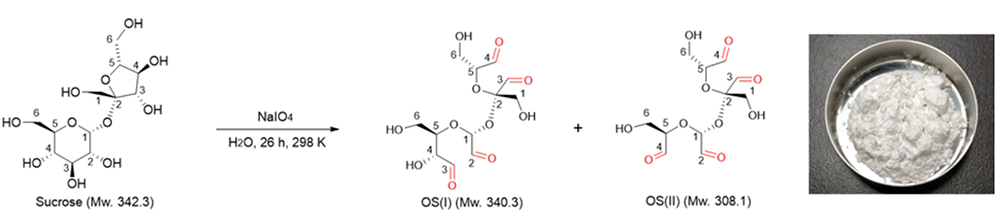
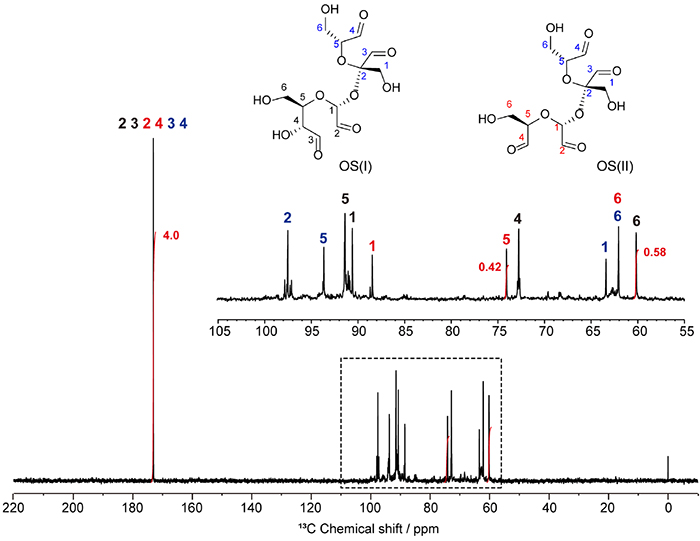
最近までOSの構造は、フルクトース残基とグルコース残基の複数炭素‒炭素結合が酸化開裂した複雑なアセタール異性体混合物であると考えられてきた。最近、筆者らはOSの分子構造解析を実施し、二種類のテトラアルデヒド誘導体OS(I)、OS(II)混合物であることを明らかにした(図 1)。OS(I)とOS(II)は、ともにフルクトースのC2‒C3結合が酸化開裂し、グルコース残基の酸化状態が異なる。OS(I)はC2‒C3結合が酸化開裂した部分酸化型であるのに対して、OS(II)はC2‒C3‒C4結合が完全酸化開裂している18。OS(I)とOS(II)の分子量と極性は類似しており、残念ながら現時点で単離精製に至っていない。
混合物であるOS(I)とOS(II)の存在比は、定量13C NMRスペクトルを積分することで容易に決定できる(図 2)。完全分離した共鳴線であるOS(I)グルコース残基の6位炭素(60ppm)とOS(II)グルコース残基5位炭素(74pmm)の積分値から、OS(I)とOS(II)のモル分率は順に0.42、0.58となる。モル分率の総和が1であり、同時にアルデヒド炭素(173ppm)の積分値が4.0であることから、OS(I)とOS(II)はいずれもテトラアルデヒドと結論できる。
キトサンは酸性溶液中でアンモニウム基を高密度に持つポリカチオンとして溶解するが、中性やアルカリ性では溶解しない。一方、キトサンのアミノ基と水酸基の一部をカルボキシメチル化したカルボキシメチルキトサン(CMC)は中性域でも容易に可溶化するため、創傷治癒、生体イメージング、組織工学、薬剤/遺伝子送達システムに広く利用されている。CMCはキトサン同様、生体安全性があり、リゾチームやキトサナーゼなどの体内酵素により分解し、体内吸収される。
CMC水溶液はOSを添加により、無触媒で容易にヒドロゲル化する。ここでは具体的な例として、CMC(脱アセチル化度99.9%、カルボキシメチル基置換度1.0)の未置換アミノ基に対して、OSのアルデヒド基が0.5、1.0、2.0モル倍量添加して得られたヒドロゲルゲル(表 1、CMCG 1‒3)の分子構造と諸物性について紹介する。
| 試料 | CMC/mg (NH2/mmol) | OS/mg (CHO/mmol) | 架橋密度 a | CMCG 1 | 400 (0.14) | 6.10 (0,07) | 0.08 | CMCG 2 | 400 (0.14) | 12.2 (0.14) | 0.11 | CMCG 3 | 400 (0.14) | 24.5 (0.28) | 0.14 |
|---|
CMCはOS添加直後からゾルからゲルへと変化する(図 3)。その架橋速度はOS濃度に依存し、CMCG 3合成条件下では3時間以内に完全ゲル化できる。CMCG 1のような希薄なOS濃度条件下でも、得られるゲルのレオロジー挙動は24時間以内に一定となる。得られたゲルを洗浄、凍結乾燥すれば、白色のCMCGが得られる。

CMCGの固体13C NMRスペクトルを測定すると、そのカルボニル炭素領域にCMCのカルボキシメチル基の共鳴性に加え、新たにイミンの共鳴線が検出できる(図 4)。カルボキシメチル基は架橋反応に寄与せず、反応前後で変化しない。つまりカルボキシメチル基を基準として、波形分離によりイミン共鳴線の積分値を求めれば、架橋密度(グルコサミン1残基あたりに形成したイミン結合の割合)を決定することが可能である(表 1)。
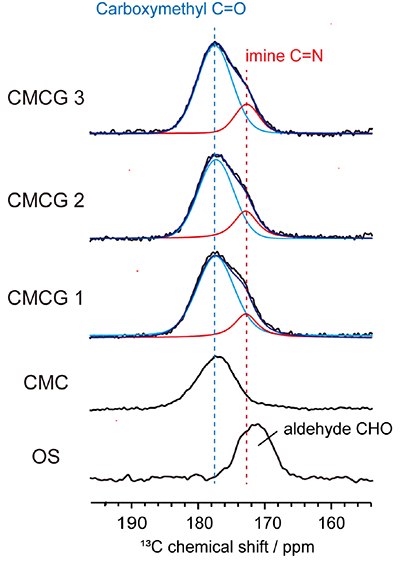
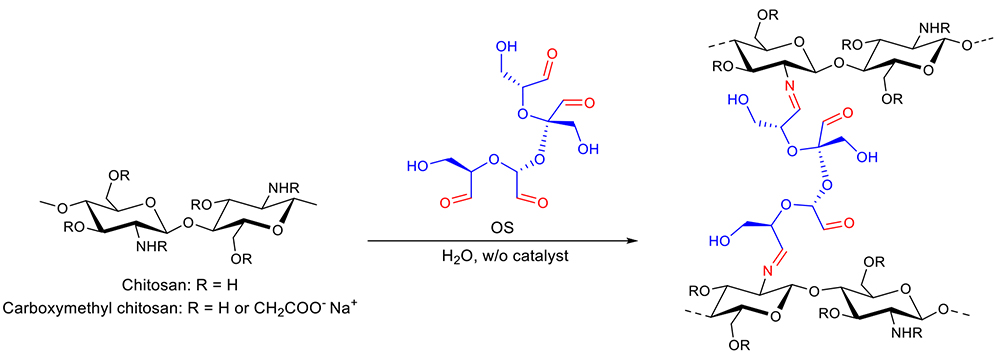
酸性多糖や中性多糖に対しては、無触媒下でのOSによる架橋化は進行しない。言い換えれば、グルコサミンやガラクトサミンなどアミノ糖含有多糖とのイミン架橋形成によるゲル化である(図 5)。OSを過剰に添加して得られたヒドロゲルには、未反応のアルデヒド基が残存することになるが、還元剤(例えば水素化ホウ素ナトリウム)水溶液に浸漬することで、アルデヒドは水酸基に変換できる。さらに還元剤処理によって、比較的不安定なイミンは、安定なアミンに還元できる利点がある。
CMCGは水と接触すると、再吸収して透明ゲル化する。骨格CMC分子鎖のカルボキシメチルナトリウム塩はイオン化し、ゲル全体はポリアニオンとなっている。分子鎖間の静電反発はゲルの膨潤を促進し、外液のイオンとゲル内部の遊離ナトリウムイオンの濃度差が浸透圧を生じ、吸水力を発生する。ゲルの弾性力と一度吸水した水はOSによる分子間架橋により、圧力をかけても離水しない。図 6にCMCG 1‒3の純水とPBS緩衝溶液に対する飽和吸水量を示した。吸水率を比較すると,PBSに含まれる塩がCMCGゲルの浸透圧を低下させるため、純水よりもPBSの吸水率が低下している。また、CMCGの架橋密度が上昇すれば、CMC分子鎖間の反発が抑制されて吸水率は低下する。
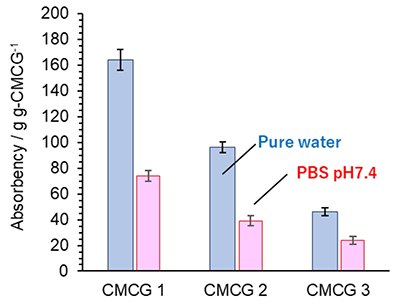
PBSで飽和吸水後したCMCGの凍結割断面を観察すると、典型的な多孔質からなるセル状構造が観察され、架橋密度の増加に伴ってその孔径は減少する傾向を示す19。孔径の減少はCMC分子鎖の静電的反発の抑制と関連付けられ、吸水性が低下する結果と一致する。
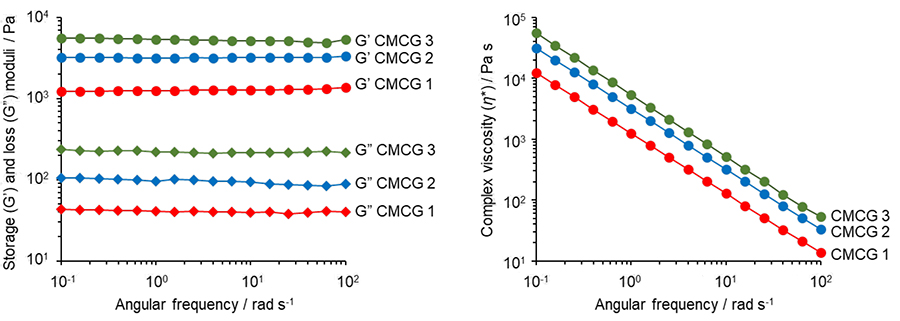
PBS膨潤したCMCG試料の動的粘弾性を角周波数掃引に対する弾性率から評価した(図 7)。貯蔵弾性率(G’),損失弾性率(G”)は歪によらず一定の値を示し、すべての試料でG’とG”は交差せずに、G’はG”の10倍以上の値を示した。また各周波数に対する複素粘度ƞ*の傾きは-1の一次直線で示されることから、CMCGは完全弾性ゲルの特徴を持つ、典型的な化学ゲルである。また架橋密度の増加に伴って、G’とG”はともに増大し、ƞ*も向上した。つまり架橋密度を上昇することで高強度なヒドロゲルが調製できる。
CMCの代わりに、キトサンからヒドロゲルを合成する場合、酸性水溶液で架橋反応を行う。酸性水溶液中では、キトサンのアミノ基がアンモニウムイオンに変化するため、窒素原子の求核性は向上する。この結果、アルデヒド炭素に対する反応性が増加するため、架橋反応速度も増加する。得られるヒドロゲルはその構造中にカルボキシメチル基のようなイオン性官能基を持たないため、キトサンヒドロゲルの吸水性は極めて低い。
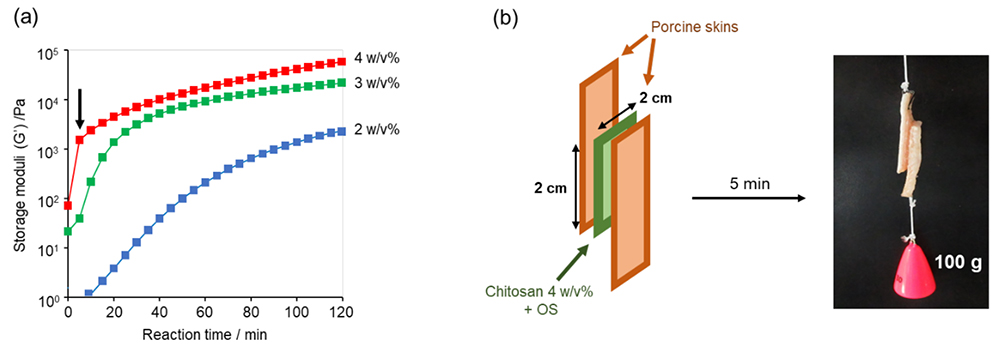
図 8aはキトサン水溶液(濃度2, 3, 4 w/v%)に一定量のOSを添加して形成したゲルについて、反応時間とその貯蔵弾性率の関係を示している。4wt%のような高濃度でゲル合成を行った場合、反応開始数分でキトサン水溶液は高強度なゲルに変化する。この急速かつ高強度なゲル化性能に着目し、キトサンゲルを生体接着剤に応用展開することを検討している。例えば2枚の豚皮表面に、それぞれキトサン水溶液とOS水溶液を滴下して張り合わせると、5分以内にキトサンゲル相が形成されて強固な接着性を発現する(図 8b)。OSの非毒性、非抗原性などの生体安全性が確認されれば、インジェクタブルゲルなど様々な医療用途に展開できる可能性がある。
本稿では、我々が取り組んでいる糖質系機能性材料開発の一つのトピックであるキトサンの機能性を活用した生体用ハイドロゲル材料の構造・物性制御法について紹介した。安価な糖から得られるOSは,従来から懸念されていた架橋剤の毒性問題を解決する可能性を持っている。したがって、キトサン、ヒアルロン酸、ヘパリン、コンドロイチン硫酸などのアミノ糖を含む多糖類にOSを適用することにより、得られるゲル材料を医薬用途に使用できる可能性がある。またキトサンは繊維化、ビーズ化など成形加工性に優れ、金属吸着能を有していることから、材料分野への用途展開が進められている。OSによる架橋化は、これら材料の機能性を高めるポテンシャルを有している。本稿で紹介した技術以外にも、我々はナノからミリメートルスケールでの球状ゲル粒子化や多糖ナノ材料の表層改質技術、有機合成手法を用いた機能化や複合化、さらには構造制御に関する技術と知見を有している。これら技術との融合によってキトサンに内在した機能性を最大限に発揮していきたいと考えている。