
氏原 哲朗
協和発酵バイオ株式会社 生産技術研究所 主任研究員
2006年東京大学大学院総合文化研究科修士課程修了。同年協和発酵工業(株)入社。2015年東京大学大学院総合文化研究科博士課程修了(学術)。2019年 協和発酵バイオ株式会社主任研究員、現在に至る。ヒトミルクオリゴ糖を含めた微生物を用いた有用物質の大量生産に興味を持ち、製造プロセスの開発に取り組んでいる。

簗島 謙太郎
協和発酵バイオ株式会社 R&BD部 マネジャー
2007年東京大学薬学部修士課程卒業後、協和発酵工業株式会社(協和発酵バイオ株式会社の前身)バイオフロンティア研究所にて、微生物を用いた物質生産研究に従事。2010年派遣研究員として北海道大学工学部にて大利徹教授のもとで放線菌の二次代謝経路研究に取り組む。2012年よりヒトミルクオリゴ糖をはじめとした製品開発や経営企画に従事。2017年INSEAD MBA取得。2019年4月より現職。
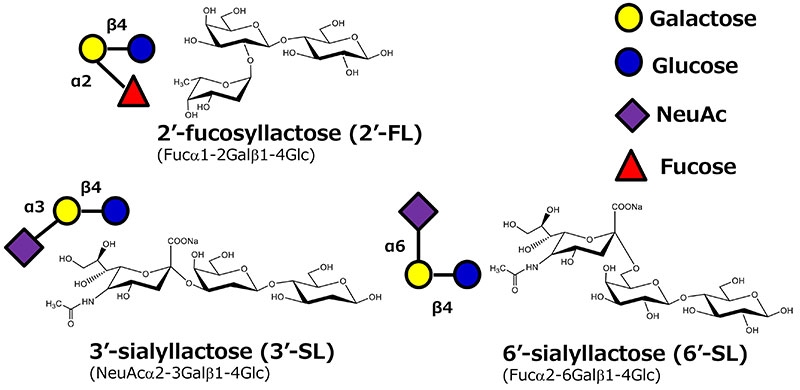
ヒトミルクオリゴ糖(HMOs)は母乳に含まれる多様な構造のオリゴ糖であり様々な有用性が示唆されており、注目を集めている1-3(図 1) 。 一方でHMOは人工ミルクの原料となる牛乳など他の哺乳類の乳汁には一部の成分しか含まれないため、HMOを人工的に製造し、粉ミルクに添加することで母乳に近い性質を達成できると考えられ、安価で高品質なHMOの生産が求められている。これまでにHMOの様々な製法が試みられていたが、天然からの抽出は前述の通り種類や量に限りがあり4、化学合成による生産も、2’-フコシルラクトース(2’-FL)など複数のHMOで合成に成功しているものの、HMOは多くの水酸基を保有するため、位置や立体選択的に糖鎖を結合していくためには多段階の保護、脱保護が必要であり工業的製法としては依然課題が多い5。位置、立体選択性という観点では、生物の有する酵素を用いた反応が最適であり、現在HMOの工業製法は酵素を用いた生物学的な製法が一般的となっている。
HMOを生物的に生産するためには複数の課題がある。まず初めにHMOは糖転移酵素によって複数の糖を正しい位置に結合させる必要がある。そのための適切な糖転移酵素の探索が第一の課題である。また、糖転移酵素は基本的に活性化された糖ヌクレオチドを基質としてラクトースなどへ転移する性質がある一方で、糖ヌクレオチドは高価で不安定な化合物であることが知られている。この糖ヌクレオチドの供給をどのように行うのかが第二の課題である。第三の課題として副生成物の制御、不純物の除去がある。工業的にHMOを生産するためには不純物の少ない高品質の最終製品が必要となる。
これら三つの課題を解決するために、これまでに多くの取り組みがなされてきた。近年注目が集まっている酸性HMOである、シアリルラクトース(Sialyllactose, SL)を例にこれらの課題の解決方法についてみてみたい。
シアリルラクトースはHMOに含まれる主要な酸性オリゴ糖でシアル酸(N-アセチルノイラミン酸)の結合位置により6'-シアリルラクトース(6’-SL)と3'-シアリルラクトース(3’-SL)が存在する。これまでに微生物で複数のシアル酸転移酵素が見出されており、その中に6’-SLを生産する酵素も3’-SLを生産する酵素(Sialyltransferase EC 2.4.99)も見出されている6(図 2)。6’-SLの合成酵素としてはPhotobacterium属の細菌から、3’-SLの合成酵素としてはNeisseria属細菌やPasteurella属、Campylobacter属細菌などで見出されている6。ちなみにこれらの細菌がシアル酸の糖転移酵素を持つ理由は明らかになっていないが、一説によるとヒトの体内と同じような糖鎖を表層に提示することで免疫系の攻撃を免れているという話がある7。
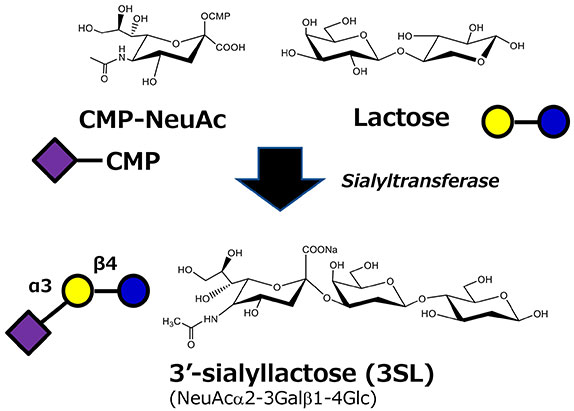
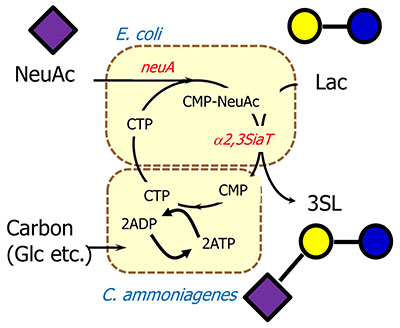
シアル酸転移酵素はCMP-シアル酸という高エネルギー状態の糖ヌクレオチドを用いる必要があるため、この酵素を用いたSLの大量生産にはCMP-シアル酸が大量に必要となることが課題であった。CMP-シアル酸はシアル酸とCTPがCMP-シアル酸合成酵素で結合することで生成されるが、シアル酸もCTPもそれぞれ高価な化合物である。
それぞれの化合物の安価な生産に関して考えたい。CTPは高価な化合物であるが、SL生産において、CTPはCMP-シアル酸になった後、再度CMPとして放出されるため、CMP kinase、Nucleoside diphosphate kinaseを用いて再度CTPに再生することができる。1分子のCMPからCTPへの再生には2分子のATPが必要であり、ATPもADPに変換されるため、同様にADPをATPに変換するプロセスが必要となる。最初に工業的に成功したATP再生法としては協和発酵工業にて見出されたATP再生力に優れるコリネバクテリウムを用いて再生させる方法である7(図 3)。この方法は糖転移酵素などの物質生産に関わる酵素遺伝子を発現させた大腸菌とコリネバクテリウムを界面活性剤やキシレンなどの有機溶媒処理によって物質透過性を上げ、CMPやATPといった通常細胞外に出ない物質のやり取りをさせることで、単一の反応系として成立させるという手法でATPを必要とする反応を可能にするという技術であった。本技術はCDP-コリン生産などで工業的なスケールで生産できることが示されている7。
他の方法としては、ポリリン酸を利用して、ポリリン酸キナーゼでATPを再生させる反応を共役させることでSLを生産する大腸菌の中でATPを生産させて利用する方法もある8。この方法では一菌体で生産できるという点でプロセスは簡便になるが、ポリリン酸を添加する必要があり安価な炭素源が利用可能なコリネバクテリウムを用いたATP再生系に比べるとコスト面で劣る。
次にシアル酸(N-アセチルノイラミン酸、NeuAc)の供給について述べたい。シアル酸は天然ではツバメの巣などに含まれているが、その生産量は多くない。シアル酸の生産方法としては、比較的安価に手に入るN-アセチルグルコサミンをアルカリ条件下でエピメリ化し、N-アセチルマンノサミンに変換し、シアル酸分解酵素であるN-アセチルノイラミン酸リアーゼの逆反応を活用し、ピルビン酸とN-アセチルマンノサミンを結合させN-アセチルノイラミン酸を生産する方法が知られている9。一方でこの反応は多量のピルビン酸を原料として必要とし、かつ逆反応であるため効率面で限界がある。より効率的な方法としてシアル酸合成酵素を用いてN-アセチルマンノサミンにホスホエノールピルビン酸を結合させる方法がある。ホスホエノールピルビン酸自体が高エネルギー化合物であるため、こちらもコリネバクテリウムや大腸菌でグルコースやグリセロールといった安価炭素源から生産させる必要がある。ちなみにN-アセチルマンノサミンも含め全てグリセロールやグルコースで生産することが可能で、これらすべてを組み込んだ菌株をラクトース存在下で培養することで一気にシアリルラクトースを生産することが可能となっている(図 4)。
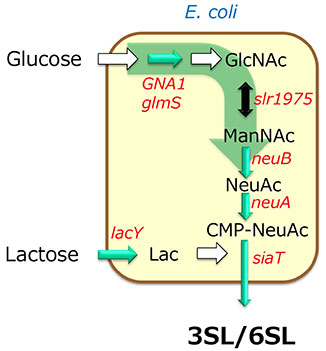
これまでにSL生産についてみていたが、2’-FL、3-フコシルラクトース(3-FL)などのフコシル化オリゴ糖やラクト-N-テトラオース(LNT)などのHMOも基本的な流れは変わらない。フコシル化オリゴ糖の生産にはCMP-シアル酸ではなくGDP-フコースを用いるし、N-アセチルグルコサミンの転移にはUDP-GlcNAcが、ガラクトース、グルコースの転移にはUDP-Gal, UDP-Glcが用いられる。これらの糖ヌクレオチドの生産にもATPが必要であり、糖転移酵素の探索と、適切なATP再生系の組み合わせがHMO生産のキーポイントとなる。
発酵法や菌体反応法で生産したHMOは菌体を含めた多くの不純物を含んでおり、工業的な生産には精製工程が必須である。菌体の分離方法としては遠心や、膜による分離がある。菌体分離後にイオン交換樹脂などで分離を行い、場合によっては電気透析を行い脱塩し、最終的にはスプレードライや晶析によりHMOの粉を得る。晶析は有機溶媒中でのHMOの溶解度が低くなる現象を利用して行うもので、結晶型の制御が重要である。これまでに2’-FL, 6’-SL, 3’-SLなどで結晶の報告があり10,11(図 5)、高純度の製品の生産に活用できると考えられる。スプレードライは物理的にHMO液を固体にするもので、晶析と異なり純度の向上は期待できないが、より簡便で安価なプロセスとして注目を集めている。スプレードライを用いる場合にはスプレードライ原液として高純度で目的産物を含んでおく必要があるため、精製のプロセスが重要となる。シアリルラクトースなどの酸性HMOの精製にはイオン交換樹脂を検討することで、中性・酸性の不純物を除去し、酸性の不純物もクロマト分離を行うことで除去することができる。

ここまで述べてきたようにHMOのバイオテクノロジーを用いた製法の研究開発が進み、近年になってHMOの大量安価製造が可能となってきた。欧州、米国のスタートアップ企業が市場をリードする形で、2017年頃から2’-FLやラクト-N-ネオテトラオース(LNnT)が添加された粉ミルクが欧米各国や一部のアジア諸国で発売され始め、2021年には更に6’-SL、3’-SL、3-FLなどの新しいHMO種が添加された粉ミルクも一部地域で発売が開始されている。
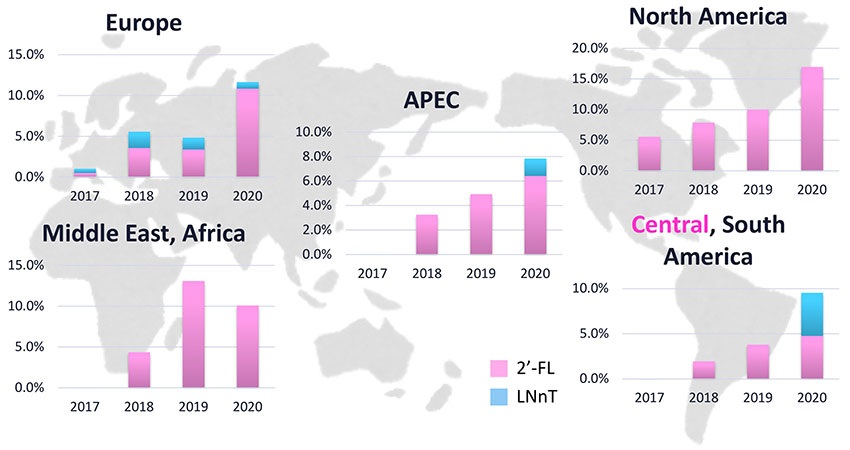
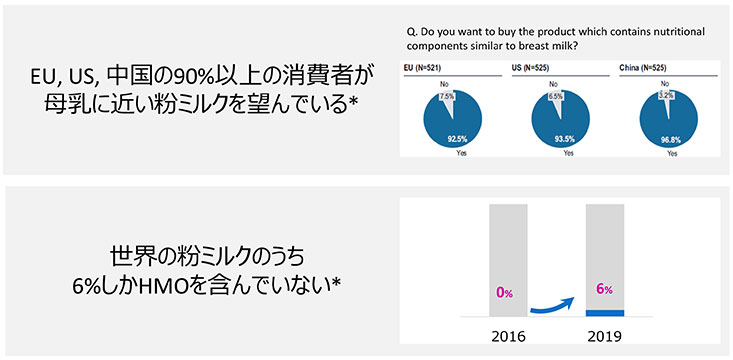
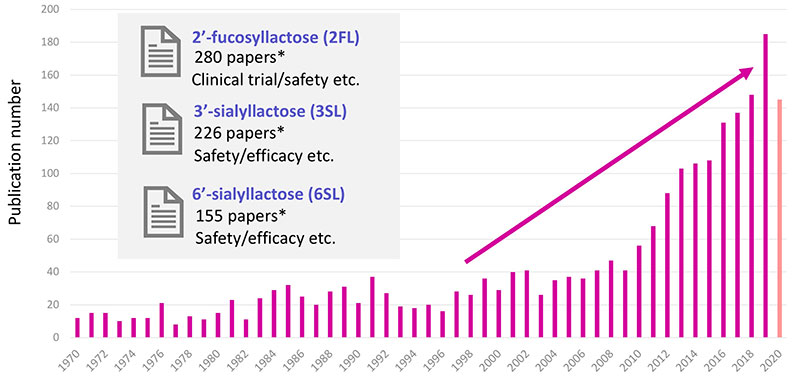
HMOの主な用途は粉ミルク製造原料である。粉ミルクにとっては、目指すべき組成のゴールドスタンダートは母乳であり、粉ミルク各社は母乳にできるだけ近い組成の粉ミルクを目指してHMO添加粉ミルクを展開し始めている。しかしながら、250種ともいわれる多様な母乳中HMOのうち、グローバルに見てもまだ7種類(2’-FL、LNnT、6’-SL、3’-SL、3-FL、LNT、Difucosyllactose)程度しか商業的に使用できるHMO種はなく12、日本では商業的に粉ミルクを含む食品にHMOが使用された例はまだない。日本も含め、著者が所属する協和発酵バイオなどのHMOサプライヤーが各国規制への対応を進めており、少しずつHMOを使用できる地域が拡大しているのが現状である。HMOが使用できる地域では実際にHMO含有粉ミルクの製品数が増加している(図 6)。我々が実施した消費者調査では、欧州、米国、中国において、90%以上の方が、母乳に近い粉ミルクを望んでいることがわかっている(図 7-1)。2016年時点ではHMO含有粉ミルクは世界のどこにも発売されていなかったところ、2019年時点では世界の6%程度の粉ミルクにHMOが添加されるようになってきた(図 7-2)。粉ミルク用途だけではなく、HMOのもつ生理機能を活用した機能性食品の開発も世界で始まりつつある。具体的には免疫機能、抗感染、脳機能といった機能に注目した開発が進められている。商業製造が始まっている2’-FLやLNnTはヒト臨床試験の成果も積み重なりつつあり、開発が先行している。作用機序のメカニズムとして、腸内細菌を介したHMOの機能発現が注目されていることから、プロバイオティクスとHMOの組み合わせによる相乗効果に着目した取り組みも顕著である。2010年頃を境にHMO関連論文報告数が増加トレンドに入り、そのトレンドがまだ続いていることはHMOに関連した研究開発がこれまで以上に加速していることを裏付けている(図 8)。2’-FLは母乳中含量が多いことや、商業製造が早く始まっていることもあり、既に論文数が多いが、3’-SLや6’-SLといった他のHMOを題材とした研究もどんどん増えている状況である。いずれも、HMO種によって多様な効果が報告されており、HMO種ごとの機能の差が明らかにされつつある。具体的な機能としては、抗感染では、連鎖球菌、ロタ、ノロ、インフルエンザなどへの効果が示唆されている13,14。また、免疫賦活・調節では、炎症性サイトカイン抑制、食品アレルギー症状の緩和15,16、脳機能では、ガングリオシド増加、記憶の改善、不安行動抑制、腸機能17-20などが報告されてきている。有益な生理機能が期待できるBifidobacteriumやLactobacilusの生育を助ける作用が知られている一方で、有害な腸内細菌の生育を防ぐことも期待されている21,22。こういったHMOのプロバイオティクスへの効果が着目されており、今後、プロバイオティクスメーカーにより、各社が持つ固有のプロバイオティクスとHMOの組み合わせの研究と製品開発が進むことが想定される。
2’-FLの消費量は、現在もグローバルに拡大が続いている。拡大が先に進んだ欧米だけでなく、アジアでもベトナム、シンガポール、香港などでHMO含有粉ミルクが発売されており、実際に購入することができる。2021年には粉ミルクの世界最大の消費国である中国においてもHMO使用に関する規制について当局の方針が明確になり始めており、HMOサプライヤー各社の取り組みが活発化している23。これまではGlycom社、Jennewein biotechnologie社といったスタートアップ企業が市場を開拓してきたが、2020年にはこれらの企業が大手企業に買収されており、市場創成期から市場の規模拡大のフェーズに移行しつつある状況である。デンマークのスタートアップ企業であるGlycom社は世界的な栄養成分製造企業であるDSM社に買収された。DSM社はHMO事業を乳児用栄養事業における成長領域としてこれから投資を進めることを発表している23。また、ドイツのスタートアップ企業であるJennewein biotechnologie社は、Christian Hansen社という世界的なプロバイオティクス製造企業に買収された。こちらのケースでも今後HMO事業に投資していくこと、また、Christian Hansen社が持つプロバイオティクスとHMOを組み合わせについて製品開発を進めていくことも併せてプレスリリースされている24。また、同じく2020年11月には、著者らの所属する協和発酵バイオ社がタイに持つ発酵工場に製造ラインを新設し、2022年第4四半期から2’-FL、6’-SL、3’-SLの3品目を上市することを、キリンホールディングスとともにプレスリリースしている25。この工場は世界で初めてのアジアにおけるHMO製造拠点となり、今後HMO需要の拡大が見込まれる中国、東南アジア地域へのHMOの供給に貢献することが見込まれている。
現在、世界で流通している粉ミルクの数%にしかHMOは添加されていない。HMOがより大量に安定して供給されるようになることで、これまでよりも母乳に近いHMO含有粉ミルクがもっと多くの消費者に届くようになるであろう。また、今後さらに多くの種類のHMO種が供給されるようになることで、更に母乳に近い粉ミルクが実現することが期待される。同時に、HMOが持つ生理学的な可能性の解明も進むだろう。HMOはヒトが赤ちゃんのために特別に作る成分である。大量製造によりヒト試験も可能となった今、HMOがヒトの健康に貢献するメカニズムが、より詳細に解明されてくるだろう。その健康機能は、乳児特異的なものもあるかもしれないが、乳児以外の世代のヒトの健康にも寄与できる可能性も期待される。