氏名:舘野 浩章
グライコームを解析するための新たな技術を開発することで、これまで観察不可能であった生命現象を解き明かすとともに、国際社会に貢献する実用的技術の開発を目指して研究を進めています。異なる分野の研究者と連携することで、面白い研究をしたいと思っておりますので、お気軽にご連絡ください。
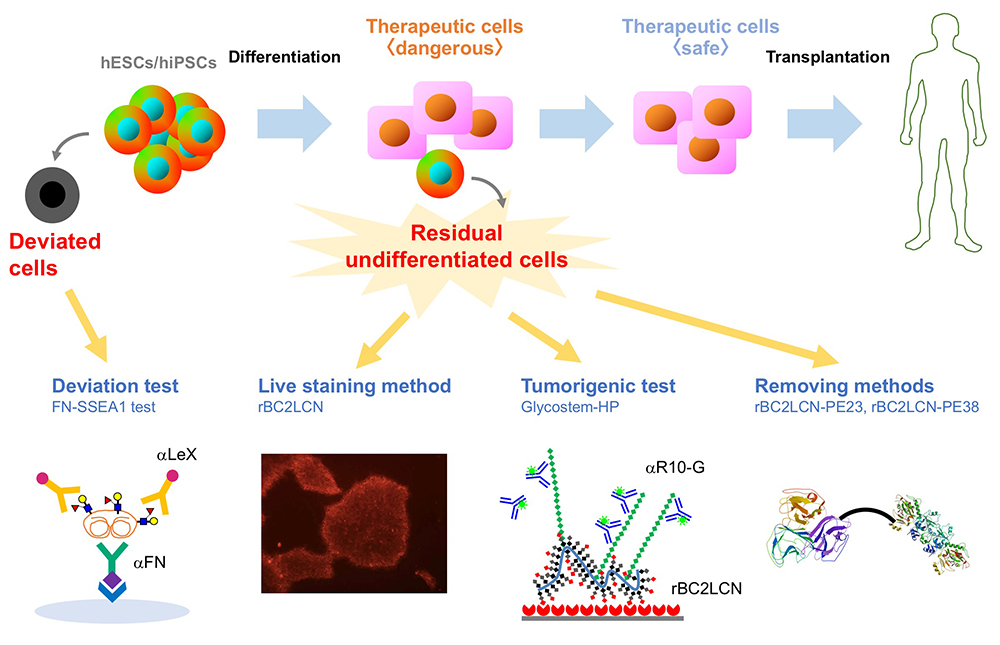
ヒトES/iPS細胞の最外層を覆う細胞の顔・糖鎖を網羅解析することで、ヒトES/iPS細胞の顔の特徴を明らかにするとともに、ヒトES/iPS細胞に反応するrBC2LCNと呼ばれるレクチンを発見した。そしてrBC2LCNを用いて細胞治療用製品に残存するヒトES/iPS細胞を検出、除去する技術を開発した。さらに最近ではヒトiPS細胞の未分化状態から逸脱した細胞である「逸脱細胞」を検出する技術を開発した。ここでは、筆者らがこれまで開発してきた糖鎖を基盤としたヒトES/iPS細胞品質管理技術についてご紹介したい。
ヒト胚性幹細胞(ES細胞)やヒト人工多能性幹細胞(iPS細胞)は、無限に増殖できる能力(自己複製能)とあらゆる細胞に分化する能力(多能性)を持つことから、再生医療のための細胞ソースとして期待されている。現在、ヒトES/iPS細胞を用いた再生医療の産業化を実現するために多くの研究が進められている。2014年9月には加齢黄斑変性の治療を目的として自己由来のヒトiPS細胞から作製した網膜色素上皮細胞の移植が世界で初めて実施された。その後、パーキンソン病、角膜上皮幹細胞疲弊症、重症心不全、血小板減少症など様々な疾患の治療にヒトiPS細胞から作製した細胞治療製品が利用されている。このようにヒトiPS細胞の臨床応用が現実的になりつつある一方で、造腫瘍性という安全性における大きな課題がある。「ヒト(自己)iPS(様)細胞加工医薬品等の品質及び安全性の確保に関する指針(薬食発0907第3号 2012年9月7日)」においても、「ヒトiPS(様)細胞加工医薬品等においては目的細胞以外の未分化細胞の混入を否定するための方策が最も重要な要件である。可能な限り中間製品の段階で目的細胞以外の未分化細胞の混入を否定することが望ましい」と記載されており、ヒトiPS(様)細胞加工医薬品を医療に用いる際には、残存する未分化細胞の造腫瘍性が大きな関心事になっていることが分かる。そのため、ヒトES/iPS細胞を用いた再生医療の産業化を実現するためには、ヒトES/iPS細胞から作製した細胞治療製品に残存する未分化なヒトES/iPS細胞を検出、除去する技術が必要である。
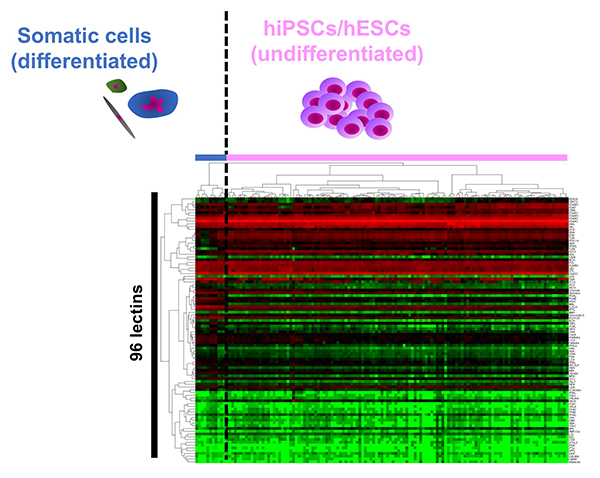
糖鎖は全ての細胞の最外層を覆い、その構造は細胞の種類や状態に応じて変化することから「細胞の顔」と呼ばれ、細胞表面マーカーとして様々な細胞の同定や選別に利用されてきた。一般的に用いられているヒトES/iPS細胞マーカーであるSSEA3/4やTra-1-60/81は糖鎖である。しかしヒトES/iPS細胞に発現する糖鎖構造の詳細については十分には理解されていなかった。2007年にヒトiPS細胞が報告された直後に、我々は高密度レクチンマイクロアレイと呼ぶ糖鎖プロファイリング技術を用いて、ヒト胎児肺、羊膜、子宮内膜、胎盤動脈、皮膚など様々な組織から調製した計114種類のヒトiPS細胞の糖鎖プロファイルを、ヒトiPS細胞の元となるヒト体細胞やヒトES細胞と比較解析した1。その結果、1)ヒトiPS細胞はヒトES細胞と同じクラスターに分類され、ヒトES/iPS細胞は体細胞と異なるクラスターに分類、2)114種のヒトiPS細胞は由来によらず一つの大きなクラスターに分類、3)体細胞はそれぞれ異なるクラスターに分類された(図 1)。「糖鎖リプログラミング」を初めて証明するとともに、ヒトES/iPS細胞には独自の「顔」が存在することを示した。
それでは、ヒトES/iPS細胞はどのような顔をしているのか?得られたレクチンマイクロアレイのデータと関連する糖転移酵素の発現解析の結果から、α2-6シアル酸、1型ラクトサミン構造(Galβ1-3GlcNAc)、α1-2フコースの3つの糖鎖エピトープを特徴的に発現していることがわかった。これらの結果を検証するために、ヒトiPS細胞(201B7株)とヒト皮膚線維芽細胞の2種について、液体クロマトグラフィーと質量分析により、N型及びO型糖鎖の比較解析を行った2。その結果、ヒト皮膚線維芽細胞からN型糖鎖20種、O型糖鎖7種、ヒトiPS細胞からN型糖鎖37種、O型糖鎖10種が同定された。2種の細胞間で糖鎖構造に明確な違いが認められ、レクチンマイクロアレイによる糖鎖プロファイリングの結果とほぼ一致していた。すなわちヒトiPS細胞のN型糖鎖において、1)N型糖鎖のシアル酸結合様式はすべてα2-6型、2)1型ラクトサミン構造の発現、3)H抗原(Fucα1-2Gal)の発現が認められた。これに対してO型糖鎖ではシアル酸結合様式の大きな変化は認められなかったが、1型ラクトサミンとH抗原の出現は顕著であった。
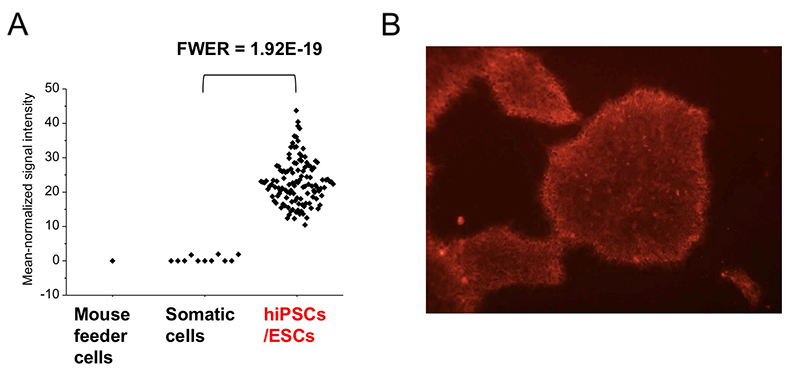
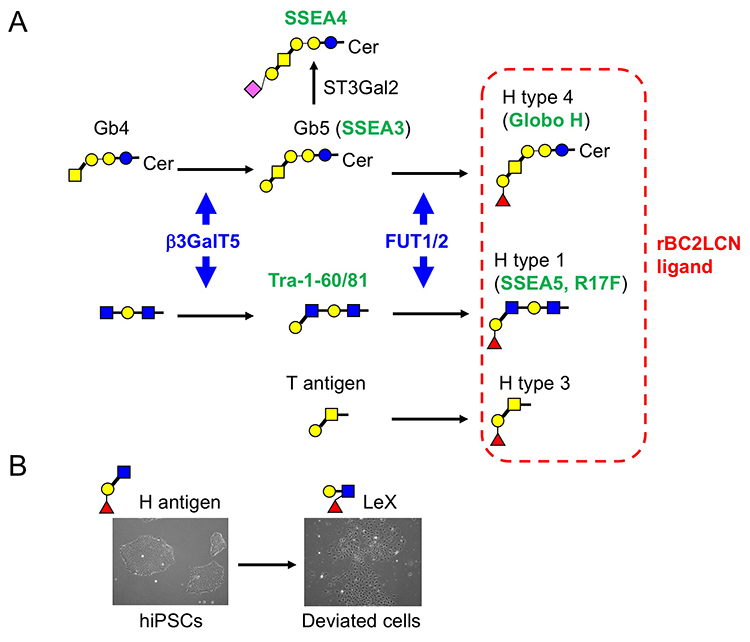
レクチンマイクロアレイに用いた96種類のレクチンのうち、グラム陰性菌 Burkholderia cenocepacia由来のレクチンBC2L-CのN末端ドメインのリコンビナント体であるrBC2LCNは、未分化なヒトES /iPS細胞のすべてと反応するものの、分化した体細胞やマウスフィーダー細胞とは全く反応しないことがわかった(図 2)1,3。rBC2LCNの糖結合特異性を糖鎖複合体アレイとフロンタル・アフィニティークロマトグラフィーで解析すると、前節に記載した3つのヒトES/iPS細胞の糖鎖構造の特徴のうちの2つ(α1-2Fuc、Galβ1-3GlcNAc)が関係するFucα1-2Galβ1-3GlcNAc/GalNAcに結合した。上記糖鎖構造解析の結果、ヒトiPS細胞からFucα1-2Galβ1-3GalNAcを持つCore2 O型糖鎖が検出された2。rBC2LCNの糖タンパク質リガンドを探索すると、その1種はポドカリキシンと呼ばれるシアロムチンであることがわかった4。実用面では、蛍光標識したrBC2LCNを用いると、培地に添加するだけで様々な種類のヒトES/iPS細胞を、生きたまま染色できる(図 2)5。rBC2LCNはたとえ100 µg/mLという高濃度であっても、ヒトES/iPS細胞に毒性を示さない。もちろんフローサイトメトリーへの適用も可能であり、ヒトES/iPS細胞の選択的な分離にも応用できる。rBC2LCNが認識する糖鎖エピトープはヒトES/iPS細胞で顕著に発現が増加しているFUT1/2とB3GalT5という2種の糖転移酵素遺伝子で合成される(図 3 A)。実はこれら糖転移酵素は既知の未分化マーカーであるSSEA3/4/5、Tra-1-60/-81、Globo Hの合成にも関与している。rBC2LCNが認識する糖鎖構造は既知の未分化マーカーと密接に関係しているのだ。
さらにrBC2LCNが反応性を示すポドカリキシン(以後、rBC2LCN陽性ポドカリキシン)が、様々な種類のヒトES/iPS細胞から培養上清中に分泌されていることがわかった6。rBC2LCN陽性ポドカリキシンは調べた限りヒトES/iPS細胞から特異的に分泌されており、ヒト体細胞からは分泌されていない。すなわち培養上清中のrBC2LCN陽性ポドカリキシンを調べることで、細胞自体を使わずに、培養上清を用いてヒトES/iPS細胞を検出できることになる。そこでrBC2LCNを捕捉プローブとして使用し、ポドカリキシン上の低硫酸化ケラタン硫酸に反応するR-10G抗体を検出プローブとして使用したサンドイッチアッセイ系(GlycoStem-HP法)を構築した7。GlycoStem-HPは各種培養液で培養したヒトES/iPS細胞の検出に適用可能であり、その検出下限値は0.0006-0.03%であった。更に、GlycoStem-HP法が実際のヒトiPS細胞由来の移植用細胞に適用できるかどうかについて検証した。その結果、ヒトiPS細胞から作製した心筋細胞やヒト神経幹細胞中に混在するヒトiPS細胞の検出に適用可能であった。本技術は2019年に「ヒト細胞加工製品の未分化多能性幹細胞・形質転換細胞検出試験、造腫瘍性試験及び遺伝的安定性評価に関するガイドライン(薬生機審発0627第1号)」に掲載され、再生医療産業での利用が期待される。
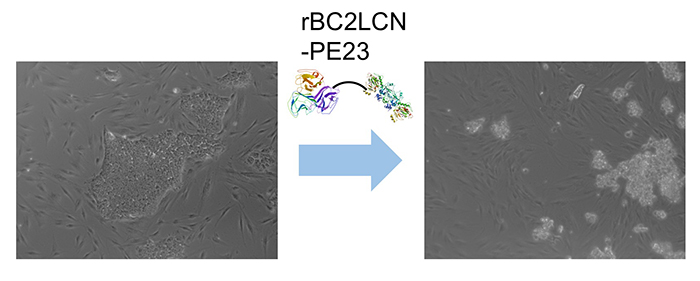
面白いことにrBC2LCNは、ヒトES/iPS細胞に結合した後に細胞内に取り込まれることがわかった。そこでrBC2LCNを薬剤キャリアとして利用できないかと考え、タンパク質合成を阻害して細胞死を引き起こす緑膿菌外毒素の触媒ドメイン(domain III、23 kDa)をrBC2LCNのC末端部分に融合させた組換えタンパク質(rBC2LCN-PE23)を作製した8。rBC2LCN-PE23を培養液に添加して24時間後、ほとんどの細胞が培養皿への接着能力を失い、培養液中に浮遊して、死滅した(図 4)。rBC2LCN-PE23はヒトES細胞に対しても同様の効果を示した。一方、ヒト皮膚線維芽細胞やヒト間葉系幹細胞の生存や増殖には影響を与えなかった。さらにその後、rBC2LCNのC末端部分に緑膿菌外毒素のdomain IIIに加えてdomain Ibとdomain IIを融合させたrBC2LCN-PE38を開発した9。rBC2LCN-PE38はrBC2LCN-PE23と比べて556倍高い活性を示した。ヒトiPS細胞由来肝細胞とヒトiPS細胞の混合培養系におけるrBC2LCN-PE38の殺傷効果を調べると、ヒトiPS細胞だけが選択的に殺傷除去された。rBC2LCN-PE38を用いることで、ヒトiPS細胞由来細胞治療製品中に残存しているヒトiPS細胞を選択的に殺傷除去できることがわかった。また最近、rBC2LCN固定化ビーズを用いて分化細胞中に残存しているヒトiPS細胞を除く技術が開発された10。
ヒトiPS細胞を培養していると、小さい玉石状から大きく平らな細胞に形態が変化し、未分化性を失うことがある。そのような細胞は「逸脱細胞」と呼ばれ、初期分化マーカーであるSSEA1(LeX)を発現する。すなわち、未分化状態から初期分化状態に変化する過程で、H抗原(α1-2Fuc)からLeX(α1-3Fuc)への糖鎖変換が起こる(図 3 B)。我々はSSEA1陽性逸脱細胞から培養上清中に分泌されるSSEA1陽性糖タンパク質を探索し、フィブロネクチンがSSEA1の主要なキャリアタンパク質の1つであることを見出した11。そこでSSEA1陽性フィブロネクチンを検出するELISA法(FN-SSEA1テスト)を開発した。本方法を用いると、逸脱細胞の数を非破壊的に測定できる。本技術の再生医療への応用が期待される。
ここではヒトES/iPS細胞の糖鎖解析から、ヒトES/iPS細胞に特異的に結合するrBC2LCNを用いたヒトES/iPS細胞検出・除去技術について紹介した。rBC2LCNの最大の利点の1つは、費用対効果が高く、大腸菌で大量に調製できることである。また、未分化状態から逸脱した細胞の検出技術について記載した。もちろん糖鎖はヒトES/iPS細胞のみならず、他の細胞治療用製品の品質管理にも応用できる。例えばヒト間葉系幹細胞を用いた再生医療は既に実用化されているものの治療効果にバラつきがあることから、品質管理技術が求められている。我々はα2-6シアル酸がヒト間葉系幹細胞の分化能の指標となることを報告している12,13。糖鎖を利用した様々な細胞品質管理技術を開発することで再生医療の産業化に貢献できれば幸いである。