
氏名:西原 祥子
創価大学 糖鎖生命システム融合研究所 所長、同大 理工学研究科 生命理学専攻 教授、理学博士
1982年 東京大学大学院理学系研究科化学専攻博士課程 修了、理学博士取得。慶応義塾大学医学部薬化学研究所、東京慈恵会医科大学、ノースキャロライナ大学、三菱化成生命科学研究所を経て、1991年より創価大学。この間、ノースキャロライナ大学、三菱化成生命科学研究所でショウジョウバエの発生や神経に関する研究を行い、創価大学に移動後、糖鎖生物学の研究を開始した。現在、日本糖鎖科学コンソーシアム(JCGG)副会長、Glycoconjugate Journal のEditorial Boardメンバーを務めている。
研究テーマ:種を超えて保存されている糖鎖の機能に着目し、哺乳類多能性幹細胞における糖鎖の機能、及び、ショウジョウバエモデルにおける糖鎖の機能を、機能に注目した網羅的スクリーニングを行うことにより見出し、解析している。この他、最近は、糖鎖が関わる未診断疾患や希少疾患のスクリーニングの共同研究も開始した。
細胞表面に提示される糖鎖は、組織特異的に、また、発生段階特異的に発現が制御されており、ステージ特異的胚性抗原(SSEA)など、胚性幹細胞(ES細胞)のマーカーとしても使われている。しかし、幹細胞における糖鎖の役割は、よくわかっていなかった。そこで、我々は、糖鎖を合成する糖転移酵素を主な対象としてマウスES細胞でRNAiスクリーニングを行い、現在までに、ナイーブな多能性状態を維持するために必要な4種の糖鎖構造、(1)LacdiNAc構造(GalNAcβ1,4GlcNAc)、(2)ヘパラン硫酸、(3)O-GlcNAc、(4)ムチン型O-結合型糖鎖の1つであるT抗原(Galβ1,3GalNAc)を明らかにした。これらの糖鎖は、いずれも、ナイーブな多能性状態の維持に必要な白血病抑制因子(LIF)、骨形成因子(BMP)、Wntシグナル、あるいは、分化の出口となるFGF4シグナルのどれかに関与していていた。また、ショウジョウバエから哺乳類まで進化的に保存されている糖鎖構造でもあった。一方、ES細胞とエピブラスト様細胞は、エピブラストへの最初の細胞系譜の決定をin vitroで再現し、多能性状態の遷移の根底にある分子メカニズムの解析を可能にする。両者の細胞の全グライコーム解析を行ったところ、全てのタイプの糖鎖構造が発生の初期段階から劇的に変化することが分かり、この変化には、ポリコーム抑制複合体2による様々な糖転移酵素の発現を同時に制御するネットワークが関与していた。ここでは、これらの我々の研究を中心に、再生医療への応用も含めて紹介する。
胚性幹細胞(ES細胞:ESCs)や人工多能性幹細胞(iPS細胞:iPSCs)など、哺乳類の多能性幹細胞は、ナイーブ状態とプライム状態と呼ばれる2つの異なる状態にある1-3。また、最近ではナイーブ状態とプライム状態の間にformative状態も提案されている4。 ナイーブ状態は胚の着床前の胚盤胞に対応し、プライム状態は着床後の胚盤胞に対応し、各々異なる特徴を持つ。3.5日胚の内部細胞塊に由来するマウスESCsはナイーブ状態であるが、従来のヒトESCsはその性質からプライム状態にあるとされている1-3。
哺乳類の多能性幹細胞のマーカーの多くは糖鎖である1-3。マウスESCsは、ステージ特異的胚性抗原-1(SSEA-1)を、糖タンパク質上や糖脂質上に発現する。一方、従来のヒトESCsはSSEA-3、SSEA-4、SSEA-5を発現するが、SSEA-1は発現しない。しかし、多能性幹細胞の細胞表面にある糖鎖の生物学的機能はよくわかっていなかった。そこで、我々は、ESCsの自己複製能と多能性維持に必要な糖鎖を同定するために、アルカリホスファターゼ活性を自己複製能の指標として、ナイーブなマウスESCsで100以上の糖転移酵素のRNA干渉(RNAi)スクリーニングを行った。そして、現在までに、ナイーブな多能性状態の維持に必要な4種類の糖鎖構造を見出した。それらは、それぞれ、グリコサミノグリカン、N-結合型糖鎖、O-結合型糖鎖、細胞内糖鎖など、異なるタイプの糖鎖に属し、多能性に関与する転写因子のネットワークの上流にあるシグナルを調節するか、分化へ出口となるシグナルを阻害していた(図 1)。
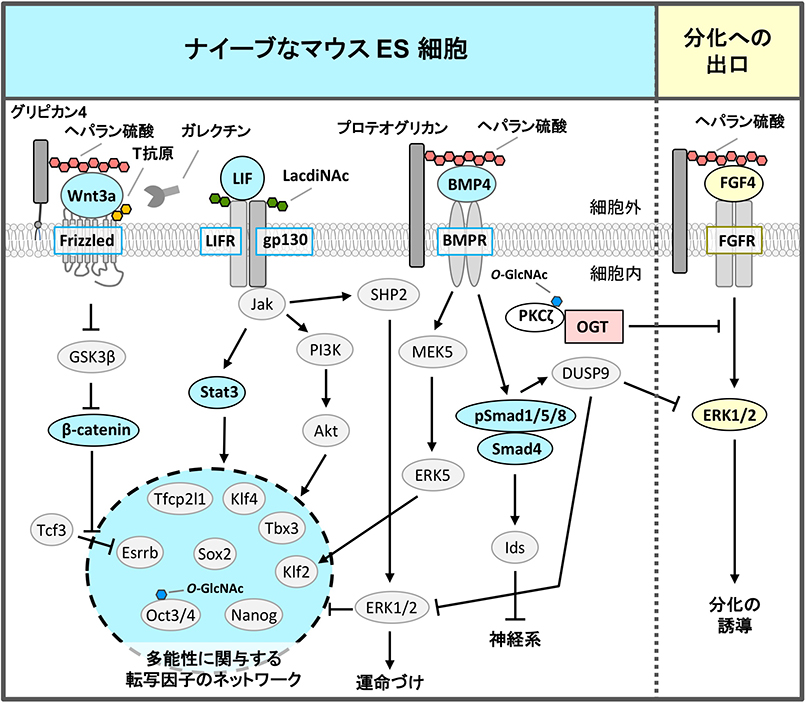
ナイーブ状態では、Nanog、Sox2、Oct3/4、Klf4、Klf2、Tbx3、Tfcp2l1、Esrrbが多能性に関与する転写因子のネットワークを構成し、相互に調節・協調して下流の遺伝子の発現を調節し、自己複製能と多能性を維持している(図 1)。 白血病抑制因子(LIF)シグナルはJak /Stat3とPI3K / Akt経路の活性化を介してこれらの転写因子の発現を誘導するため6、培地にLIFを添加してナイーブな多能性幹細胞を培養している。 Jak / Stat3経路はKlf4とTfcp2l1を直接活性化し、PI3K / Akt経路はTbx3を直接活性化している。
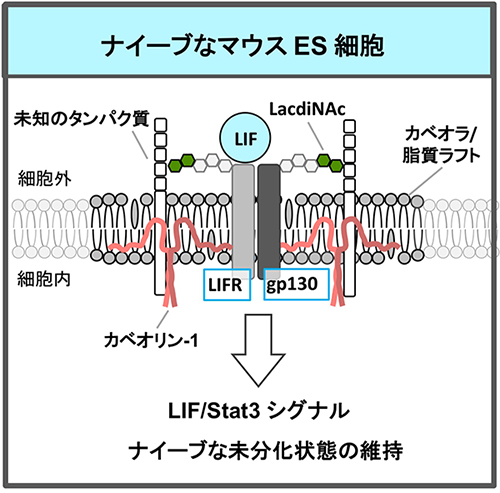
ナイーブなマウスESCsの自己複製能と多能性に必要な糖転移酵素のRNAiスクリーニングで見出されたものの一つに、LacdiNAc(GalNAcβ1,4GlcNAc)構造を合成するβ1,4N-アセチルガラクトサミン転移酵素3がある7。LacdiNAcは、ショウジョウバエからヒトまで保存されている糖鎖構造であり、N-結合型糖鎖、あるいは、O-結合型糖鎖の外鎖部分にある特徴的な末端構造である。LIF受容体(LIFR)とglycoprotein130(gp130)上のLacdiNAcは、LIF/Stat3シグナル伝達を介したナイーブ状態の維持に必要であった(図 2)。 LacdiNAcの発現は、ナイーブなマウスESCsで高く、分化に伴い減少した。LacdiNAc の発現が高いナイーブ状態のマウス ESCsでは、LIF 受容体と gp130 上の LacdiNAc を介して、両者はカベオリン-1 複合体などのラフト構成因子と結合して、カベオラ脂質ラフトに局在する。カベオラ脂質ラフトは、スフィンゴ脂質とコレステロールに富んだ細胞膜上の微小領域のうち、カベオリンを含むものである。種々のシグナル受容体が集積してシグナル伝達の場となっている。このため、LIF シグナル伝達に必要な LIFRと gp130 の複合体形成が促進され、効率的にシグナルが伝達されていた。
LIFシグナル以外にも、骨形成因子(BMP)4/mothers against dpp homolog (Smad)とWnt /β-カテニンシグナルも、ナイーブな多能性幹細胞の自己複製と多能性に必要である(図 1)1-3。 Wntシグナルは、それのみでは不十分であるが、LIFシグナルと相乗的に働き、ナイーブ状態を維持する。一方、ショウジョウバエ変異体の解析結果8や、ヘパラン硫酸(HS)と構造が類似するヘパリンがBMP4(KD = 69.4 nM)9とWnt3a(KD = 26.0 nM)10に強く結合することから、HSがBMPやWntの補助受容体、あるいは、安定化因子として機能することが示されていた。
ナイーブなマウスESCsの自己複製能と多能性に必要な糖転移酵素のRNAiスクリーニングからも、HSの二糖繰り返し領域を合成するexostosin 1 (EXT1)が見出された10。我々を含むいくつかのグループの解析から、HSがWntとBMPシグナルを制御して、マウスESCsのナイーブ状態の維持に働くことがわかり(図 1)2,3、そこでは、HSの硫酸化が必須であった9。さらに、HSプロテオグリカンのうち、グリピカン4はWntシグナルを選択的に制御していた11。HSは、種々のコアタンパク質に結合してHSプロテオグリカンを形成している。シグナルによってコアタンパク質が使い分けられていると考えられた。
O-GlcNAc修飾は、細胞質、核、または、ミトコンドリアに存在する唯一の糖鎖修飾である12。O-GlcNAc転移酵素(OGT)は、単一のGlcNAcをタンパク質のセリン(Ser)/スレオニン(Thr)残基に転移するが、O-GlcNAcase(OGA)はタンパク質からO-GlcNAcを取り去る。O-GlcNAc修飾されているタンパク質には、シグナル伝達因子、転写因子、エピジェネティック制御因子、ヒストンなどがあり、O-GlcNAcは、一般に、リン酸化の阻害、転写活性の調節、タンパク質の安定化、細胞内局在の調節など、さまざまな機能を持っている。
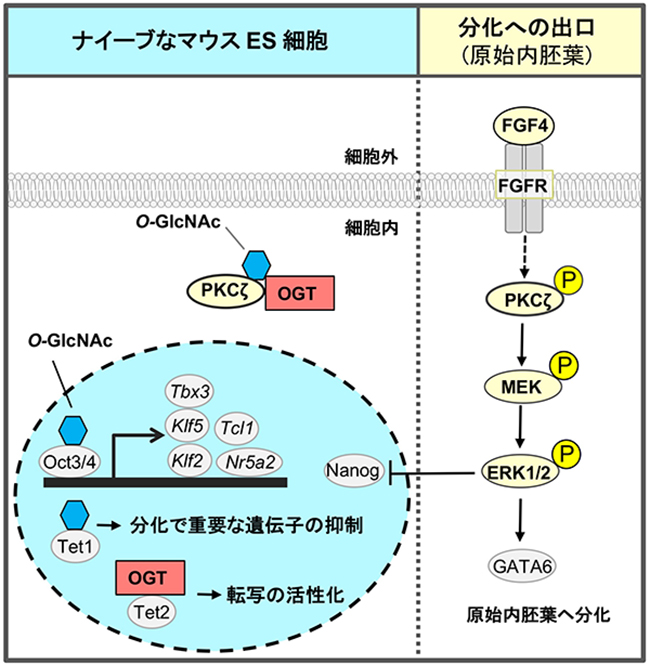
ナイーブなマウスESCsの自己複製と多能性に必要な糖転移酵素のRNAiスクリーニングで三番目に見いだされた糖鎖は、O-GlcNAcであった2,13,14。リン酸化されるSer/Thr残基やその近傍でO-GlcNAc修飾が行われることが多く、O-GlcNAc修飾とリン酸化修飾は競合関係にあるとされている。線維芽細胞増殖因子(FGF)4シグナルは、マウスESCsの分化への出口として重要で、未分化状態を抑制し、分化を促進する。我々は、マウスESCsが未分化性を維持するためには、FGF4シグナルを抑制する機構が存在すると仮定し、O-GlcNAcによるリン酸化の阻害に注目した。FGF受容体の下流でmitogen-activated protein kinase kinase (MEK) - extracellular signal-regulated kinase 1/2 (ERK1/2) 経路がリン酸化され、FGF4シグナルは活性化する(図 1,3)。リン酸化ERK1/2は未分化性維持に関わる転写因子であるNanogの発現を抑制する。Ogt ノックダウン(KD)マウスESCsでは、FGF4-MEK-ERK1/2経路が活性化し、未分化性が低下して分化が促進していた。一方、ナイーブなマウスESCsでは、FGF4シグナル構成因子のprotein kinase c ζ(PKCζ)のThr410が、O-GlcNAc修飾されていた。PKCζはThr410がリン酸化されると活性化して、下流のMEK-ERK1/2経路を活性化する。ナイーブなマウスES細胞では、Thr410がO-GlcNAc修飾を受け、PKCζのリン酸化が阻害され、FGF4シグナルが抑制されていることがわかった14(図 3)。すなわち、ナイーブなマウスESCsでは、O-GlcNAcがFGF4シグナルを抑制し、未分化性維持に寄与していた。
シグナル構成因子の制御に加えて、O-GlcNAcは、多能性幹細胞で転写因子やエピジェネティック因子も制御していることが、他のグループから報告されている2。多能性に関与する転写因子であるOct4とSox2がナイーブなマウスESCsでO-GlcNAc化されており、分化に伴いそれらは除去される15。Oct4のThr228のO-GlcNAc修飾は、Oct4の転写活性を正に制御し、ナイーブ状態の維持に必須な遺伝子、Klf2、Klf5、Nr5a2、Tbx3、Tcl1などの誘導に重要であった15(図 3)。Ten eleven translocation(Tet)1はO-GlcNAc修飾を受けると安定化し、Sin3A、NuRDと抑制型クロマチン構造を形成する複合体を作り、分化で重要となる遺伝子の発現を抑えていた16。その一方で、Tet2はOGTをヒストンH2Bへリクルートし、ヒストンH2BのSer112をO-GlcNAc化して転写を活性化していた17。この様に、O-GlcNAcは実に多様な機能を持ち、ナイーブなマウスESCsの維持に働いていた。
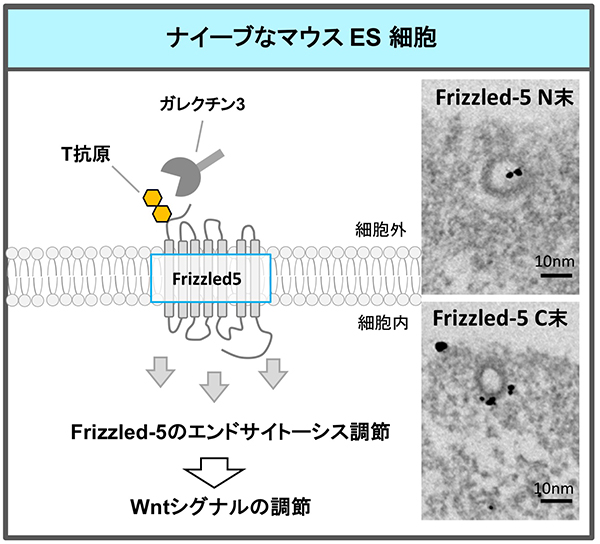
最近、ナイーブなマウスESCsの自己複製能と多能性に必要な糖転移酵素のRNAiスクリーニングにより、4番目の糖転移酵素、コア1β1,3-ガラクース転移酵素(C1GalT1)を同定した18。C1GalT1はT抗原(Galβ1-3GalNAc)を合成する。T抗原は一般の細胞や組織に多く存在するムチン型O-結合型糖鎖ある。ナイーブなマウスESCsでは、ムチン型糖鎖修飾経路のうち、C1GalT1の合成から始まる伸長経路が主となっていた。C1GalT1 をKDすると、ESCsは多能性を失い、栄養外胚葉へ分化した。さらに、Frizzled-5はT抗原を持ち、T抗原に結合するガレクチン-3を介してFrizzled-5のエンドサイトーシスが直接調節されていることを見出した(図 4)。T抗原が減少すると、カノニカルなWntシグナルが過剰となり、多能性状態から抜け出し分化していた。これは、Wntシグナルの新規な調節機構、また、ESCsの新しい調節機構を示すものだった。
上記の様に、4種類の異なる糖鎖が幹細胞の未分化状態の維持に関わっていた。これらの糖鎖構造はすべて、ショウジョウバエから哺乳類まで進化的に保存されている。おそらく、糖鎖による細胞シグナル伝達の調節メカニズムの原型が種を超えて保存されているためと考えている。
ヒトで200種ともいわれる糖転移酵素が、非常に多様で複雑な糖鎖を合成する。糖タンパク質と糖脂質上にある様々な糖鎖構造は、これらの糖転移酵素の解析から、推定することができる。 酵母から哺乳動物への進化において、糖転移酵素の基本的な遺伝子ファミリーの構築は、線虫とショウジョウバエを含む前口動物と哺乳類へと進化する後口動物の分岐の前に完了した19。 したがって、重要な糖鎖構造の多くは、通常のタンパク質の場合と同様に、種を超えて保存されていると考えられる。
ショウジョウバエの生殖幹細胞、腸幹細胞、造血幹細胞、神経幹細胞などの組織幹細胞は、哺乳類の組織幹細胞の良いモデルとなっている2,19。幹細胞ニッチと呼ばれる特定の環境が、組織幹細胞の維持に必要であり、幹細胞ニッチからの外因性シグナルと幹細胞自身の内因性調節因子が重要となる。組織幹細胞は非対称に分裂し、ニッチに接触する娘細胞はニッチから外因性のシグナルを受け取り幹細胞になるが、ニッチに接触していない娘細胞は成熟した組織細胞へと分化し始める。 多くのグループが、HSプロテオグリカンが、幹細胞ニッチから生殖細胞幹細胞へのBMPシグナルに関与していること20、腸幹細胞、造血幹細胞、神経幹細胞自身の増殖または維持のため、上皮成長因子(EGF)、ヘッジホッグ(Hh)、FGFグナルに関与していることを報告している19。
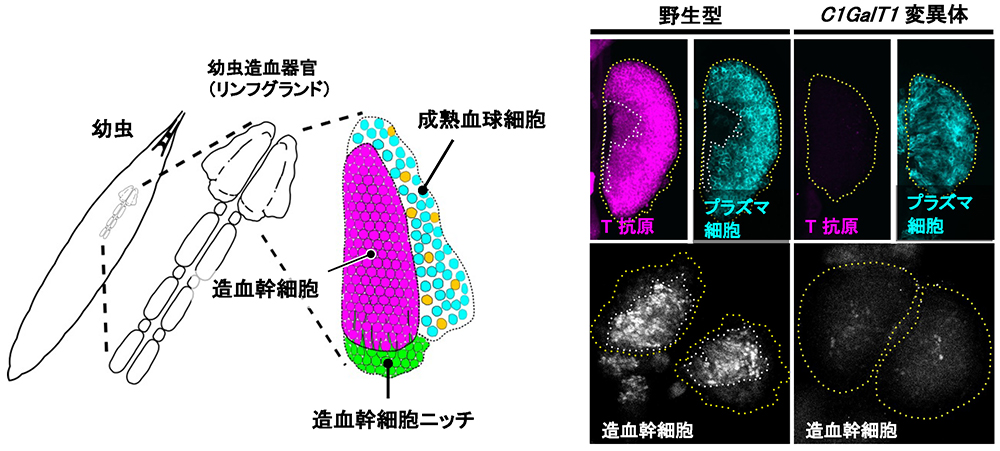
ショウジョウバエとヒトで保存されている糖鎖機能の分析をしていたところ、造血幹細胞の維持には、ムチン型O-結合型糖鎖の1つであるT抗原(Galβ1,3GalNAc)が必要であることがわかってきた21。ショウジョウバエには、胚と幼虫の2つの発生段階で異なる造血が行われる。幼虫の造血器官は、背側表皮のすぐ下のリンフグランドであり、リンフグランドの一次葉は、造血幹細胞ニッチ、造血幹細胞、成熟血球細胞の3つの領域から構成される(図 5)。ショウジョウバエの成熟血球細胞は、脊椎動物の骨髄細胞系統に対応する3種類の細胞、プラズマ細胞、クリスタル細胞、およびラメロサイトで構成されている。脊椎動物のマクロファージに対応するプラズマ細胞は、成熟血球全体の95%以上を占め、細胞性免疫や食作用で働いている。
ショウジョウバエC1GalT1(dC1GalT1)変異体の幼虫では、T抗原が減少し、造血幹細胞が失われていた(図 5)21。すべての幼虫の器官は血リンパに浸されている。このため、血リンパは、造血器官にとって好ましい環境を作り出すために重要な働きをしている。プラズマ細胞から血リンパに分泌されるヘモレクチン(Hml)は、血リンパの凝固に関わっている。Hml上のムチン型O-結合型糖鎖であるT抗原は、血リンパの生化学的特性を決定し、造血幹細胞ニッチの糸状仮足の伸展に好ましい条件を整えていた。T抗原の減少は、血リンパまたはHml自体の特性を変化させ、凝固因子であるHmlがリンフグランドの周りに殻の様な凝集体を形成することを可能にし、造血幹細胞ニッチからの糸状仮足の伸長を阻害して、造血幹細胞の喪失をもたらしていた。
上記のように、HSプロテオグリカンとムチン型O-結合型糖鎖であるT抗原の両者は、ナイーブな多能性幹細胞の維持のみならず、ショウジョウバエ組織幹細胞の維持においても、重要な機能を果たしていた。
マウスESCsは、E3.5-E4.5の着床前胚に由来し22、ESCsからin vitroで分化誘導できるエピブラスト様細胞(EpiLCs)は、E5.5-E6.5の着床後胚に類似している23。 マウスESCsとマウスエピブラスト様細胞は、それぞれナイーブ状態とプライム状態という2つの異なる多能性状態を反映しており、着床に伴う多能性状態の遷移を調べるためのin vitroの有用なモデルとなる24。
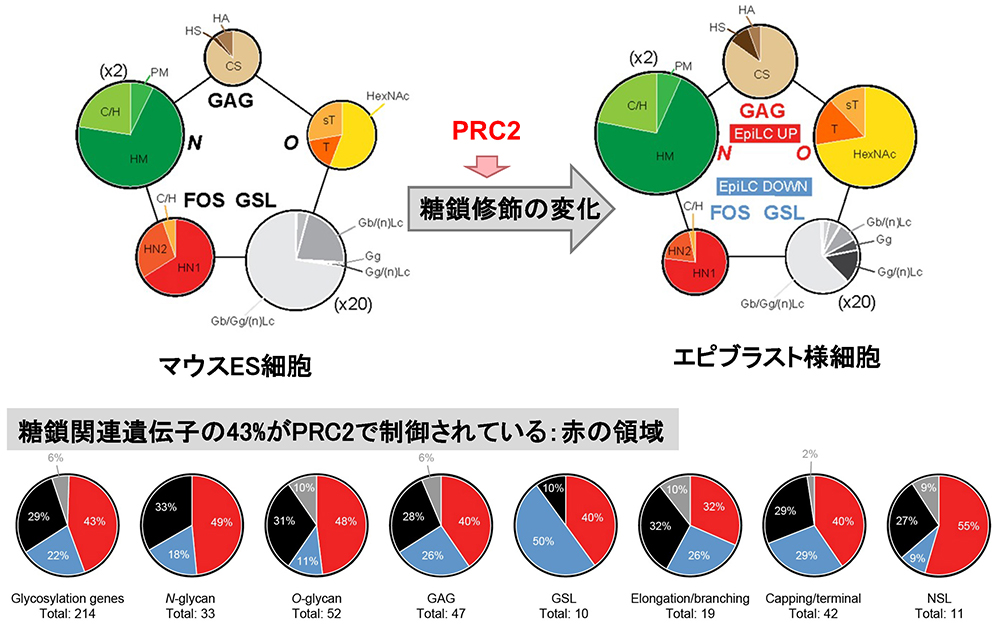
ESCsとEpiLCsの全糖鎖構造解析を行い、N-結合型糖鎖、O-結合型糖鎖、グリコサミノグリカン(GAGs)、糖脂質(GSLs)、遊離オリゴ糖(FOSs)など、全てのタイプの糖鎖に属する糖鎖構造の絶対量を決定した25。また、全糖鎖構造解析と同じサンプルで全ての糖転移酵素の発現量を定量的に解析した。全てのタイプの糖鎖修飾は、発生の初期段階から、転写レベルと構造レベルの両方で劇的に変化していた(図 6)。さらに両細胞の各々に特徴的な糖鎖構造を、従来のものに加えて、全てのタイプの糖鎖で新規に見出すことができた。これらは、ナイーブ状態とプライム状態の2つの多能性状態を区別するための新規マーカーになると考えられた。また、マウスESCsとEpiLCsの両者は、他の細胞株(ヒトESCsや正常あるいは癌の体細胞株など)に比較して26、特徴的な全糖鎖構造のプロファイルを示し、他のタイプの糖鎖よりも大量にGSLsが発現していた(図 6)。 ESCsからEpiLCs への遷移では、GSLsとFOSsの発現は減少したが、N-結合型糖鎖、O-結合型糖鎖、GAGsは増加していた。
ポリコーム抑制複合体2(PRC2)は、ヒストンH3リジン27(H3K27me3)をトリメチル化し、遺伝子の発現を抑制する27。 我々は、PRC2が、ESCsからEpiLCsへの遷移に伴って引き起こされる劇的な糖鎖構造の変化をトータルに調整するネットワークの中心となっていることを明らかにした。 最初に、ChIP-Atlasの包括的なデータベース(https://chip-atlas.org)28を用いて、これまでに公開されているESCsのクロマチン免疫沈降-シーケンス(ChIP-seq)データセットを詳細に解析し、糖転移酵素などの糖鎖関連遺伝子のプロモーター領域で濃縮されている因子を検索した。ESCsにおいて、PRC2複合体が、すべての糖鎖修飾のタイプにわたる様々な糖鎖関連遺伝子のプロモーター領域に濃縮されていることを見出し、H3K27me3修飾を顕著に減少させるPRC2阻害剤EED226を用いて、それを確認した。 ESCsからEpiLCsへの遷移とEED226処理前後のESCsでフローサイトメーターにより糖鎖構造の変化を比較したところ、EpiLCsへの遷移とEED226処理前後において、多くの構造が同様な変化を示し、遷移におけるPRC2の直接的な関与が考えられた。さらに、ESCsとEpiLCs、および、EED226処理前後における糖転移酵素などの糖鎖関連遺伝子の発現の違いをRNA-seqで比較した。遺伝子の43%がEpiLCsとEED226処理ESCsで、同様な発現変化を示し、PRC2による制御を受けていた(図 6)。これらの結果は、発生初期におけるPRC2による「全糖鎖修飾の変化をトータルに制御するネットワーク」の存在を示していた。
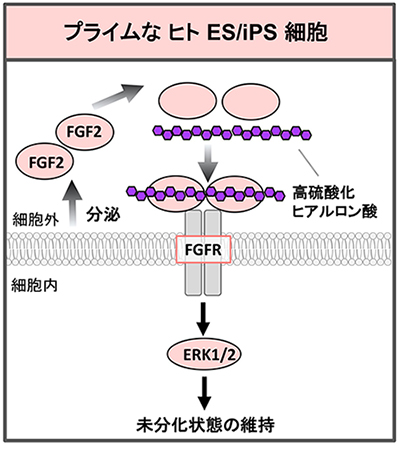
ヒトESCs/iPSCsに発現する全糖鎖の種類について絶対量を比較すると、ヘパラン硫酸やコンドロイチン硫酸を含む硫酸化されたGAGsが半分以上を占めている26。プライムなヒトESCs/iPSCs上のGAGsの機能はよくわかっていないが、実際には、血清なしの培地ではFGF2とヘパリンが加えられている29。また、フィーダー細胞から分泌、あるいは、ESCs/iPSCs自身が合成するHSはFGF2と結合してFGF2を安定化し、増殖と多能性維持に重要であると考えられる。
一方、ヒアルロン酸(HA)は、GAGsの一種であり、グルクロン酸とN-アセチルグルコサミンの二糖繰り返し構造によって構成されるが、他のGAGsとは異なり、硫酸化されていない。我々は、最近、HAを人工的に硫酸化し、硫酸化度を自在に調節することに成功した。高度に硫酸化したHA(1つの二糖繰り返し構造に対して4箇所のOHが硫酸化できるが、1つの繰り返し構造当たり3.63個が硫酸化されているもの)は、FGF2にヘパリンより強く結合した30。これを培地に加えてヒトiPSCsを培養したところ、フィーダー細胞なし、FGF2の添加なし、血清なしの条件で多能性を保って培養することができた30(図 7)。実際、高硫酸化HAの添加によりFGFシグナルの増強も認められた。高硫酸化HAが複数のFGF2と結合することにより、FGF受容体の二量体形成が促進され、その結果、シグナルが増強したと考えている。我々は、低硫酸化したHAも合成している。これらの硫酸化度が異なるHAを適切に使用することにより、in vivoにおけるHSやCSなどのGAGsの機能を、他の動物種からの生体分子の汚染なしに模倣することができる。多くの再生医療の局面で、生体内の発生過程により近い分化培養の開発などに役立つと考えられ、様々な細胞外からのシグナルを安全に調整することを可能にすると期待される。
これまで述べた様に、幹細胞表面にある様々なタイプの糖鎖は、細胞外からの主要なシグナルの受容を制御して、幹細胞の多能性維持や分化に関与していた。さらに、細胞内の唯一の糖鎖修飾であるO-GlcNAcは、下流のシグナル伝達分子のリン酸化を制御して、これもまた、幹細胞の多能性維持や分化に関与していた。ここに述べた糖鎖の機能は、我々の仕事を中心とした一部の糖鎖機能であり、糖鎖は、まだ解明されていない機能も含め、さらに多くの機能を持っている。これらの糖鎖の機能を理解し、その機能を応用すれば、これまでと異なる新たな視点から、幹細胞生物学や発生学、さらには、様々な生命科学の問題の解明が可能となる。糖鎖機能の理解と応用は、再生医療はもちろん、難治性疾患や希少疾患、癌など、多くの医療分野の発展にも貢献すると期待している。