
氏名:森実 飛鳥
京都大学iPS細胞研究所特定拠点講師
2004年京都大学大学院医学研究科博士課程を卒業、博士号を取得。その後、神戸市立中央市民病院で脳神経外科医として臨床業務に従事。2006-2008年スウェーデンルンド大学にポスドク研究員として留学。帰国後、京都大学再生医科学研究所および同iPS細胞研究所で研究員。2012年よりiPS細胞研究所特定拠点助教。2019年4月より現職。研究テーマは幹細胞を用いた中枢神経疾患に対する細胞移植治療。最近は、移植後免疫反応の制御などについて取り組んでいる。

氏名:高橋 淳
京都大学iPS細胞研究所 臨床応用研究部門 教授
博士(医学)
1986年京都大学医学部卒業。脳神経外科専門医。細胞移植による神経再生を目指して2007年京都大学再生医科学研究所准教授として研究生活にシフトし、2012年から現職。2018年パーキンソン病に対するドパミン神経前駆細胞移植の治験を開始。
人工多能性幹細胞(iPS細胞)を用いたパーキンソン病に対する細胞移植治療が医師主導治験として2018年より始まった。iPS細胞は身体を構成する様々な細胞に分化できる高い分化能(多能性)と高い増殖能を持つ細胞である。パーキンソン病では脳のドパミン神経が失われている。細胞移植治療はiPS細胞からドパミン神経を誘導して、それらを脳に移植し、失われた機能を補う。iPS細胞からドパミン神経を作るには、様々な誘導因子を加えて培養(分化誘導)する必要がある。発生学の知識を応用した長年の研究により、ドパミン神経誘導技術が開発された。今後は世界各国で行われつつある臨床試験の結果を科学的に慎重に評価することが必要である。パーキンソン病をはじめ、様々な疾病でiPS細胞を用いた細胞移植治療が新たな治療選択肢になることが期待される。
パーキンソン病(PD)は脳の黒質という部分にあるドパミン神経細胞が進行性に脱落することにより、手足の震えやこわばり、運動低下などを生じる疾患である1。多くは50歳以降に発症し、日本には約16.3万人、世界中で約600万人の患者がいると言われている。PDの標準治療は内服治療であり、治療開始時には有効である事が多い。ところが、発症から時間が経つにつれて薬が効きづらくなり、副作用が出てくる。そこで、追加の治療選択が考慮される。 現存する外科治療としてPDに対する深部脳刺激療法(deep brain stimulation: DBS)がある。これは電極を脳内に埋め込む治療法で、脳のペースメーカーとも例えられる。この治療は正しい手術適応のもとでは有効な治療である。しかし、内服治療やDBSを行っても、内在性のドパミン神経の脱落は進む一方である。細胞移植は失われたドパミン神経に代わり、外から必要な細胞を補充するという治療である。
中枢神経において細胞移植は既に臨床応用が行われている。1980年代の後半から欧米を中心に中絶胎児の中脳組織を用いた移植治療がPDに対し試験的に行われ、適切な症例には一定の効果が確認された2。中には移植治療の効果により内服治療から完全に離脱でき、長期間経過している症例も報告されている。胎児の中脳組織には将来ドパミン神経になるドパミン前駆細胞が含まれている。完全に成熟したドパミン神経は移植しても生着しないが、未成熟な前駆細胞は生着することが動物実験で示されている。ヒト胎児の場合は妊娠11週以前のものがよく生着すると言われており、1人のPD患者を治療するにはそれら中絶胎児の中脳組織を4-8体分も準備する必要がある。これだけの中絶胎児の組織を手術日に揃えて一定の質で準備するのは困難であり、一般的な治療とはなりにくい。また、これらの組織を凍結や冷蔵保存すると、細胞の質が落ちることが分かっている。そこで、中絶胎児の中脳組織の代わりにiPS細胞をはじめとする幹細胞由来のドパミン神経前駆細胞をドナー細胞として利用しようとする研究が行われるようになった。
iPS細胞は培養皿の中で維持培養液にて培養すると、細胞分裂を繰り返し、iPS細胞として増殖していく。一方、分化させるには培養液の組成を変えると、分裂しながら目的とする細胞に分化していく(Fig.1a)。iPS細胞の維持には多くのシグナル分子が働いているが、その中でもBMPシグナルとActivinシグナルの働きを阻害する薬剤を加えると、効率よく神経に分化することが知られている。さらに神経の中でもドパミン神経を誘導するにはWnt刺激剤およびFGF8やソニック・ヘッジホッグ(SHH)などの成長因子と呼ばれるものを添加する(Fig.1b)。これらの因子は発生生物学の研究によって発見された因子であり、iPS細胞からの分化誘導でも正常の胎児の脳神経の発生を模倣することにより、目的とする細胞に誘導できることが分かっている。各因子を培養液中に添加する濃度、タイミングなどは緻密な実験を繰り返して決定され、プロトコールとして確立されてきた3。多能性幹細胞は様々な細胞に分化する多能性を持つために、分化誘導を行うと目的以外の細胞も出現してくる。また、同時に分化を開始しても、ある程度時間が経つと、分化が進んだ細胞と未分化な細胞が混在してくる。未熟な細胞が多く含まれると、移植後に腫瘍となる可能性があり、成熟しすぎた細胞は移植後に多くが死んでしまう。そのため目的とする「分化方向」の細胞を適度な「分化度」で高率に分化誘導する技術が必要である。さらに筆者らは抗体を用いて、必要な細胞を集めてくるソーティングという技術を用いて移植細胞の準備を行っている(Fig.1b)。
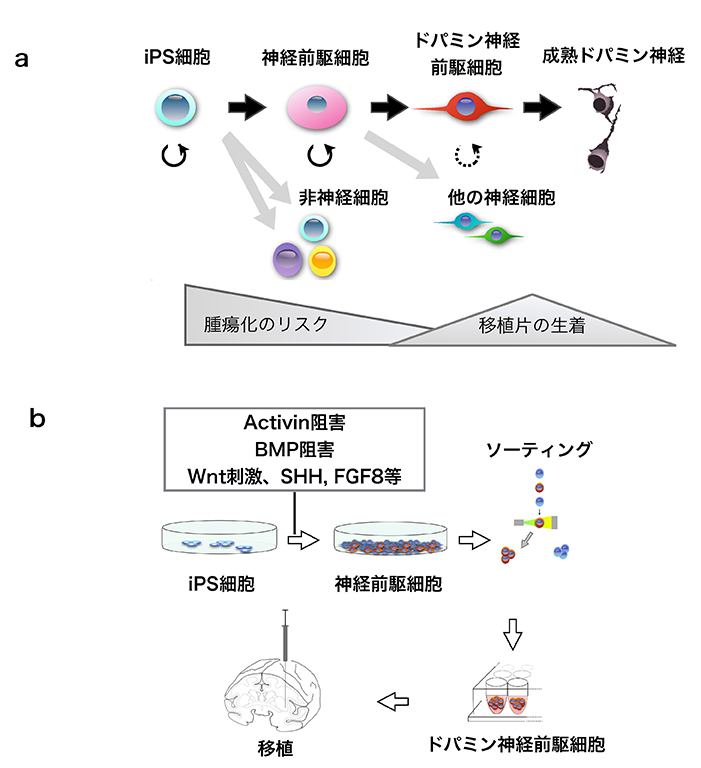
マウス、ラット、カニクイザルなどの動物に特定の神経毒を投与し、ドパミン神経を脱落させると、PDの薬剤傷害モデルができる。移植治療の研究ではこれらのPDモデル動物を使う事が多い。これらのPDモデル動物に、誘導したドパミン神経前駆細胞を移植し、行動が改善するかどうか、組織学的に移植細胞が生着しているか等を確認する。とくに筆者らは臨床応用で用いるプロトコールと同様の方法によりヒトiPS細胞から誘導されたドナー細胞をカニクイザルのPDモデルに移植し、移植後最長2年の経過を観察した。すると移植片の過増大や腫瘍化のないことがMRIなどの画像診断および病理組織学的に確認できた。 PDの神経学的症状のスコアやビデオを用いた観察によりサルの自発運動が移植後に改善したことが示され、PETによる画像検査でも移植した細胞が機能していることが確認された4。
実験動物を用いた多くの研究で有効性、安全性が確認されたため、臨床応用にむけた準備が世界中で始まっている。臨床用の細胞を準備するには、研究レベルで細胞を準備する環境とは異なり、より厳格なレベルでの製造環境が必要となる。ハード面、 ソフト面について原材料の入荷から製造、最終製品の出荷にいたるすべての過程において、製品が「安全」に作られ、「一定の品質」が保たれるように細かく法令で規定されている。これには細胞培養加工施設(cell processing center: CPC)の設置と運用も含まれる。
どのような患者にこの治療が向いているかも考えなくてはいけない。PDの全ての患者に細胞療法が有効というわけではなく、細胞療法に適した病型や時期があると考えられる。そもそも前述のようにPDの初期には内服治療が有効である。また病気が進行しすぎた状態では細胞療法の効果が期待できない。移植した神経がホスト側の神経に作用し効果を発揮するためには、ホスト側の神経がある程度残っており、放出されたドパミンに反応できる必要がある。
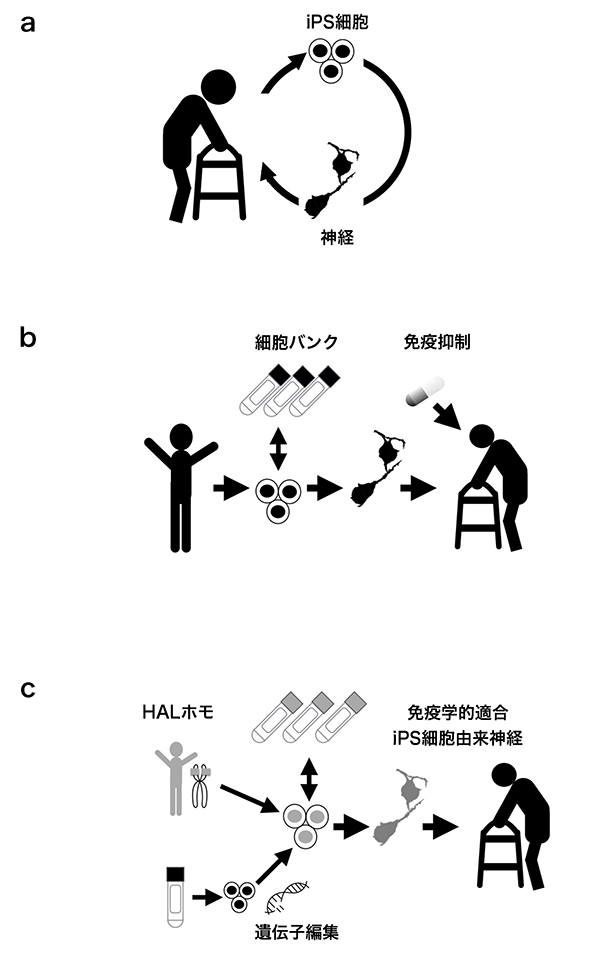
また、拒絶反応についても考える必要がある(Fig.2)。iPS細胞を移植治療に応用するには3つの戦略が考えられる。第1は患者自身の体細胞からiPS細胞を作り、目的細胞に分化誘導し、自分に戻す「自家移植」である5(Fig.2a)。この方法は免疫拒絶反応を起こさないので理想的に思えるかもしれないが、実際にそれぞれの患者ごとにiPS細胞を樹立し準備をするのはコストが高く、現時点では一般的な医療とはなりにくい。さらに患者自身の細胞から作られた細胞は同じ遺伝子を持つために、病気という環境に弱い(疾患感受性)可能性も無視できない。10%程度のPD患者は疾患関連遺伝子の関与があると考えられている。第2の方法として、他人(健常人)由来の幹細胞を用いて移植を行う方法である(Fig.2b)。この場合、予め大量に細胞を準備し、十分な検査をしておくことが可能である。ただし、移植後の免疫反応を考える必要がある。脳は他臓器と比べると免疫反応の起きにくい臓器であるが、細胞移植後には免疫反応が起きうる。そのために免疫抑制剤を用いる必要があると考えられている。第3のオプションとして免疫反応が起きにくい細胞を用いる方法である(Fig.2c)。その1つがヒト白血球抗原(human leukocyte antigen: HLA)ホモiPS細胞を用いたHLA-適合移植である6。HLAは細胞表面に発現するタンパクで、移植における免疫拒絶反応に深く関与している。特にHLA-A、-B、-DRという3つの遺伝子の型がドナー・ホスト間で一致している場合は拒絶反応が起きにくいといわれている。患者のHLAの型にあった健常人由来iPS細胞を用いて細胞移植を行うという方法がHLA適合移植である。特にHLA型がホモ型という特殊なドナーから樹立された場合、多くのレシピエントに適合する可能性が高い。また、近年は遺伝子工学の技術を用いてHLA分子を発現させないようにしたiPS細胞の研究も行われている7。このようなiPS細胞も移植後の免疫反応を起こしにくいと期待されている。
2020年現在、 日本ではHLAホモのiPS細胞株をから樹立した細胞を用い、 欧米では胎性幹細胞 (ES細胞)由来の細胞を用いて、パーキンソン病に対する細胞移植治療の臨床試験が進められている8。ES細胞はiPS細胞と同様、多能性幹細胞であり性質は似ているが、iPS細胞と異なり体細胞ではなく胚の細胞から樹立される点で異なる。PDの治療の主役は薬物療法であることは今後しばらくは変わらないであろう。まずは細胞移植治療が一つの治療選択として確立され、薬物療法やリハビリテーションなどの他の治療と組み合わせることで、多くの患者に恩恵をもたらすことが目標である。今後、PDに対する細胞移植治療が臨床で標準化されるためには、しっかりとしたサイエンスに基づき、安全面に十分に配慮しながら臨床研究を進めて行く必要がある。 新たな科学技術が登場した時、研究者は一般社会に対してわかり易く説明を行い、知識の普及に努めることが必要である。新しい技術や医療を普及させるには、倫理面も含めた社会的な合意を形成しながらそれらを発展させていくべきである。