
氏名:東 顕二郎
千葉大学大学院薬学研究院 製剤工学研究室 准教授
千葉大学薬学部製剤工学研究室において20年以上にわたり分子製剤学的研究を継続し、近年は薬物封入ナノ粒子の調製と構造評価に注力しています。cryo-TEM、SAXS/WAXS、固体NMR、分子シミュレーションを駆使し、分子レベルでの物性解析を展開しています。シクロデキストリン研究は学部時代から続けており、国内学会で若手研究者賞も受賞しています。
シクロデキストリン(CD)包接化合物結晶を粒子界面に析出させたPickeringエマルションが注目されている。植物ステロールエステル(PSE)とγ-CDからなるPickering エマルションでは、カプサイシンのマスキングや薬物放出制御に有効であることが示されている。しかし従来の報告は粒径が1 μm以上であり、そのナノ粒子化は十分に検討されていない。本研究では、PSEの主成分であるオレイン酸コレステリル(ChO)を用い、調製条件を工夫することでChO/γ-CDナノ粒子の調製に成功した。本ナノ粒子はChO結晶をコアとし、複数のChO/γ-CD包接化合物結晶からなるナノシートがシェルを構成する特異的なコアシェル構造を有していた。さらに、加熱及び胆汁成分に応答して構造変化を示す二重刺激応答性が認められた。本ナノ粒子は安価、調製が簡便、安全性の高い原料を用いているなど実用性が高く、刺激応答性キャリアとして各分野における展開が期待される。
シクロデキストリン(CD)は、グルコースがα(1→4)グリコシド結合によって環状に連なった環状オリゴ糖であり、高い生体適合性を有する1。バケツ型の立体構造を有し、1分子を構成するグルコース単位数に応じて様々なCDが存在し、構成単位数が6、7、及び8のCDは、それぞれα-CD、β-CD、及びγ-CD(Fig. 1a)と称され、異なる空洞径を有する。CDは、疎水性相互作用やvan der Waals力などを駆動力として、疎水性のゲスト化合物を空洞内に取り込み、包接化合物を形成する。このCDの包接特性は、ゲスト化合物の好ましくない味や臭いのマスキング、溶解性改善、光や熱に対する安定性改善などを目的として、医薬品、化粧品、食品、トイレタリー、及び繊維など幅広い分野で応用されている2。
CDは様々な粒子の分散安定化剤としての利用も検討されている3。また近年、CD包接化合物結晶を粒子界面に析出させたPickering エマルション(固体粒子によって安定化されたエマルション)がそのユニークな構造及び高い粒子分散安定性、放出制御能などの特性により高い注目を集めている4,5。Sasakoらは、脂質の一種である植物ステロールエステル(phytosterol ester : PSE)を用いた場合に、コアシェル構造を有するマイクロ粒子が調製可能であることを報告している6。本PSE/γ-CDマイクロ粒子は、液体状態のPSE単独相から成るコア相を、PSE/γ-CD包接化合物結晶からなるシェル相が被覆したPickeringエマルションである。本マイクロ粒子に辛味成分であるカプサイシンを封入することで、口腔内におけるマスキングが可能であり、食品分野で実用化されている7。さらに、本マイクロ粒子は優れた薬物放出制御能を有し、口腔内及び胃内環境でカプサイシン放出を抑制する一方、小腸内環境では速やかにカプサイシンを放出する8。
CD包接化合物結晶を用いたPickeringエマルションに関する報告は増加しているが、多くは粒子サイズが1 μm以上である。近年、ドラックデリバリーを指向した様々なナノ粒子(< 1 μm)が開発されている。ナノ粒子化することで、注射投与では、腫瘍や炎症部位への効率的な薬物送達が可能となり、また経口投与では薬物吸収性が改善される9。本研究では、PSE/γ-CDマイクロ粒子の更なる機能化を期待して、ナノ粒子化を検討した。PSEは複数のステロールエステルの混合物であるため、ナノ粒子の特性を正確に制御し、形成機構を詳細に理解するために、PSEの主成分脂質であるオレイン酸コレステリル(cholesteryl oleate: ChO)を用いた(Fig. 1b)。調製方法及び条件の工夫の結果、ChO/γ-CDナノ粒子を得ることに成功した10。本ChO/γ-CDナノ粒子はコアシェル構造を有し、ChO単独結晶からなるコア相を、複数のChO/γ-CD包接化合物結晶ナノシートからなるシェル相が被覆している特異的な構造を有していた。さらに興味深いことに、本ナノ粒子は加熱及び胆汁成分の添加により構造を変化させる刺激応答性を示すことが明らかとなった。本稿では、ナノ粒子の調製、構造評価、刺激応答性構造変化の結果を紹介する。
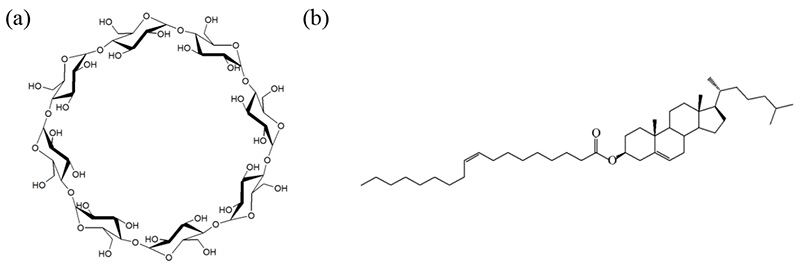
Fig. 2a に、トップダウン法による既存のPSE/γ-CDマイクロ粒子の調製法を示す。融点が20-30℃のPSEをγ-CD溶液中において70℃でホモジナイズ処理することで乳化したところ、約5 μmの粒子が得られている。本手法において組成や調製条件を変更してナノ化を検討したが、均一なナノ粒子を得ることは困難であった。そこで、ボトムアップアプローチ法の一つである溶媒拡散法を検討した。ここでは、γ-CD水溶液に対してChOを溶解させたエタノール溶液をホモジナイザー撹拌条件下で滴下した(Fig. 2b)。その結果、約170 nmの狭い粒度分布を示すナノ粒子懸濁液を得ることが出来た(本ナノ懸濁液をnanosuspension-I : NS-1とする)。
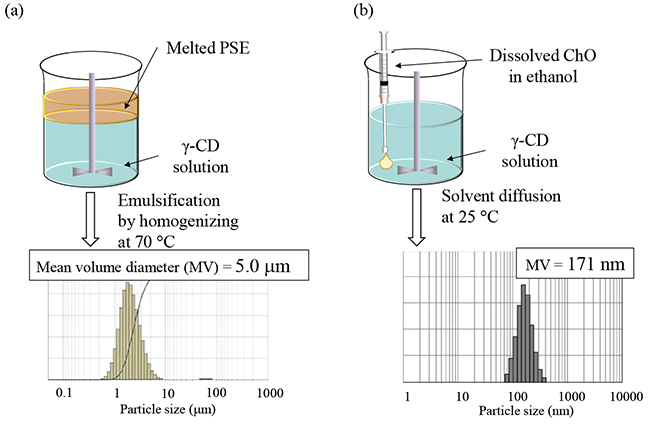
得られたNS-1中のナノ粒子の形態を評価する目的で、極低温透過型電子顕微鏡(cryogenic transmission electron microscopy : cryo-TEM)測定を行った(Fig. 3a)11。その結果、粒子径100 -200 nm程度の表面が滑らかな粒子が観察された。目的としていたCD包接化合物結晶が表面を被覆したコアシェル構造を示す粒子像が得られなかったため、本NS-Iについて各種製剤処理を施した。その結果、NS-Iを凍結することでコアシェル構造を有する粒子が形成されることが明らかとなった(本ナノ懸濁液をNS-IIとする)。本ナノ粒子のcryo-TEM像を詳細にみると、ChO/γ-CD包接化合物結晶に由来すると考えられる複数のナノシート構造物が粒子を被覆したユニークな構造を有することが分かる。本ナノシートの形成メカニズムとして、凍結濃縮が寄与していると考察した12。すなわち、NS-I中で溶解している微量のChO/γ-CD包接化合物が、凍結過程においてChOナノ粒子と共に濃縮されることで、ChO/γ-CD包接化合物結晶がナノシートとしてChO結晶界面に析出したと推察された。
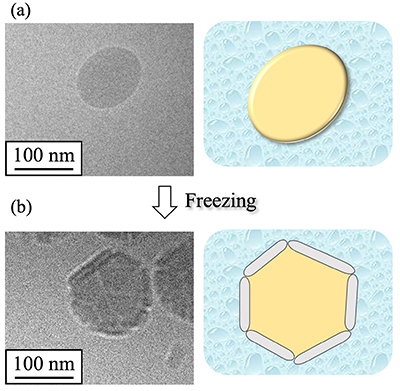
NS-IIの詳細な構造評価を目的として、原子間力顕微鏡(atomic force microscopy : AFM)測定を実施した(Fig. 4)。AFMでは、微細な針(探針)と試料の間に働く原子間力を検知して、ナノスケールの構造を3次元で観察する13。NS-IIのAFM画像では、高さ100-200 nm程度の粒子が複数認められた(Fig. 4a)。さらに、各粒子についてAFMフォース-ディスタンス測定を行い、NS-II中のナノ粒子の機械的特性を評価した。本測定では、探針を試料表面に近づける(approach)または離す(retract)際に、探針と試料の間に働く力を測定する。20個の粒子について評価した結果、いずれの粒子でも探針が粒子を貫通することなく、またNS-IIのapproachカーブ(Fig. 4b)及びretractカーブ(Fig. 4c)いずれも基盤の場合と同程度の傾きを示した。この結果は、NS-II中のナノ粒子の弾性が低く、硬いことを反映している14。
さらに、NS-IIに含まれるナノ粒子の構造を広角X線散乱(wide-angle X-ray diffraction (WAXD)測定により詳細に評価した(Fig. 5)。NS-IIのWAXDパターン(Fig. 5a)では、ChO/γ-CD包接化合物に由来する回折ピーク(図中ピンクの四角)、及びChO結晶に由来する回折ピーク(図中水色の菱形)が認められた。この結果は、NS-IIに含まれるナノ粒子は、ChO/γ-CD包接化合物結晶及びChO結晶を含有し、それぞれがシェル相並びにコア相を構成していることを反映した結果である。ここで、共沈法により別途調製したマイクロサイズのChO/γ-CD包接化合物結晶のWAXDパターン(Fig. 5b)と比較した。NS-II及びマイクロサイズの回折パターンでは共に、ChO/γ-CD包接化合物結晶が有するカラム状に配列したγ-CD分子が正方晶系に従って配列した(tetragonal-columnar:TC)形に特徴的なピークを示した(各ピークの上部に示した数字がその面指数である)15。しかし興味深いことに、NS-II中の回折ピークでは、TC形結晶構造のc軸方向の結晶面を反映する回折ピーク(図中赤文字の面指数)の強度が著しく低下した。TC形結晶構造のc軸方向はγ-CDのカラム構造の長さに対応しており、c軸方向の結晶面を反映する回折ピークの強度が相対的に低いことは、γ-CDのカラム構造の長さが短いことを意味する16。この結果はナノシートの形状を良く反映しており、cryo-TEM画像で認められたシート状のシェル相において、TC形結晶構造のc軸方向とシェル相の厚さ方向が対応していることが示された。
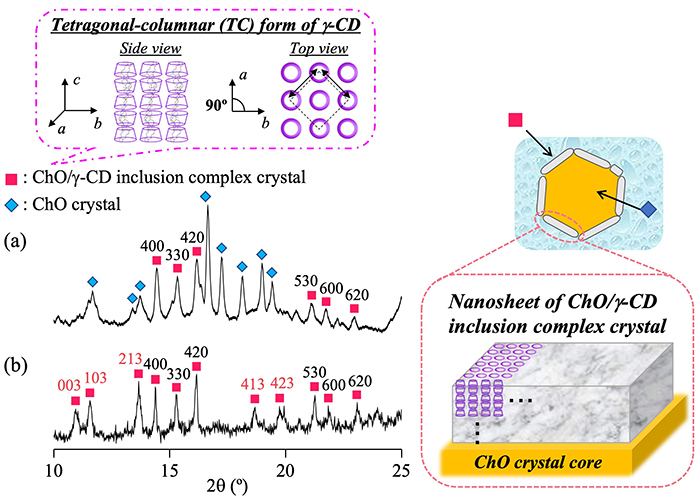
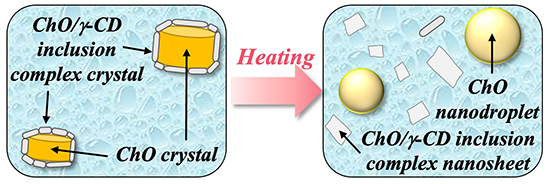
次に、ChO/γ-CDナノ粒子の各種刺激に対する構造変化を評価した。はじめに、加熱によるChO/γ-CDナノ粒子の形態変化をcryo-TEMにより評価した。Fig. 6にその模式図を示す。60°Cに加熱したNS-IIでは、表面が滑らかな球形粒子及びナノシートのみが観察され、25℃で観察されたコアシェル構造を有するナノ粒子は完全に消失した。この結果から、本ナノ粒子は加熱することでコアシェル構造を失う温度応答性を示すことが明らかとなった。加熱によるコア相及びシェル相の変化を詳細に評価するために、NS-IIについてin situ WAXD測定を行った。ChO結晶に由来する回折ピークは、加熱に伴い強度が顕著に低下し、45-55℃付近で消失した。この結果から、ChOが45-55℃付近で融解し、ChOナノ液滴が形成されたことが示された。一方、ChO/γ-CD包接化合物結晶に由来する回折ピークは、加熱に伴い強度が減少したものの、60℃においても残存していた。このことから、シェル相のナノシートは加熱に伴い一部が溶解するものの、60℃においてもその構造を維持していることが示された。ここで観察されたシェル相の解離は、温度上昇に伴うChO/γ-CD包接化合物結晶の溶解度の増加及び融解により、コアシェル界面に存在するChO/γ-CD包接化合物結晶が一部水相に溶出することで生じたと推察された。
近年、温度応答性キャリアの開発が精力的に進められているが、その多くは温度応答性脂質やポリマーの相転移を利用したものであり、ナノ粒子の形態自体は保持される場合がほとんどである17,18。これに対し、本研究で得られたChO/γ-CDナノ粒子は、加熱によりナノシートが解離する顕著な形態変化を示し、従来にないユニークな温度応答性キャリアとして位置づけられる。
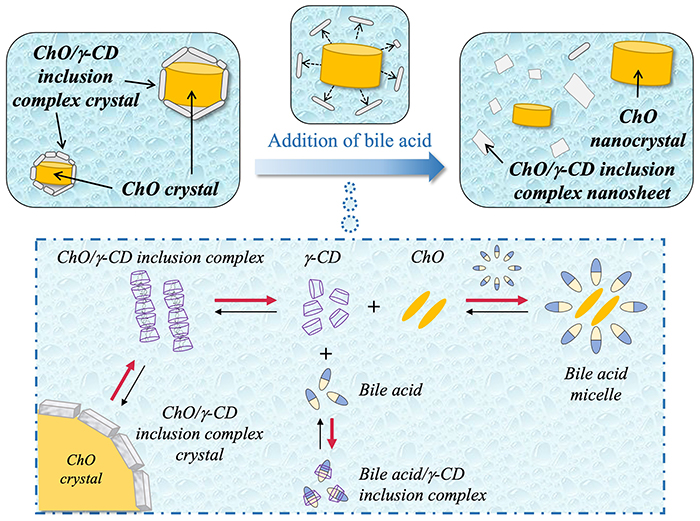
次に、胆汁成分を含有する摂食時人工腸液(fed state simulated intestinal fluid:FeSSIF)を用いて、胆汁成分の添加がChO/γ-CDナノ粒子の構造に及ぼす影響を評価した19。Cryo-TEM測定の結果、FeSSIF添加後の試料では、シリンダー状の粒子及びナノシートが観察され、コアシェル構造を有する粒子は消失した。この結果から、ChO/γ-CDナノ粒子はFeSSIFの添加により構造変化を起こす胆汁応答性を示すことが明らかとなった。FeSSIFを添加したNS-IIについてWAXD測定を行った結果、FeSSIF添加前と同様に、ChO/γ-CD包接化合物結晶に由来する回折ピーク及びChO結晶に由来する回折ピークが認められた。この結果より、シリンダー状の粒子はChO結晶、ナノシートはChO/γ-CD包接化合物結晶に由来することが確認された20。
Fig. 7に胆汁成分添加時のChO/γ-CDナノ粒子の構造変化及びそのメカニズムの模式図を示す。胆汁の主成分である胆汁酸は、水中においてミセルを形成し、ミセル内部の疎水性環境にChO分子を取り込むことで可溶化する21。また、胆汁酸/ γ-CD包接化合物は高い安定度定数を有するため、胆汁酸は容易にγ-CDに包接され、包接化合物を形成する22。バルクの水中には難水溶性のChO/γ-CD包接化合物が微量溶解しており、単独のγ-CD及びChO分子との間に平衡が成立している。ここに胆汁成分を添加すると、胆汁酸ミセルによるChOの可溶化及び胆汁酸/ γ-CD包接化合物の形成により、ナノ粒子のコアシェル界面に存在するChO/γ-CD包接化合物結晶の溶出が促進される。その結果、シェル相がナノ粒子界面から解離し、シリンダー状のChOナノ結晶及びChO/γ-CD包接化合物結晶ナノシートが形成されたと考察した。
近年、様々な刺激応答性キャリアの開発が検討されているが、ナノサイズの胆汁応答性キャリアに関する報告は過去に見受けられない。胆汁酸濃度は腸管で高くなるため、本ナノ粒子に封入された薬物の放出は胃を通過した後に腸で起きると予想される。この腸溶性機構は広く用いられているpH応答性腸溶性ポリマーを用いたものではなく、腸液に含有される胆汁酸と脂質のゲスト交換によるユニークなものである。本ナノ粒子は、新しいメカニズムに基づく経口腸溶性製剤としてその応用が期待される。
複数のChO/γ-CD包接化合物ナノシートがChO結晶を被覆した特異的なコアシェル構造を有するChO/γ-CDナノ粒子の調製に成功した。また、本ナノ粒子は温度及び胆汁成分により構造を大きく変化させるユニークな刺激応答性を有することが示された。近年、刺激応答性キャリアによる薬物放出制御が注目されており、特に外因性刺激(温度・磁場・光)及び内因性刺激(pH・酵素)の複数の刺激に応答するキャリアが生体内でより精密な薬物放出を可能にすると期待されている23,24。本ChO/γ-CDナノ粒子は、外因性刺激である加熱と、内因性刺激である胆汁成分の両方に応答する二重刺激応答性を示す。すでに本ナノ粒子には薬物が封入可能であることが明らかとしているが10、詳細な薬物の刺激応答性放出挙動は不明である。今後は、その刺激応答性薬物放出挙動の解明に取り組むとともに、様々な種類の脂質やCDの利用並びに調製法を検討することにより、医薬品、化粧品、食品などの様々な分野で応用できる脂質/CDナノ粒子の調製を目指す。本システムに用いる原料は安価で高い安全性を有することから、実用性は高く、今後の展開が期待される
本研究の遂行に際して多大なるご尽力を頂いた千葉大学大学院薬学研究院 森部 久仁一 教授、植田 圭祐 助教、石本 有沙 氏、大森 将貴 氏、ハウス食品グループ本社株式会社 神山 和夫 博士、笹子 浩史 氏に謹んで厚く御礼申し上げます。また、γ-CDを提供していただきました株式会社シクロケムに深く感謝致します。本研究におけるWAXD測定は、High Energy Accelerator Research Organization (KEK)の放射光共同利用実験施設(PF) BL-10C(課題番号:2019G532, 2021G562, and 2023G596)にて実施致しました。