
氏名:花松 久寿
東海国立大学機構 名古屋大学 糖鎖生命コア研究所 特任講師
2014年北海道大学大学院生命科学院 生命科学博士取得、同年から北海道大学生体機能化学研究室 博士研究員、2017年 北海道大学医学研究院・消化器内科学教室・先端的糖鎖臨床生物学分野 博士研究員、2019年 特任助教。2023年より現職。研究テーマは、シアル酸結合様式特異的修飾法の開発および総合グライコーム解析。

氏名:古川 潤一
東海国立大学機構 名古屋大学 糖鎖生命コア研究所(iGCORE))特任教授
北海道大学 整形外科学教室 客員教授
1996年北海道大学理学部卒業、2001年博士(地球環境科学)取得。2001年日本学術振興会特別研究員(北海道大学 理学部)、博士研究員を経て、2007年より理学部 特任助教。2016年より医学研究院 先端的糖鎖臨床生物学分野 特任准教授。2022年より現職。研究テーマは生物有機化学、糖鎖分析化学。独自の開発した分析ツールを用いた包括的な糖鎖分析について研究を進めている。
ヒューマングライコームプロジェクト(HGA)セグメント2において、私たちはN結合型糖鎖、O結合型糖鎖、スフィンゴ糖脂質(GSL)糖鎖、グリコサミノグリカン、遊離オリゴ糖を包括的に解析し、ヒトグライコームカタログ(ヒト血漿総合グライコーム)を格納することが私たちのミッションである。そしてTOHSAと呼ばれるナレッジデータベースの構築を目指している。本稿ではヒト血清・血漿を対象とした GSL 糖鎖解析について紹介したい。
様々な糖鎖が全ての真核生物の細胞の表面を覆っており、非常に多くの生命現象に関与することから、糖鎖はタンパク質や核酸に次ぐ「第三の生命鎖」として注目されている。様々な糖鎖は複合糖質に応じて分類される。タンパク質上の糖鎖は、アスパラギン残基に結合しているN結合型糖鎖もしくはセリン/スレオニン残基のO結合型糖鎖にそれぞれ分類される。グリコサミノグリカンの多くはコアプロテインに結合しており(プロテオグリカンと呼ばれる)、ヒアルロン酸のように硫酸基がなく遊離で存在しているものもある。疎水的なセラミドに結合した糖鎖はスフィンゴ糖脂質と呼ばれ、ヒトにおける主要な糖脂質である。私たちはこれまでに異なるクラスの複合糖質の調製法およびMALDI-TOF MSやHPLCを用いた解析技術を統合した総合グライコミクスと呼んでいる包括的な糖鎖解析法について報告してきた1-5。加えて、非還元末端にシアル酸残基を有するN-結合型、O-結合型そしてGSL糖鎖に対するいくつかのシアル酸結合様式特異的誘導化法(SALSA)を開発し、ラクトン環開裂アミノリシスによるN-結合型およびO-結合型糖鎖の解析法については本シリーズで既に紹介した(Glycoforum. 2024 Vol.27 (3), A9, Glycoforum. 2024 Vol.27 (6), A22)。私たちは、シアル酸の結合様式特異的なエステルからアミドへの変換によるシアリル化糖鎖異性体のユニークな識別法についても報告している6。本稿では、1)GSL糖鎖の解析法とLEAD-SALSA法による誘導化と2)大規模コホート研究に向けた自動ヒト血清/血漿GSL糖鎖調整システムの開発について紹介したい。
スフィンゴ糖脂質(GSLs)は骨格となるスフィンゴシンと脂肪酸からなるセラミド部分とグルコースやガラクトースもしくは様々な糖鎖からなる糖部分で構成されている。GSLは親水性と疎水性部分の両方を持つユニークな両親媒性の生体分子であり、スフィンゴミエリンやコレステロールと共に特異的なタンパク質が集合した細胞膜脂質ラフト(Lipid Raft)の構成成分の一つでもある。GSLは膜の物性や様々な生命現象における分子認識の場として寄与し、このような生物活性を持つGSL分子は、結果としてライソゾーム病、ガン、感染、動脈硬化、糖尿病や中枢神経系疾患など様々な病気の病態生理や発症機序に関わっている7-11。血清中では、ガングリオシドを含むGSLはアポタンパク質と会合し、様々なリポタンパク質として血液中を循環している12。GSLを構成している糖鎖構造についてはLIPID MAPに300 種類以上が報告されており(https://www.lipidmaps.org)、セラミドも脂肪酸のアシル基の長さ(鎖長)や二重結合や水酸基の有無など構造多様性に富んでいる。このような理由から、両方の複雑性を有するスフィンゴ糖脂質の解析は非常にチャレンジングである。私たちのGSLグライコミクスでは、糖鎖部分をエンドグリコセラミダーゼ消化によりGSLより切断することでセラミド部分の複雑性を排除するという戦略をとっている。解析方法については次のセクションで紹介する。
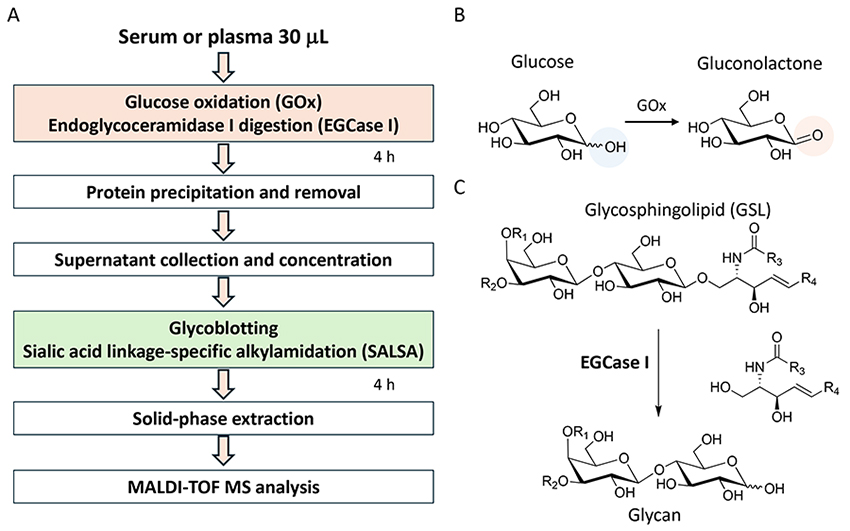
私たちが行っている GSL 糖鎖解析のプロトコルの概要をFigure 1Aに示した。 GSL-グライコミクスでは 30 µL の血清/血漿を使用しているが、GSL糖鎖の存在量がタンパク質上のN結合型糖鎖の約1/100と極めて低い理由からN-やO-グライコミクス解析よりも多くの量を用いている。さらに、血中における健常者のグルコース濃度は約 4.4-6.1 mmol/L であり13、アルデヒド基を持つグルコースはGSL糖鎖と同様に化学選択的にBlotGlycoビーズに捕捉される。そのため高濃度のグルコースはGSL 糖鎖の解析を妨げる一因となっている。そこで、私たちは糖鎖捕捉前に血清・血漿をグルコースオキダーゼ(Glucoseoxidase: GOx)で処理している。これによりグルコースは酸化され、アルデヒド基を持たないグルコノラクトンへと変換される(Figure 1B)。次に、エンドグリコセラミダーゼI(Endoglycoceramidase I: EGCase I)を用いて、GSL からの糖鎖部分を遊離させる(Figure 1C)。私たちは以前に細胞中のGSL糖鎖解析でEGCase I とII の両方を用いることが効果的であることを報告したが4、EGCase Iを過剰に使用すれば、単独でもヒト血清から網羅的にGSL糖鎖を切り出すのに十分であった14。GOxとEGCase Iによる酵素反応を同時に行った後、非常に濃度の低いGSL糖鎖を解析するには血中に含まれる大過剰のN-およびO-結合型糖が修飾されたタンパク質を酵素反応液から除く必要がある。手動では遠心分離により分画を行なっているが、自動化のために遠心分離の必要がない96 穴フォーマットのタンパク質除去プレートを用いている。タンパク質除去プレート上で9倍量のメタノール溶液に酵素反応液を加え、GSL糖鎖を含むパススルー画分を回収する。切断されたGSL 糖鎖はグライコブロッティング法で精製され、固相上で誘導化もできる。シアル酸結合様式特異的な誘導化(SALSA)を行った後で、GSL糖鎖はビーズから切り離され、イミン交換反応によりNα-([aminooxy]acetyl)tryptophanylarginine methyl ester (aoWR)で標識される15。最終的に過剰な aoWR 試薬の除去し、MALDI-TOF MSを用いて測定している。
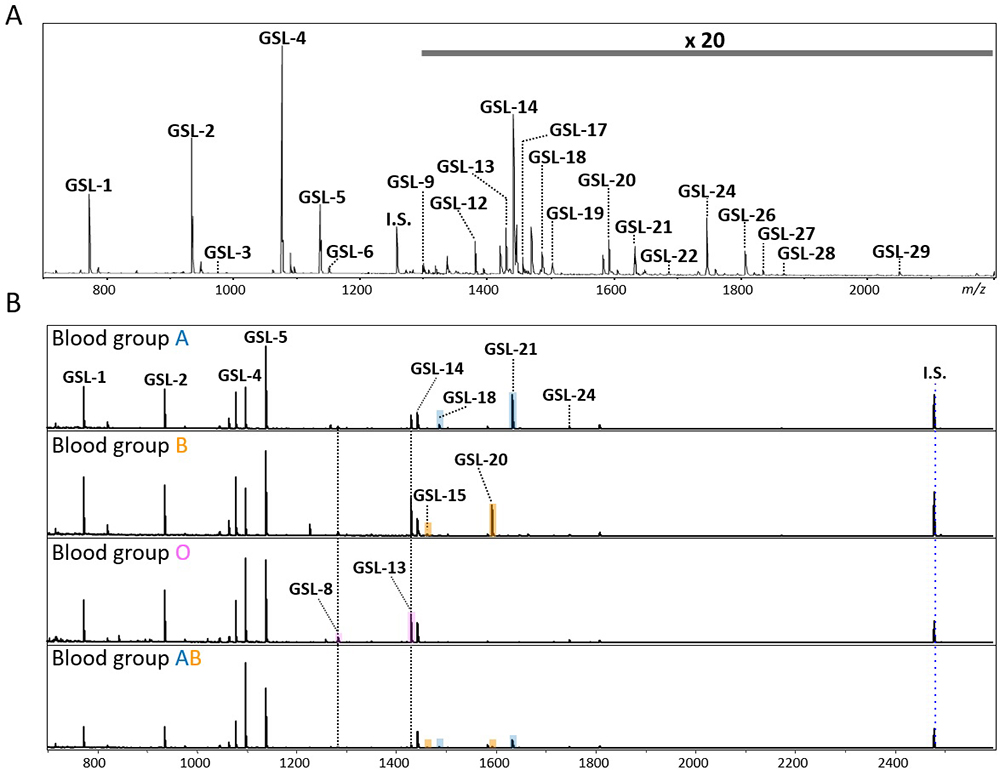
実際に本手法を用いて市販の標準血清の GSL 糖鎖解析を行った MALDI-TOF-MS スペクトルをFigure 2Aに示す。また GSL 糖鎖リストをTable 1にまとめているが、29 種類の GSL 糖鎖が検出されている。私たちは血液型特異的な GSL 糖鎖が血清・血漿に存在していることを明らかにした16。Figure 2Bに示すように、モノ(GSL-8: (Hex)3(HexNAc)1(Fuc)1)およびジフコシル化GSL糖鎖(GSL-13: (Hex)3(HexNAc)1(Fuc)2)は全ての血液型で観測された。A型の血清では、末端にαGalNAcを持つと思われるGSL-18((Hex)3 (HexNAc)2 (Fuc)1)および GSL-22 ((Hex)4 (HexNAc)2 (Fuc)1)が観測された。血液型Bでは、GalNAcの代わりにGalを持つ GSL-15((Hex)4 (HexNAc)1 (Fuc)1)およびGSL-20((Hex)4 (HexNAc)1 (Fuc)2)が血液型特異的抗原として検出された。AB型では両方の血液型糖鎖抗原が観測された。但し、これら血液型特異的GSL抗原が分泌されない非分泌型(Lea+,Leb−)では検出されなかった。Figure 1Aに示した本解析法では GSL 糖鎖だけはなく、遊離オリゴ糖(Free oligosaccharides: fOS)も同時に検出することも可能である。興味深いことに、GSL 糖鎖と同様に fOS でも血液型特異的な糖鎖が存在しており、こちらに関しては過去の文献を参照して頂きたい16。

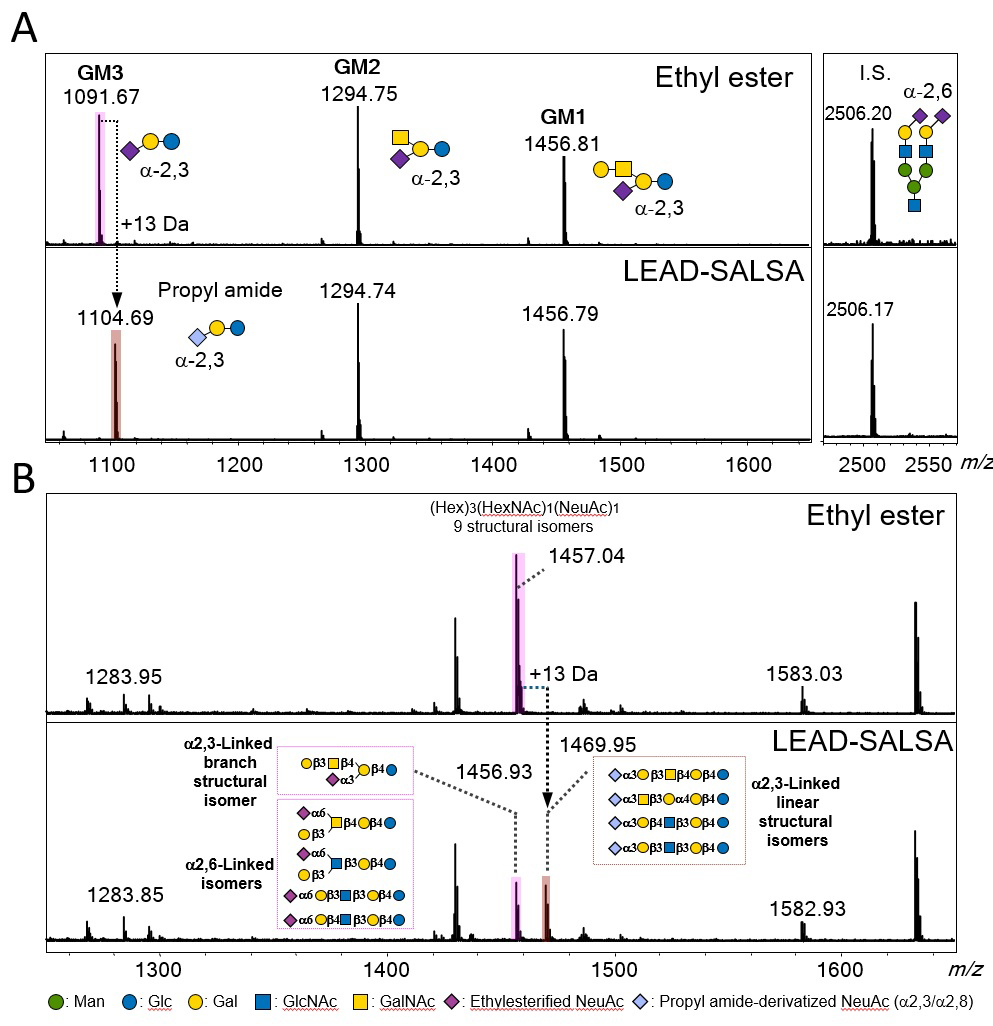
私たちはこれまでに質量分析でシアル酸の結合様式を識別するため、分子内ラクトン形成を基盤としたシアル酸結合様式特異的な修飾法を開発してきた6,17-19。その中の一つである LEAD (Lactone-driven-Ester-Amide)-SALSA 法について紹介したい6。エステル化されたシアリル化糖鎖は、MALDI-TOF MS 解析において非修飾シアリル化糖鎖よりも安定であるが、質量分析ではシアル酸結合様式の違いは区別できない。最近、私たちはメチルエステル化された α2,3結合のシアリル化糖鎖がアミン試薬を混合することで選択的にアミドへと変換するが、α2,6シアリル化糖鎖はメチルエステルのままであることを見出した。さらに、分子内ラクトンの安定性が選択的なエステル-アミド交換にとって重要であることを実験および密度汎関数理論(DFT)計算により明らかにした。このラクトン形成エネルギーの違いを利用することで、LEAD-SALSA 法はシアル酸の結合様式の識別だけではなく、シアル酸が結合したガラクトースの分岐構造の識別にも利用することができる。ウシ由来GM1、GM2、GM3 のLEAD-SALSA によるGSL-グライコミクスの結果をFigure 3Aに示した。エチルエステル化された GM3はアミドへと変換されたが、シアル酸が結合しているガラクトースが分岐構造を持つ GM1 や GM2 糖鎖はエチルエステルのままであった。次にヒト標準血清の GSL 糖鎖を分析した結果をFigure 3Bに示した。LEAD-SALSA 法では、m/z 1456 のシグナルがプロピルアミドへと変換したm/z 1469 のシグナルが同じシグナル強度で検出されている。これはFigure 3Bに示すように α2,3シアル酸を有する直鎖状の構造異性体が50% 程度存在していること示している。
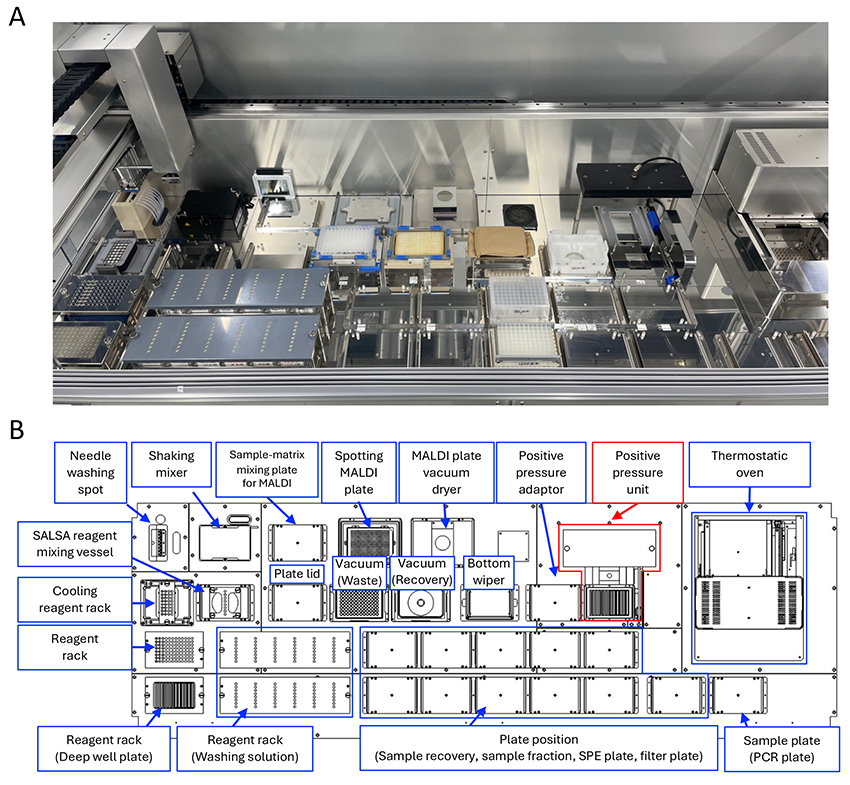
ヒューマングライコームプロジェクトにおいて、様々な複合糖質糖鎖に対応する大規模な糖鎖解析を行うためには、自動化されたサンプル調製プラットフォームの開発が不可欠である。私たちはこれまでに NおよびO型糖鎖自動前処理装置を構築してきた(Glycoforum. 2024 Vol.27 (3), A9, Glycoforum. 2024 Vol.27 (6), A22)。ここでは、これまで上述したGSL糖鎖の調製法に対応した自動前処理装置を紹介する(Figure 4A)。このシステムは96ウェルプレート規格の様々なプレートに対応しており、8 チャンネルのマルチシリンジで 1~2500 µLの分注に使用できる。恒温槽は室温から100 °Cまで制御が可能でき、酵素反応や糖鎖補足に利用できる。プレート攪拌ユニットはSALSA 反応の効率的に進行できる。さらに、精製および誘導体化された GSL 糖鎖はマトリクスと混合され、 MALDI プレートに点着される。この装置はN型糖鎖自動前処理装置とほぼ同じであるが、加圧ユニット(Figure 4B、赤線で囲ったユニット)が新たに搭載されている。この加圧ユニットにより、エタノール沈殿と遠心分離に代わってフィルタープレートを使ってタンパク質を除去できる。このシステムは96検体の血清/血漿からGSL 糖鎖を調製する全ての工程を可能にし、16時間程度で完了できる。
私たちは大規模 GSL 糖鎖解析に向けた自動前処理装置の開発に取り組み、ヒト血清/血漿には血液型特異的なグライコエピトープを含む様々な GSL 糖鎖が存在していることを示した。また、血清/血漿の N および O結合型糖鎖についても自動前処理装置で調製し、測定する準備は整っている。今後はこのような解析から得られる膨大な糖鎖データを迅速かつ正確に解析するソフトウェアの開発は必須である。そして、さまざまな生命現象における血清/血漿糖鎖の機能を解明し、バイオマーカーなどの発見に繋がることを期待している。