Aug. 01, 2025
岡島 徹也
氏名:岡島 徹也
名古屋大学糖鎖生命コア研究所・大学院医学系研究科 教授
1996年名古屋大学医学部卒、2000年 同大学院医学研究科修了、博士(医学)。米国ラトガース大学Ken Irvine研究室にて留学後、2005年より名古屋大学大学院生命農学研究科助教(松田幹研究室)、2008年より名古屋大学大学院医学系研究科附属神経疾患腫瘍分子医学研究センター講師(古川鋼一研究室)、2015年より同教授を務める。2018年より、 糖鎖生命コア研究所を兼務。2010年 日本生化学会奨励賞。NOTCH受容体の非典型的なO型糖鎖修飾の機能解析を通じて、糖鎖の新機能の探索を続けている。また、HGAにおけるコホート研究を通じた異分野の研究者との連携研究の推進に関わっている。
序文
ゲノムやプロテオーム解析においては、定型的な解析手法が確立されており、大規模集団を対象とした全ゲノム解析や網羅的なタンパク質解析がこれまでに実施され、主要な疾患との関連も明らかになりつつある1-5。 一方、ヒューマングライコームプロジェクトにおける糖鎖解析基盤の整備により、グライコーム解析も大規模集団を対象とした解析が可能となった6-9。 本レビューでは、健常者または疾患群を対象としたコホート研究を通じて得られた集団規模のグライコームデータが、糖鎖科学および生命科学全体にもたらす新たな可能性と期待について紹介する。
1. はじめに
ヒューマングライコームプロジェクト(Human Glycome Atlas Project、以下HGA)は、ヒトのグライコーム(糖鎖の全体像)を包括的に解析し、糖鎖が関与する疾患や生理現象の理解を深めることを目的とした、日本発の研究プロジェクトである10,11。中でも、大規模集団を対象とした糖鎖のコホート研究は、本プロジェクトに特有であり、世界でも前例のない試みである。 この研究の背景には、分子多様性に新たな次元を加える糖鎖に対して、網羅的な解析を可能とする技術基盤の確立がある。具体的には、総合的なグライコーム解析6,7,9に加え、ロボティクスを活用したグライコプロテオミクス解析8、さらには難同定糖鎖の定量解析といった先進的な手法が導入されている。本稿では、これらの解析技術を統合した大規模かつ網羅的な糖鎖解析を「集団グライコミクス」と位置づけ、その概要と将来展望について総説する。あわせて、HGAが提供する共同研究プラットフォームとしての役割を紹介し、糖鎖科学と他分野との融合による新たな研究展開へのイントロダクションとしたい。
2. 集団グライコミクスに基づく疾患バイオマーカーの探索
糖鎖が疾患に関与することは広く認識されており、特定の糖鎖抗原が腫瘍マーカーとしてすでに実用化されている例もある12,13。また、免疫グロブリンIgGに付加される糖鎖の構造が感染症や自己免疫疾患の病態に影響を与えることを示す報告14,15も多数あり、糖鎖は単なるバイオマーカーにとどまらず、生体内で機能的な役割を果たしていることが明らかになってきている。しかしながら、糖鎖は多くのタンパク質に付加されることで極めて多様なタンパク質の修飾構造として存在し、その分子種は膨大である。さらに、ゲノムやタンパク質とは異なる性質の多様性を有しており、糖鎖は分子多様性に新次元の複雑性をもたらすといえる。このため、糖鎖の網羅的な解析は依然として技術的に難しく、機能が明らかにされている糖鎖は全体のごく一部にとどまっている。こうした中、HGAにおける集団グライコーム解析は、あらゆる疾患と糖鎖の関連性を明らかにするコホート研究を大きく前進させる可能性を持つ。たとえば、疾患群におけるグライコーム解析の結果を、HGAが提供する糖鎖データベースと比較解析することで、存在比率の異なるバイオマーカー候補を同定することができ、疾患の有無を予測することが可能となる。また、疾患の早期段階における糖鎖プロファイルとの照合を通じて、より早期のバイオマーカー探索が可能になり、疾患の発症を抑制するための新たな介入法の開発にも貢献することが期待される。実際、アルツハイマー病においては、早期バイオマーカー探索が盛んに行われており16、グライコーム解析はそれらの治療法開発に貢献する可能性がある。今後、HGAで構築される糖鎖データベースと連携した学際的研究の進展が強く期待される。
3. 集団グライコミクスを通じた健康指標の確立
血液型の違いに代表されるように、健常者においても糖鎖の発現には個体差が存在することは、古くから広く知られている。また、数千検体規模の免疫グロブリンIgGにおけるN型糖鎖の解析により、大規模集団における性差や年齢差の存在が報告されている17。このような発現様式および発現量の違いは、IgGに限らず糖鎖全般にも存在すると十分に予測されるが、これまで同様の規模での網羅的解析は行われていない。HGAでは、東北メディカル・メガバンクなど国内のバイオバンクと連携し、数千人規模の健常者血液検体を用いた大規模なグライコーム解析が計画されている。これにより、性別や年齢に応じた糖鎖プロファイルの特徴を明らかにし、健康状態を糖鎖情報に基づいて捉えることが可能となる。さらに、こうした健常者の糖鎖プロファイルを基準(スタンダード)とすることで、さまざまな応用研究の展開が期待される。たとえば、疾患発症前の段階で得られた糖鎖プロファイルと臨床情報を比較し、健常者からの乖離を評価することにより、糖鎖に基づく疾患リスクの予測が可能となる。これにより、疾患リスクに応じた個別化医療への応用が期待される。
4. 集団グライコミクスが可能にする疾患と糖鎖の因果関係の類推
HGAにおける大規模集団を対象としたグライコーム解析により、日本人における糖鎖プロファイルの全体像が解明され、疾患情報との関連性をもとに、疾患のバイオマーカーやリスク予測指標としての活用が期待される。しかしながら、糖鎖が疾患のメカニズムにどのように関与しているかを解明するためには、糖鎖情報のみでは不充分で、疾患の分子基盤となるゲノム情報との統合的解析が不可欠である。これまでに、数多くの疾患や形質に対してゲノムワイド関連解析(GWAS)が実施され、疾患関連SNP(single nucleotide polymorphism)が多数同定されてきた18。一方、免疫グロブリンなど特定のタンパク質上の糖鎖に対するGWASが報告されているものの19、これまで包括的なグライコームGWAS解析は行われていない。HGAでは、国立長寿医療研究センターや東北メディカル・メガバンクなどの国内バイオバンクが整備するゲノム情報を活用し、集団グライコームデータを用いた糖鎖GWASの推進を目指している。さらに、疾患および糖鎖に共通して関連するSNPを操作変数として用いる疫学的手法(メンデルランダム化解析)20を応用することで、糖鎖と疾患との因果関係にアプローチすることが可能になると期待される。
5. おわりに
本稿では、HGAが目指す大規模研究の中核であるコホート研究により確立される集団グライコミクスの概要と、将来的な研究展開への期待について概説した。日本人大規模集団におけるグライコームのプロファイルは、TOHSAと呼ばれる糖鎖データベースに集積され、研究コミュニティに広く共有される予定である10。そして、共同研究プラットフォームとして、さまざまな研究分野への波及効果をもたらすことが期待される(図 1)。さらに、国内のバイオバンクとの連携を通じて、糖鎖情報と他のオミクスデータ(ゲノム、プロテオーム、メタボローム等)との統合解析が可能となり、より高精度で信頼できる疾患バイオマーカーや健康指標の確立に貢献することが期待される。
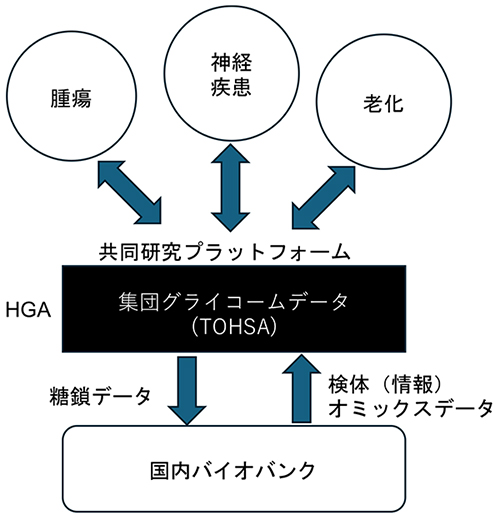 図 1. ヒューマングライコームプロジェクトにおけるコホート研究
図 1. ヒューマングライコームプロジェクトにおけるコホート研究
References
- Prohaska A, Racimo F, Schork AJ, Sikora M, Stern AJ, Ilardo M, Allentoft ME, Folkersen L, Buil A, Moreno-Mayar JV. Human disease variation in the light of population genomics. Cell. 2019;177(1):115-31.
- Ishigaki K, Akiyama M, Kanai M, Takahashi A, Kawakami E, Sugishita H, Sakaue S, Matoba N, Low S-K, Okada Y. Large-scale genome-wide association study in a Japanese population identifies novel susceptibility loci across different diseases. Nature genetics. 2020;52(7):669-79.
- Sakaue S, Kanai M, Tanigawa Y, Karjalainen J, Kurki M, Koshiba S, Narita A, Konuma T, Yamamoto K, Akiyama M. A cross-population atlas of genetic associations for 220 human phenotypes. Nature genetics. 2021;53(10):1415-24.
- Sun BB, Suhre K, Gibson BW. Promises and challenges of populational proteomics in health and disease. Molecular & Cellular Proteomics. 2024;23(7).
- Cai X, Xue Z, Zeng F-F, Tang J, Yue L, Wang B, Ge W, Xie Y, Miao Z, Gou W. Population serum proteomics uncovers a prognostic protein classifier for metabolic syndrome. Cell Reports Medicine. 2023;4(9).
- Hanamatsu H, Furukawa J-i. Total glycome analysis: glycosphingolipid-glycomics. Glycoforum. 2025;28:A1.
- Kurogochi M, Furukawa J-i. Total glycome analysis: O-glycomics in human plasma/serum. Glycoforum. 2024;27:A22.
- Hanzawa K, Nakajima K. HGA Segment 2: Automation of sample preparation in rapid glycoproteomics. Glycoforum. 2024;27:A16.
- Hanamatsu H, Kurogochi M, Furukawa J-i. Total glycome analysis-N-glycomics. Glycoforum. 2024;27:A9.
- Aoki-Kinoshita KF, Akune-Taylor Y, Ando H, Angata K, Fujita M, Furukawa J-i, Kaji H, Kato K, Kitajima K, Kizuka Y. The Human Glycome Atlas project for cataloging all glycan-related omics data in human. Glycobiology. 2024;34(11):cwae052.
- Kadomatsu K. Human Glycome atlas project: the future that opens up. Glycoforum. 2024;27:A1.
- Reily C, Stewart TJ, Renfrow MB, Novak J. Glycosylation in health and disease. Nature Reviews Nephrology. 2019;15(6):346-66.
- Zhou JY, Cobb BA. Glycans in immunologic health and disease. Annual review of immunology. 2021;39(1):511-36.
- Malhotra R, Wormald MR, Rudd PM, Fischer PB, Dwek RA, Sim RB. Glycosylation changes of IgG associated with rheumatooid arthritis can activate complement via the mannose-binding protein. Nature medicine. 1995;1(3):237-43.
- Gudelj I, Lauc G, Pezer M. Immunoglobulin G glycosylation in aging and diseases. Cellular Immunology. 2018;333:65-79.
- Dong Y, Song X, Wang X, Wang S, He Z. The early diagnosis of Alzheimer's disease: Blood‐based panel biomarker discovery by proteomics and metabolomics. CNS Neuroscience & Therapeutics. 2024;30(11):e70060.
- Štambuk J, Nakić N, Vučković F, Pučić-Baković M, Razdorov G, Trbojević-Akmačić I, Novokmet M, Keser T, Vilaj M, Štambuk T. Global variability of the human IgG glycome. Aging (Albany NY). 2020;12(15):15222.
- Wellcome Trust Case Control Consortium. Genome-wide association study of 14,000 cases of seven common diseases and 3,000 shared controls. Nature.
2007;447(7145):661-78.
- Lauc G, Huffman JE, Pučić M, Zgaga L, Adamczyk B, Mužinić A, Novokmet M, Polašek O, Gornik O, Krištić J. Loci associated with N-glycosylation of human immunoglobulin G show pleiotropy with autoimmune diseases and haematological cancers. PLoS genetics. 2013;9(1):e1003225.
- Boehm FJ, Zhou X. Statistical methods for Mendelian randomization in genome-wide association studies: a review. Computational and structural biotechnology journal. 2022;20:2338-51.

