
氏名:林 幸壱朗
九州大学大学院歯学研究院 准教授
2005年 名古屋大学工学部卒業。2007年 名古屋大学大学院工学研究科博士前期課程修了。2010年 同大学院博士後期課程修了、博士(工学)取得。同年、徳島大学大学院医学研究科助教に就任。2014年 名古屋大学未来材料・システム研究所助教を経て、2017年より九州大学大学院歯学研究院に所属し、現在に至る。専門は生体材料学、硬・軟組織再生、ナノ医療。
軟骨は自然再生しない組織であり、変形性膝関節症などの患者数は増加の一途をたどっている。現行の治療法には限界があり、新たな再生技術の開発が急務である。筆者は、木材の骨格構造を保持しつつ、セルロース間の水素結合を制御することで、関節軟骨と同等の剛性および含水率を持つ木材由来スポンジハイドロゲルを開発した。さらに、本スポンジハイドロゲルは軟骨を超える圧縮強さと形状復元特性(クッション性)を有する。本スポンジハイドロゲルは、in vitro試験において、細胞毒性を示さず、ヒト間葉系幹細胞の軟骨分化を促進した。また、in vivo試験において、ウサギ大腿骨の軟骨欠損部への移植後4週で軟骨細胞外マトリックスが形成され、12週で欠損部全体が硝子軟骨で修復された。本スポンジハイドロゲルは、現行治療法の課題を克服するとともに、森林資源を活用した持続可能な軟骨再生材料として期待できる。
軟骨は自然には再生しない組織であり、軟骨損傷患者数は極めて多い。特に、加齢とともに膝軟骨が擦り減ることにより生じる「変形性膝関節症」の患者数は、国内だけで2530万人、世界で5億2800万人にも上る。国内統計データでは、関節症の有訴者(自覚症状がある者)のうち、病院で治療を受けている人は30%未満であり、安静にする・我慢する人が35%を超えていることから、潜在患者数は3000万人を超えると推定される。さらに、世界的に高齢化が進行しており、2035年にはアメリカと中国を含む主要9カ国において、高齢者人口の割合が20%を超えるため、今後、患者数はさらに増加すると見込まれる。また、変形性膝関節症は要支援・要介護に認定される特定疾病であり、関節疾患は最大の要支援原因である。すなわち、患者のQOL向上および医療費・介護費削減の観点から、軟骨を再生・保護する材料や技術の開発は喫緊の課題である。現在の変形性膝関節症の治療は、「人工膝関節置換術」、「高位脛骨骨切り術」、「骨髄刺激法」、「骨軟骨柱移植術」であるが、それぞれ問題がある。「人工膝関節置換術」を行うと膝の可動域が狭くなり、生活に制限が生じる。「高位脛骨骨切り術」は重度症状には適用できず、軟骨を再生する根本治療ではない。「骨髄刺激法」では正常な関節軟骨である硝子軟骨は再生せず、欠損部は機能面で劣る線維軟骨に置き換わる。「骨軟骨柱移植術」は、自己の正常な関節軟骨が犠牲になる。「自家培養軟骨移植術」は外傷性軟骨欠損や離断性骨軟骨炎では適用可能だが、変形性膝関節症には適応できない。また、細胞を用いるため、コストが極めて高い。さらに、荷重部で使用することができず、力学的サポートとして働く細胞足場材料が必要不可欠である。すなわち、現在のところ、患者の正常軟骨を犠牲にすることなく、関節軟骨(硝子軟骨)を再生し、変形性膝関節症を根本的に治療する方法は存在しない。
ハイドロゲルは、軟骨と同様に高い含水率(60~85%)を持つため、軟骨組織工学のバイオマテリアルとして広く研究されている。従来の軟骨組織工学では、ハイドロゲルの剛性を80 kPaに調整することで、間葉系幹細胞が軟骨細胞へ分化できるとされてきたが、このアプローチでは均質な組織の再生に失敗し、臨床的有効性が広く認められるには至らなかった。また、ハイドロゲルと細胞を組み合わせたアプローチも広く研究されてきたが、細胞を使用せず、ハイドロゲル単独での軟骨再生が望まれている。これは、細胞の供給源が限られていること、機能が不十分なこと、細胞培養のコストが高いこと、微生物や病原体汚染、奇形腫の形成、自然発生的な幹細胞の突然変異、悪性腫瘍形成、免疫拒絶のリスクがあるためである。
軟骨と同等の特性を持つハイドロゲルを合成するバイオミメティクス(生体模倣)のアプローチは、ハイドロゲル単独で軟骨再生を達成するための効果的な手段となりうる。関節軟骨の剛性が200~900 kPaであることから、このアプローチで使用されるハイドロゲルの剛性は、従来の80 kPaのハイドロゲルの2.5~11倍にする必要がある。また、ハイドロゲルの化学組成や含水率も実際の軟骨と類似しているべきである。さらに、ハイドロゲルは通常、機械的強度が低いが、関節軟骨再生のためには荷重に耐えられる十分に高い機械的強度を持つ必要がある。
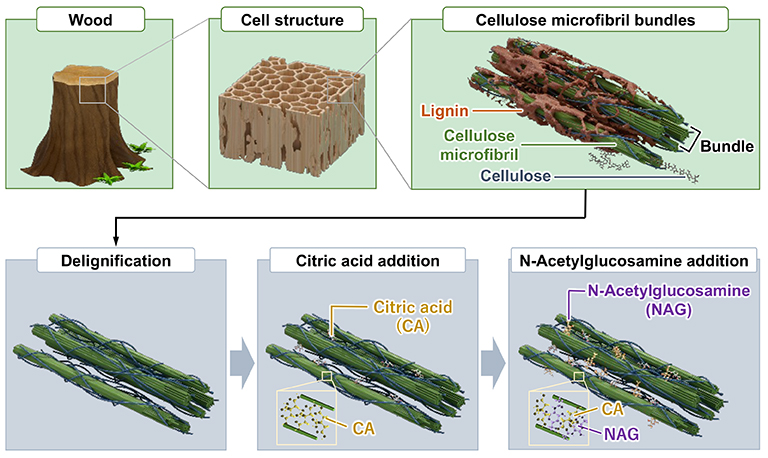
木材は、高い荷重支持能力を持つ骨格構造を有し、木材の気孔構造は細胞浸透に役立つ可能性がある。しかし、木材の剛性は軟骨より大幅に高く、その化学組成も異なるため、木材自体を軟骨再生材料として使用するのは適切ではない。しかし、木材の骨格を構成するセルロースを保持し、その他の成分を除去して軟骨成分と置換することで、軟骨成分を含むハイドロゲルを得ることができると考えられる。また、セルロースの硬い構造は強い水素結合によるものであるが、この水素結合を弱める分子の添加により、軟骨と同等の剛性を持ち、柔軟な構造を作り出すことが可能である。
木材は、物理的および化学的な方法で加工され、エネルギー貯蔵、水処理、イオン輸送、熱管理など、さまざまな用途に利用されてきた。しかし、軟骨再生に応用する場合、従来の物理的および化学的プロセス(管腔充填法や炭化法など)は、木材の骨格構造を保持しつつ軟骨と同等の化学組成と剛性を持つ材料を生成することができないため、不適切である。
さらに、森林は地球の熱・水収支や自然資源と密接に関連し、地球環境や生物多様性の保全、水源涵養、木材供給など、多面的な価値を持つ。このため、森林資源のリサイクルは世界的な目標となっている。森林間伐材や廃木材を利用して軟骨再生機能を持つハイドロゲルを合成することは、健康問題と環境問題双方の解決策を提供する可能性がある。しかし、木材を組織工学に利用する研究は、現在までのところ存在しない。
筆者は、木材の骨格構造を保持しつつ、セルロースを結合するリグニンを除去し、その後、セルロース間の水素結合を制御する分子を挿入することで、関節軟骨と同等の剛性、強度、および含水率を持つ軟骨成分を含むハイドロゲルの合成法を確立した。さらに、このハイドロゲルの軟骨再生機能を明らかにした1。本稿では、この木材由来ハイドロゲルの物理化学的・機械的特性および軟骨再生能について述べる。
木材由来スポンジハイドロゲルは次の手順で合成される(図 1)。(1)木材中のリグニン除去、(2)セルロースミクロフィブリル間およびセルロースミクロフィブリル束間へのクエン酸(CA)挿入(クエン酸は、多くの水素結合部位を持つ小分子であり、エネルギー生産に必須)、(3)セルロースミクロフィブリル間およびセルロースミクロフィブリル束間へのN-アセチルグルコサミン(NAG)挿入(NAGは軟骨グリコサミノグリカンの前駆体であり、グリコサミノグリカンの合成を促進し、その分解を抑制)。以降、CA挿入型木材スポンジハイドロゲルをCA-woodハイドロゲル、CAおよびNAG挿入型木材スポンジハイドロゲルをCA-NAG-woodハイドロゲルと表記する。
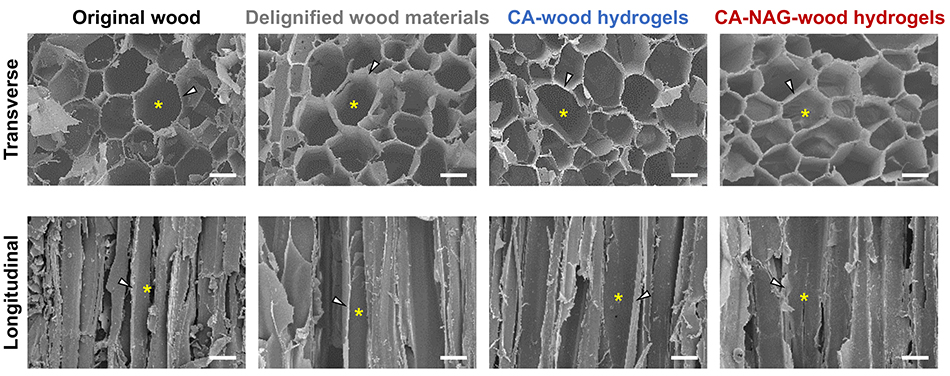
木材由来スポンジハイドロゲルの合成工程で木材のマクロ構造が崩壊することなく、CA-NAG-woodハイドロゲルは元々の木材のマクロ構造を維持する(図 2)。木材細胞壁に囲まれたルーメン由来の40~80 μmのマクロポアはスポンジハイドロゲル内への細胞の侵入を可能にし、木材細胞壁に由来するストラットはスポンジハイドロゲルに高い強度をもたらす。
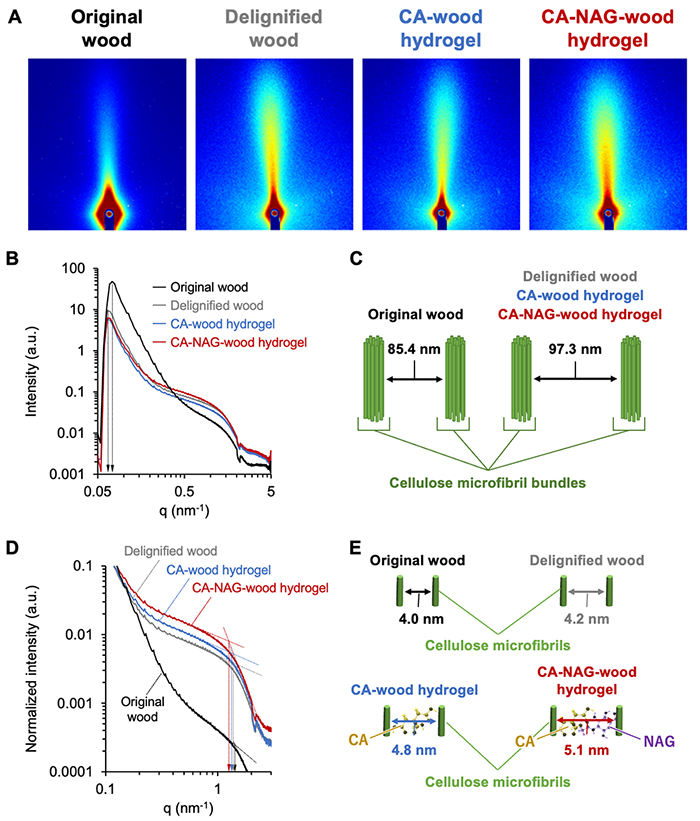
木材由来スポンジハイドロゲルの結晶構造も広角X線散乱(WAXS)により評価しており、CA-NAG-woodハイドロゲルは元の木材のセルロース結晶構造を保持していることを明らかにしている。さらに、各工程を経るにつれ、非晶質部分が増加し、これにより、スポンジハイドロゲルに柔軟性と弾力性が発現することが明らかになっている。
さらに、木材由来スポンジハイドロゲルの小角X線散乱(SAXS)解析も行っており、各工程を経るにつれて、セルロースミクロフィブリル間の距離が拡大することが分かっている(図 3)。この拡大距離は、CAとNAG分子サイズと一致しており、これらの分子がセルロースミクロフィブリル間にインターカレーションされたことが明らかになっている。
木材由来スポンジハイドロゲルは合成の各工程で物理的・機械的特性が大きく変化する。例えば、脱リグニン化した木材はねじりに弱く、容易に裂けるが、CA-woodおよびCA-NAG-woodハイドロゲルは柔軟性があり、裂けることなくねじることができる(図 4A)。また、脱リグニン化した木材は曲げに弱く、容易に折損し、CA-woodハイドロゲルは曲げることはできるが、裂けが生じる(図 4B)。一方で、CA-NAG-woodハイドロゲルは柔軟で、折損や裂けが生じることなく曲げることができる。その他、含水率、圧縮弾性率、圧縮強さ、摩擦係数も合成の各工程を経ることで大きく変化し、最終的に得られる木材由来スポンジハイドロゲル(CA-NAG-woodハイドロゲル)は上記特性が軟骨と同等になる。さらに、CA-NAG-woodハイドロゲルはクッション性を有しており、90%圧縮しても破損することなく、元の形状に復元する。

CA-NAG-woodハイドロゲルのヒト間葉系幹細胞(hMSCs)に対する細胞毒性は認められていない。さらに、CA-NAG-woodハイドロゲル上でhMSCsを2週間培養すると、材料全体がアルシアンブルー(AB)で染色されることから、この材料は軟骨分化を誘導することが示されている。一方、骨軟骨欠損の修復のための代表的な足場材料であるコラーゲンスポンジではこのような効果は観察されていない。
軟骨再生能力を評価するために、コラーゲンスポンジ、脱リグニン化木材、CA-woodハイドロゲル、およびCA-NAG-woodハイドロゲルをウサギ大腿骨軟骨下骨欠損部に埋植し、肉眼解剖および病理組織解析を行っている。また、材料を埋植しないempty群(陰性対照)との比較も行っている。本稿では、肉眼解剖および病理組織画像については、empty群、コラーゲン群、CA-NAG-woodハイドロゲル群の主結果のみを提示する。また、埋植時の各材料の使用感は実際に応用する上で重要なポイントであるが、コラーゲンスポンジは脆く、崩壊したが、CA-NAG-woodハイドロゲルは崩壊することなく、容易に埋植することができることを付記しておく。
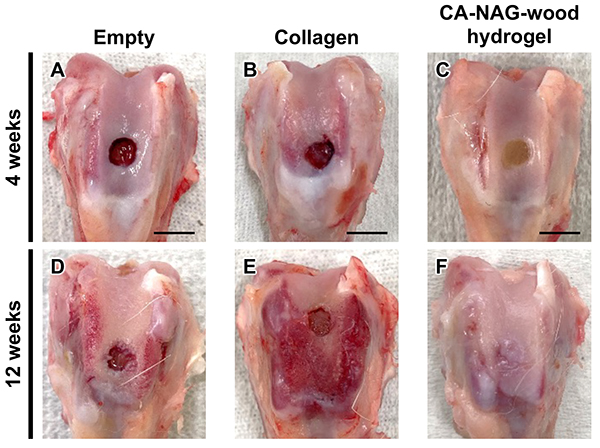
術後4週では、empty群およびコラーゲン群の軟骨下骨欠損部には組織が形成されないが(図 5A、B)、CA-NAG-woodハイドロゲル群では、組織形成が観察される(図 5C)。術後12週では、empty群、コラーゲン群では、欠損部が視認されるが(図 5D、E)、CA-NAG-woodハイドロゲル群では欠損境界が不明瞭となり、大部分の欠損が周囲の組織と類似した組織で修復されている(図 5F)。一般的なグレーディングスケールに基づいて行われた肉眼的形態評価において、CA-NAG-woodハイドロゲル群の総合スコアは、術後 4週および12週のいずれにおいても、他群より有意に高いことが確認されている(p < 0.01)
図 5にニートPEおよびTOCN/PE複合材シート(厚み約80μm)の光学顕微鏡像を示した。TOCNのみの複合材は数10μmサイズの凝集塊が多数観察され、TOCNとx(DTMACl)を含有する複合材は数100μmの凝集塊、TOCNとy(DEG)を含有する複合材の形状は異なるが大きな凝集塊が多数確認された。一方、CWSolid法で作製したD-3、E-3の複合材はニートPEと同様に、凝集塊は見られず、TOCNは解繊されたと考えられる。このように、解繊・分散のためにはxとyの両方が必要なことが分かる。
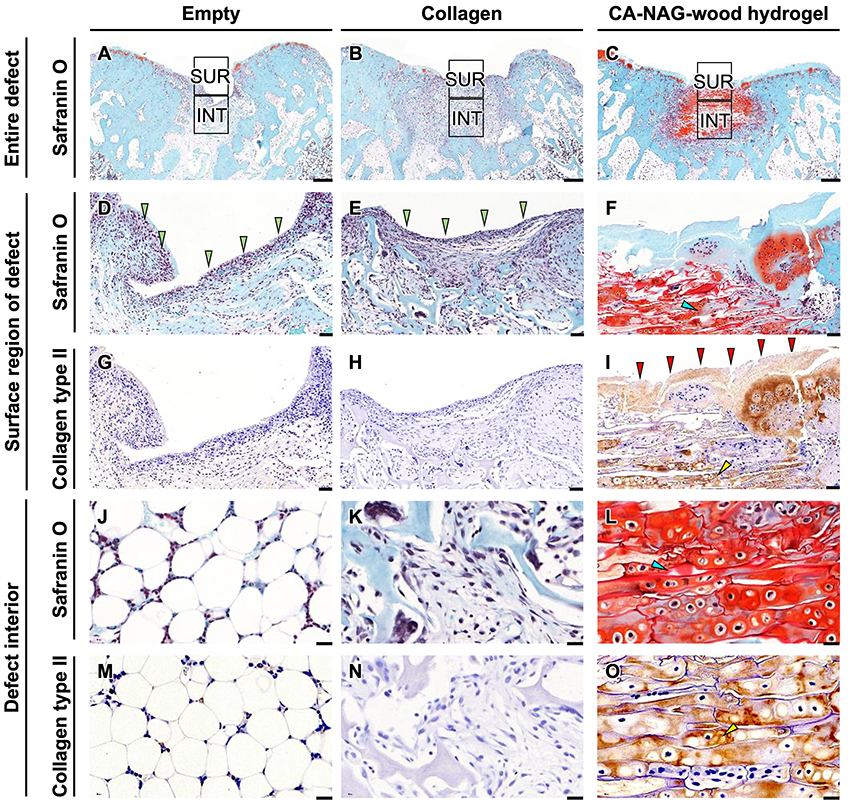
紙面の都合上、図の提示は割愛するが、術後4週の欠損表層領域におけるサフラニンO(SO)染色組織切片では、empty群およびコラーゲン群では線維性組織が形成されていたが、CA-NAG-woodハイドロゲル群では、領域全体に均一で厚い細胞外マトリックス(ECM)が形成されていた。さらに、欠損表層領域における軟骨組織の主要成分であるII型コラーゲン(COL2)の免疫染色では、empty群およびコラーゲン群ではCOL2陽性組織が観察されなかった。一方、CA-NAG-woodハイドロゲル群では、欠損表層領域に形成されたECMがCOL2に対して免疫染色され、軟骨組織に類似していた。軟骨下骨欠損の内部では、empty群およびコラーゲン群では、SO染色で赤色を呈する軟骨細胞は観察されないが、CA-NAG-woodハイドロゲル群では、部分的ではあるが、赤色を呈する細胞が視認された。また、empty群およびコラーゲン群ではCOL2陽性細胞は観察されないが、CA-NAG-woodハイドロゲル群では、SO染色で赤色を呈する細胞がCOL2にも陽性を示しており、軟骨細胞の形成が確認された。
術後12週では、empty群およびコラーゲン群の軟骨下骨欠損部では、SO陽性組織が観察されないが(図 6A、B)、CA-NAG-woodハイドロゲル群では欠損部全体にわたってSO陽性組織が形成される(図 6C)。欠損部表層領域に形成された組織は、empty群(図 6D)およびコラーゲン群(図 6E)では線維性組織であるが、CA-NAG-woodハイドロゲル群ではSO陽性ECMである(図 6F)。欠損部表層領域に形成された線維性組織は、empty群およびコラーゲン群ではCOL2免疫染色で染色されないが(図 6G、H)、CA-NAG-woodハイドロゲル群では、SO陽性ECM全体がCOL2免疫染色で染色される(図 6I)。欠損部の内部では、empty群では脂肪組織が(図 6J)、コラーゲン群では線維性組織が存在する(図 6K)。CA-NAG-woodハイドロゲル群では、SO陽性細胞がマクロ気孔を満たし、ハイドロゲル全体にわたって存在する(図 6L)。さらに、empty群およびコラーゲン群では、COL2免疫染色で染色される細胞は観察されないが(図 6M、N)、CA-NAG-woodハイドロゲル群では、SO陽性細胞がCOL2に対しても陽性を示すことが確認される(図6O)。
術後4週における免疫組織化学(IHC)画像を用いた欠損部の軟骨割合の分析では、CA-NAG-woodハイドロゲル群(5.2 ± 1.8%)の値が、empty群(0.0 ± 0.0%、p < 0.0001)、コラーゲン群(0.0 ± 0.0%、p < 0.0001)、脱リグニン化木材群(1.0 ± 0.4%、p < 0.0001)、およびCA-woodハイドロゲル群(1.1 ± 0.3%、p < 0.0001)と比較して有意に高いことを確認している。術後12週では、CA-NAG-woodハイドロゲル群の軟骨割合(41.0 ± 8.8%)が、empty群(0.0 ± 0.0%、p < 0.0001)、コラーゲン群(0.1 ± 0.1%、p < 0.0001)、脱リグニン化木材群(0.4 ± 0.4%、p < 0.0001)、およびCA-woodハイドロゲル群(4.0 ± 3.6%、p < 0.0001)よりも有意に高いことを確認している。SOスコアリング評価は、CA-NAG-woodハイドロゲル群のSOスコアは、術後4週および12週のいずれにおいても他の群と比較して有意に高いことを明らかにしている(p < 0.01)。
木材のセルロースマイクロフィブリル間にCAおよびNAGを挿入することで、実際の関節軟骨と同程度の剛性と強度を持つ柔軟なハイドロゲルが得られる。CA-NAG-woodハイドロゲルは形状回復特性を示し、90%圧縮後でも元の形状に戻り、実際の軟骨に類似したクッション性を有する。CA-NAG-woodハイドロゲルをウサギの軟骨下骨欠損部に埋植すると、術後4週で欠損部表面に軟骨ECMが形成され、欠損部内部に軟骨細胞が出現する。術後12週では、欠損部全体に軟骨細胞が分布し、肉眼的にも欠損部が修復される。これらの結果は、コラーゲンスポンジでは達成されない。これらの良好な結果は、CA-NAG-woodハイドロゲルの木材骨格構造が維持されていることと、その物理化学的および機械的特性が軟骨と同等であることに起因すると考えられる。