
氏名:花松 久寿
東海国立大学機構 名古屋大学 糖鎖生命コア研究所 特任講師
2014年北海道大学大学院生命科学院 生命科学博士取得、同年から北海道大学生体機能化学研究室 博士研究員、2017年 北海道大学医学研究院・消化器内科学教室・先端的糖鎖臨床生物学分野 博士研究員、2019年 特任助教。2023年より現職。研究テーマは、シアル酸結合様式特異的修飾法の開発および総合グライコーム解析。

氏名:黒河内 政樹
東海国立大学機構 名古屋大学 糖鎖生命コア研究所 研究員
1998年北海道大学理学部卒業、2004年博士(理学)取得。2004年北海道科学技術総合振興センター主任研究員、 2005年北海道大学 博士研究員を経て、2006年北海道大学大学院先端生命科学院 特任助教。 2012年(公財)野口研究所に入所、糖鎖生物学研究室 研究員、糖タンパク質工学研究室 室長、糖鎖有機化学研究室 研究員に従事。 2024年より現職。研究テーマは有機化学、分析化学、糖鎖工学、グイコミクス、グライコプロテオミクス。

氏名:古川 潤一
東海国立大学機構 名古屋大学 糖鎖生命コア研究所(iGCORE))特任教授
北海道大学 整形外科学教室 客員教授
1996年北海道大学理学部卒業、2001年博士(地球環境科学)取得。2001年日本学術振興会特別研究員(北海道大学 理学部)、博士研究員を経て、2007年より理学部 特任助教。2016年より医学研究院 先端的糖鎖臨床生物学分野 特任准教授。2022年より現職。研究テーマは生物有機化学、糖鎖分析化学。独自の開発した分析ツールを用いた包括的な糖鎖分析について研究を進めている。
糖鎖 (グライカン) は、核酸(ジーン) やタンパク質(プロテイン)に続く第3の生命鎖と呼ばれている。多種多様な糖鎖(サブグライカン)は、タンパク質や脂質と結合して複合糖質を形成し、細胞表面を覆い生物学的な現象において重要な役割を果たしている。その糖鎖の機能を知る上で、糖鎖の構造解析は必要不可欠である。例えば、プロテオームは生物やシステムによって産生されたり修飾されたりするタンパク質の全体セットであり、プロテオミクスという用語はプロテオーム全体の大規模な研究を意味する。同様にグライコームは個々の生体が有する糖の総体を現し、グライコミクスはその全容解析である。糖鎖の多くは、糖タンパク質、スフィンゴ糖脂質、プロテオグリカン、GPIアンカーなどの複合糖質として存在している。それらの糖鎖の機能を解明するには、複合糖質の様々なクラスの糖鎖発現を測定する必要がある。しかしながら、一般的にはトランスジェニックマウスやノックアウトマウスを標的とした糖転移酵素に関連した糖鎖の解析に限られている。実際に異なるクラス間における糖鎖の関連解析などはほとんどなされていない。様々な糖転移酵素を標的としたトランスジェニックマウスやノックアウトマウスを解析しても明確な表現型の違いが認められないこともしばしば報告された1。これらの結果は、糖鎖の機能を解明するには包括的な複合糖質の糖鎖解析も必要であることを示唆している。
以前に私たちはN型糖鎖、O型糖鎖、グリコサミノグリカン(GAG)、スフィンゴ糖脂質糖鎖(GSL糖鎖)そして遊離オリゴ糖(fOS)を質量分析計やHPLCで解析するための調製および分析の一連の方法論を報告してきた2,3,4,5。これらの異なるクラスの複合糖質糖鎖の解析法を統合し、細胞や血清中に存在するサブグライカンの全体像を俯瞰できるようになった(総合グライコミクス)6,7。現在も糖鎖解析のための新しい技術開発や改良を続けており、シアリル化糖鎖異性体を質量分析法で識別する技術、シアル酸結合様特異的アルキル化法(SALSA)を構築してきた8。
ヒューマングライコームプロジェクト(HGA)のセグメント2では、大規模な糖鎖カタログ(ヒト血漿総合グライコーム)を作成して、TOHSAと呼ばれる大規模データベースの構築することが最も重要なミッションの一つである。本セクションでは、2) シアル化糖鎖異性体を識別するためにシアル酸結合様式特異的誘導体化とグライコブロッティング法を組み合わせた改良したN型糖鎖分析法、そして3) 大規模コホート解析を目的としたヒト血漿/血清中に含まれるN型糖鎖の全自動前処理装置の開発など、最近の私たちの研究ついて紹介する。
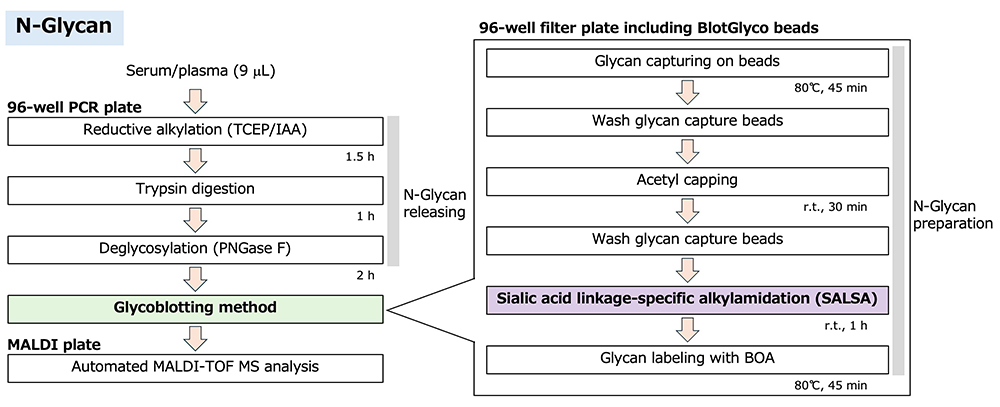
N 型糖鎖付加はタンパク質の翻訳後修飾の一つであり、N型糖鎖はアスパラギン(Asn)残基の側鎖に結合している。N型糖鎖は、特徴的な構造に応じてパウチマンノース型、オリゴマンノース型、ハイブリッド型そして複合型の4つのタイプに大きく分類される。ヒト血清中では、分泌蛋白質の50%以上が糖鎖修飾を受けていると言われている。N結合型糖鎖は、よく使われている酵素、ペプチド-N-グリコシダーゼF(PNGase F)によってタンパク質から容易に切り出すことできる。さらに糖タンパク質の還元、アルキル化そしてトリプシン消化によってPNGase FによるN結合型糖鎖の切断効率を高めることができる9。このように調製された試料には,アルキル化試薬やトリプシン消化ペプチドなどの多くの夾雑物を含むため,糖鎖を解析するには糖鎖の精製工程が必要になる。私たちはケミカルライゲーションを介したグライコブロッティング法によって切断した糖鎖の精製を行なっている2。切断された糖鎖は還元末端にヘミアセタール(アルデヒド)基を持っており、このような官能基を有する化合物は血清中にはほとんど存在しない。つまりグライコブロッティング法により糖鎖を選択的に捕捉・精製することが可能になる。
N結合型糖鎖のほとんどは非還元末端にシアル酸が結合しており、そのαグリコシド結合は不安定でありMALDI-TOF MS測定によるシアリル化糖鎖の定量は困難である10。グライコブロッティング法では固相上でシアリル化の誘導化も可能である。この修飾の詳細については次の章で紹介する。最終的にN結合型糖鎖はBlotGlycoビーズより切り離され、同時に質量分析に適した標識化が行われる。質量分析法のためのN結合型糖鎖のプロトコルをFigure 1に示す。グライコブロッティング法の詳細な実験法について以前の報告を参照されたい。
シアル酸は酸性単糖の一つであり、異なるα2,3-,α2,6-, や α2,8-結合で糖鎖の非還元末端に存在し、それら結合の違いが糖鎖-タンパク質の相互作用、細胞認識やシグナル伝達に関与している11。シアル酸のα-グリコシド結合は不安定であり、結果として質量分析による測定過程で糖鎖の末端のシアル酸の脱離が起こる。それに加えて異なる結合様式を持つ構造異性体は同じ分子量を持つため質量分析による識別ができない。最近の研究では、糖鎖異性体を質量分析で区別するためにいくつかのユニークなシアル酸の結合様式特異的な誘導化が報告されている。私たちも結合様式特異的な誘導化法を開発してきた。その概略図をFigure 2に示す。
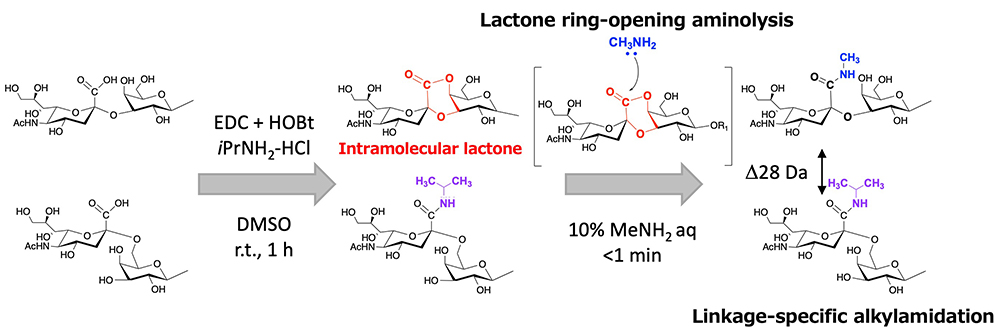
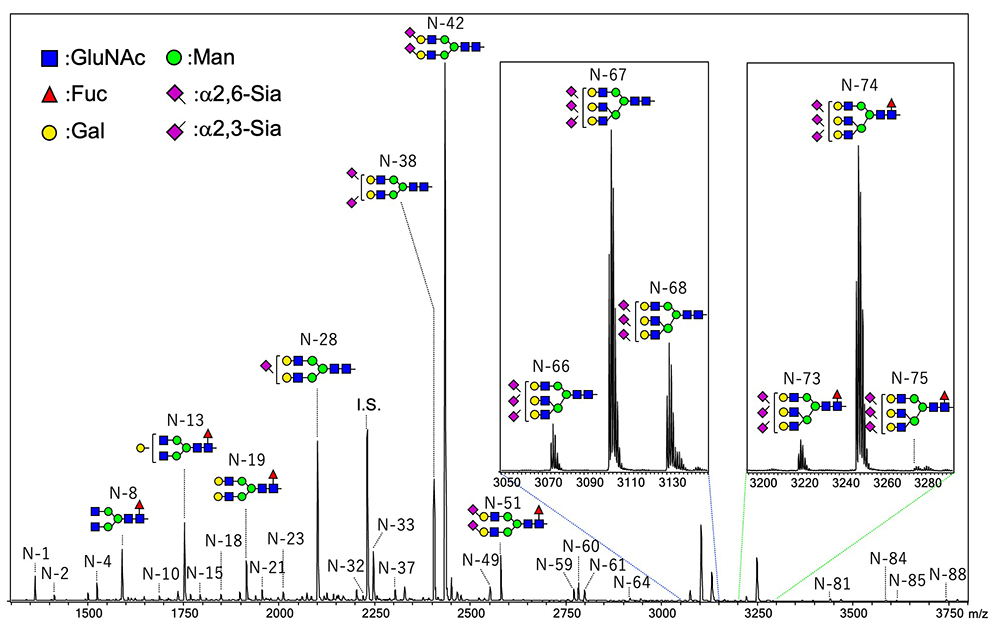
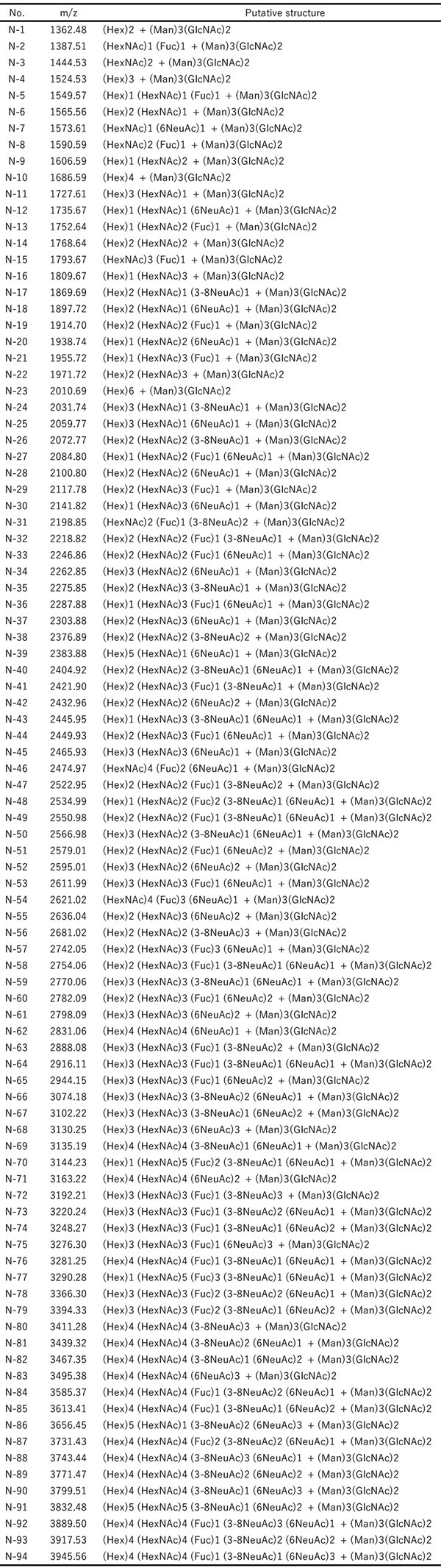
私たちの方法ではグライコブロッティング法によりシアル酸を含むN結合型糖鎖を固相上に捕捉する。固相上で最初の縮合反応を行うことができ、α2,6結合のシアル酸のカルボキシル基はイソプロピルアミドへ、それに対してα2,3とα2,8結合のシアル酸からは分子内ラクトンが形成される。私たちはこの分子内ラクトンを経由したα2,3とα2,8結合のシアル酸の結合様式特異的アミド化を開発した。この反応は非常に簡単で糖鎖が捕捉された固相担体を含む96 wellフィルタープレートにアミン溶液を単に加えるだけである。その結果ラクトン環が開裂するのと同時にアミド化(アミノリシス)が引き起こされる。これによりSALSA法の反応時間は2時間から1時間へと短縮できた。血清/血漿中のN結合型糖鎖のMALDI-TOF MSスペクトルをFigure 3に示す。SALSA法によって3本鎖3シアリル化のN結合型糖鎖、A3は構造異性体の三つのシグナルとして検出すことができた(A33,3,6 m/z 3074.19, A33,6,6 m/z 3102.24, and A36,6,6 m/z 3230.27)。興味深いことに、A3のフコシル化糖鎖の二つのシグナル(A3F3,3,6, A3F3,6,6)は同じような比率で検出されたが、すべてα2,6結合のシアル酸を持つA3F6,6,6はA36,6,6と比較してほとんど検出されなかった。

上述したようにヒト血清/結晶中のN結合型糖鎖を解析する準備は整った。次に、私たちは大規模コホート解析を行うために糖鎖自動前処理装置の開発を進めている。N結合型糖鎖の全自動調製装置をFigure 4に示す。96 wellプレートでN結合型糖鎖を調製できるように8連のシリンジを採用している。恒温槽は室温から100 °Cまで制御することができ、変性した血清/血漿タンパク質は96 wellのPCRプレート中でトリプシンやPNGase Fによって37 °Cで酵素消化される。遊離したN結合型糖鎖の捕捉や標識も恒温槽の中でBlotGlycoビーズを含む96 wellフィルタープレートの上で行われる。激しい撹拌が必要なSALSA反応は96 wellプレートシェーカーで行うことができる。最終的に、精製そして誘導化された血清/血漿中のN結合型糖鎖が調製されMALDIプレートへ点着される。この装置を使うことで96検体の血清/血漿からN結合型糖鎖を調製する全ての工程を16時間以内に完了できる。上述したようにヒト血清/結晶中のN結合型糖鎖を解析する準備は整った。次に、私たちは大規模コホート解析を行うために糖鎖自動前処理装置の開発を進めている。N結合型糖鎖の全自動調製装置をFigure 4に示す。96 wellプレートでN結合型糖鎖を調製できるように8連のシリンジを採用している。恒温槽は室温から100 °Cまで制御することができ、変性した血清/血漿タンパク質は96 wellのPCRプレート中でトリプシンやPNGase Fによって37 °Cで酵素消化される。遊離したN結合型糖鎖の捕捉や標識も恒温槽の中でBlotGlycoビーズを含む96 wellフィルタープレートの上で行われる。激しい撹拌が必要なSALSA反応は96 wellプレートシェーカーで行うことができる。最終的に、精製そして誘導化された血清/血漿中のN結合型糖鎖が調製されMALDIプレートへ点着される。この装置を使うことで96検体の血清/血漿からN結合型糖鎖を調製する全ての工程を16時間以内に完了できる。

N結合型糖鎖については、大規模コホート研究へ向けた血清/血漿中のN結合型糖鎖を測定する準備ができ、一日に最大96検体の自動測定が可能になった。得られた膨大なスペクトルを解析するための解析ツールの開発は重要な課題の一つであり進行中である。総合グライコミクスを達成するには他のサブグライコームに対応した装置の開発も必要である。次の別のクラスの糖鎖の解析については次の機会に紹介できればと考えている。