
氏名:佐川 拓矢
東京理科大学工学部工業化学科助教
2018年3月東京理科大学理工学部(現・創域理工学部)先端化学科 博士課程修了 博士(工学)取得、2018年4月北海道大学触媒科学研究所 博士研究員、2020年4月より現職。多糖複合材料の作製と評価およびキチン由来糖アルコールの触媒的変換に従事。

氏名:橋詰 峰雄
東京理科大学工学部工業化学科教授
1999年3月東京工業大学大学院生命理工学研究科博士課程修了 博士(工学)取得、テキサス大学オースチン校博士研究員、理化学研究所フロンティア研究員、奈良先端化学技術大学院大学助手、助教を経て2008年4月東京理科大学工学部第一部講師に着任。同准教授を経て2017年4月より現職。多糖の機能材料化、有機−無機ハイブリッド材料の開発に関する研究に従事。
キトサンは多くの天然賦存量を有するキチンから得られる多糖であり、高い生体適合性、生分解性を有するため、バイオマテリアルとしてよく利用されている。キトサンは酸性水溶液中ではポリカチオンとしてふるまう。本稿では、キトサンを構造材料として利用する一つのアプローチとして、キトサンとアニオン性多糖との混合により形成したポリイオンコンプレックスを成形することで得られる多糖複合フィルムについて概説する。多糖複合フィルムは物質担持能や吸湿性、保湿性を機能的特徴としてもつことから、薬物徐放担体や創傷被覆材などバイオマテリアルとして有用と期待される。
キトサン(CHI)はある種の菌類中にも存在するが、一般には海洋中で最大の賦存量を有するバイオマスであるキチンを脱アセチル化することで得られる(図 1 (A))。キチン、CHIはどちらも高い生体適合性、生分解性を有し、毒性が低いため、創傷被覆材など構造材料としてのバイオマテリアルや薬物徐放担体などに利用されている1,2。キチンは抗菌性、創傷治癒効果が報告されている水不溶性多糖である。キチンの水不溶性は3次元的な水素結合による剛直な結晶構造に由来しており3、創傷被覆材など高強度が必要なバイオマテリアルに利用されることが多い4。しかしながら成形加工性が乏しいため材料作製時の取扱いが困難である。一方、CHIは酸性水溶液に可溶なため、水不溶性の多糖と比べると取扱いや成形加工が容易である。CHIは2位にアミノ基を有するᴅ-グルコサミンから構成されており、酸性水溶液中ではこのアミノ基がプロトン化されてアンモニウムカチオンとなることで溶解性が高まる。水溶液中で多数の電荷を有する高分子をポリイオンあるいは高分子電解質と称し、多数のカチオンを有するものをポリカチオン、多数のアニオンを有するものをポリアニオンと呼ぶ。多糖のポリカチオンは天然ではCHIが唯一無二であるため、カチオン性の多糖として研究が盛んに行われている1,4,5。
CHIは溶液や分散液の状態から所望の形状に成形加工することは比較的容易であるが、成形した材料を水環境で使用する場合は膨潤によりその形状の維持が困難となり、特に酸性環境では溶解してしまう。そのためCHIをバイオマテリアル用途の構造材料として利用するような場合には、架橋剤などを使用して水不溶性とすることが多い2,6,7。しかしながら架橋剤を使用する場合、キトサンが有する抗菌性や生体適合性の喪失が懸念される。
CHIの不溶化手法の一つとして、高分子電解質複合体(ポリイオンコンプレックス、PIC)の形成が挙げられる。CHIに限らずカチオン性高分子電解質は、その反対電荷であるアニオン性の分子や無機イオンなどと相互作用する。この性質は、高分子電解質からゲル状、フィルム状、ファイバー状の構造材料を作製する際に有利に働く場合がある。PICは反対電荷を有する高分子電解質同士を混合することで形成される高分子錯体の一種で、静電相互作用により三次元架橋を形成するため水を含む各種溶媒に不溶となる。水溶液中でポリカチオンとなるCHIと複合化させることが可能なポリアニオンは種々存在するが、コンドロイチン硫酸C(CS)やヒアルロン酸(HYA)などの多糖も該当する(図 1 (A))。これら反対電荷の高分子電解質同士を混合すると、水不溶性のPICが形成する(図 1 (B))8-11。この方法の利点として、水不溶性のゲルの生成において架橋剤や糖鎖の化学修飾を必要としない点が挙げられる。つまり多糖本来の物理的・化学的性質や機能を保持したままに材料として成型加工することができるため有用である。さらに多糖からなるPICは、多糖の種類や混合比、溶液のpHを変えることで、その膨潤度や弾性率を調節することができる。
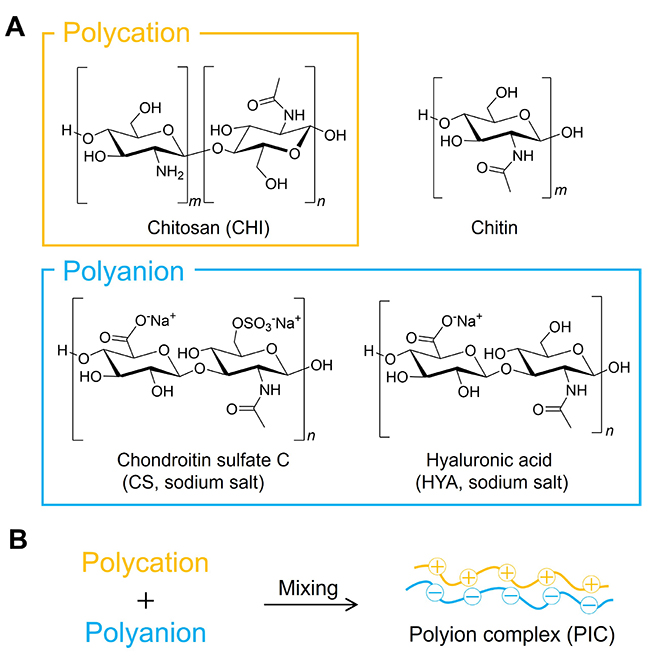
多糖を用いたフィルム材料は二次元構造材料として有用であり、二次元足場材料や創傷被覆材などバイオマテリアルに利用されている。多糖のPICからなるフィルムは通常溶液キャスト法または交互積層法(Layer-by-Layer (LbL) 法)により作製されることが多い2,12-14。溶液キャスト法の場合、均質に膜を作製することが困難である。LbL法ではCHIとアニオン性高分子との交互積層膜が得られる。フィルムの膜厚はサイクル数に応じて制御可能であるが、厚い膜の作製には多くの時間を要する。またフィルムとして扱うためには作製後に支持基板から取り外す必要がある。フィルムとしては数十ナノメートル程度の膜厚のものがよく検討されているが、その程度の膜厚のフィルムは自立性がなく取扱いが難しい。一方、我々はCHIとアニオン性多糖を混合することによって得られるPICゲルを熱プレスにより成形することで、数十µm程度の厚さのフィルム再現性よく作製する手法を確立している8,9,15,16。この手法は簡便であり、得られるフィルムは(以降多糖複合フィルムと呼ぶ)手で自在に扱えるほどの自立性を有する。
一例としてCHIとCSからなる多糖複合フィルム(CS/CHIフィルム)の作製について概説する(図 2上段)8,9。CHIの希酢酸溶液にCS水溶液を少量ずつ混合し、PICの形成を促すために激しく振とうした。PICの形成が見られなくなるまでさらにCS水溶液を少量ずつ加え、得られたゲル状のPICを遠心分離により単離した。その後、小型熱プレス機(AH-2003または H300-15, AS ONE Corp.)を使用して熱プレス操作を行った。PICゲルをポリテトラフルオロエチレン(PTFE)シート2枚で挟み、さらにその上下から厚さ100 µmのポリエチレンテレフタレート(PET)シートを設置した。まず120 ℃に加熱したプレス機の上下のステンレス板に10秒間接触させ、ゲル中の水分を蒸発させた。次に拡がったゲルを小さく折り畳んだのちPTFEシート2枚で挟み、そのPTFEシートの間にフィルムのサイズにあわせて中心部を切り取った厚さ100 µmのPETシートをスペーサーとして入れ、20 MPaで3分間熱プレス操作を行うことでCS/CHIフィルムを得た。この手法で得られるフィルムは厚さ80 µm程度であり、薄く黄色を帯びていた。この着色は加熱によりメイラード反応が進行しフミン質が形成したためと考えられ17、熱プレス温度35 ℃でフィルム作製した際には回避できる16。CHIとHYAなど他のアニオン性多糖との複合フィルムも同様の手法により作製可能であり、いずれのフィルムもCS/CHIフィルムと同様の巨視的、微視的形態を示した9,18。以上のように、本手法(熱プレス法)は緻密で高い成膜性を有する多糖複合フィルムを作製するための汎用性の高い手法である。これら多糖複合フィルムは緻密な構造に基づいた高い機械的強度を示し、特にCS/CHIフィルムの場合、約80 MPaの最大点応力を示す。またフィルムを水に浸漬すると速やかに膨潤し、30分以降では膨潤率が一定となる。すなわち基本的には水不溶性である。膨潤したフィルムは柔らかくなり強度や自立性は低下するが、支持膜の使用やフィラーの添加より改善することができる15,19。膨潤性についてより詳細に述べると、膨潤率は多糖の種類、溶液のpHや塩強度に依存し、たとえばリン酸緩衝生理食塩水(PBS)中37 ℃で長時間インキュベートするとある種のフィルムは徐々に崩壊していく。言い換えれば、多糖複合フィルムは条件に応じて生分解性フィルムとして扱うことができる。
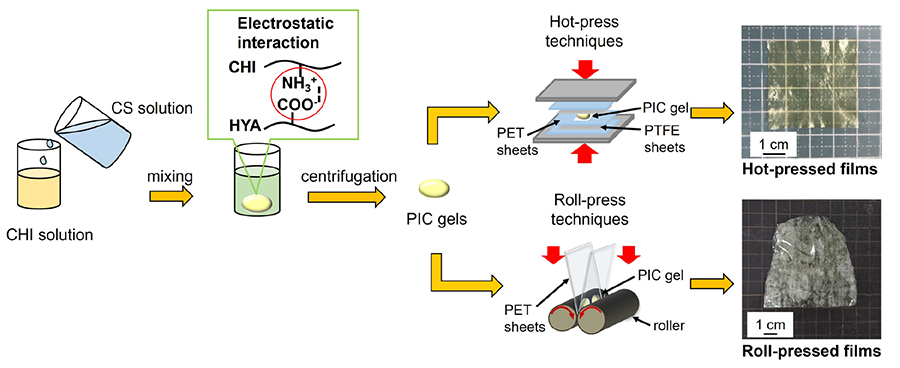
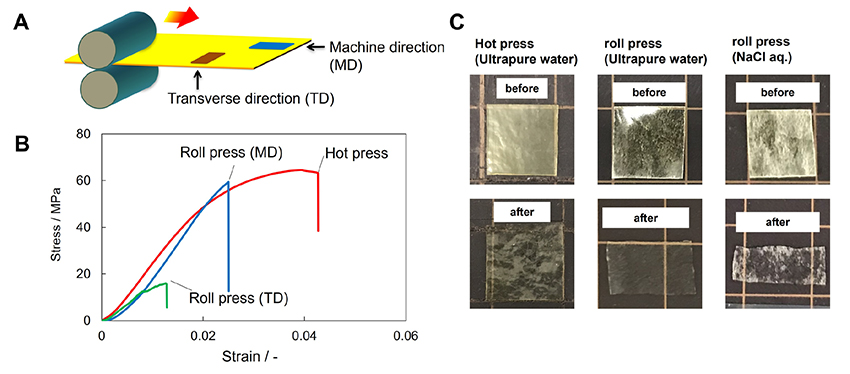
多糖複合フィルムは熱プレスによる成膜だけでなく、加熱延伸法によっても成膜可能である(図 2下段)20。上記と同様に作製したCHIとCSからなるPICゲルについて、加熱ロールプレス装置(IMC-1107, Imoto Machinery Co., Ltd.)を用いて加熱延伸操作を行った。PICゲルを上下から厚さ100 µmのPETシートで挟み、ローラー(40 mmΦ)の間を通して圧延した。さらにその後、ゲルを折りたたんで複数回圧延することで加熱延伸フィルムを作製した。得られたフィルムは熱プレスで作製したフィルムと同様に、透明で柔軟性がある自立膜だった。成膜条件の最適化について検討したところ、ロール温度と圧延速度がフィルムの成形性に大きな影響を与えることが確認できた。具体的には、ロールの回転速度を8 rpm、ロール温度を120 ℃としたとき、得られたフィルムの成膜性が最も高かった。加熱延伸フィルムの引張試験により、機械方向(MD)のフィルムの機械的強度が横方向(TD)の機械強度よりも約5倍高いことが明らかになり、加熱延伸操作がフィルムに機械的異方性を与えたことを確認した(図 3 (A), (B))。さらに、フィルムを水溶液に浸漬後乾燥させると、フィルムはMD方向に収縮し、TD方向に膨張した(図 3 (C))。このような収縮および膨張は、加熱延伸フィルムが形状記憶材料として使用できることを示している。このほか、多糖のPICは界面紡糸法によりファイバーの形態にも成形加工可能である21。
これら多糖複合フィルムの機能面での評価についても検討を進めてきた。たとえば創傷被覆材などバイオマテリアルとしての可能性について評価するため、CHIと種々のアニオン性多糖からなるフィルム上での細胞培養について検討した22。その結果フィルムの細胞毒性は低く、アニオン性多糖の種類により細胞活性を制御できる可能性が示唆された。そのほか本フィルムの選択透過膜としての利用についても検討している23。
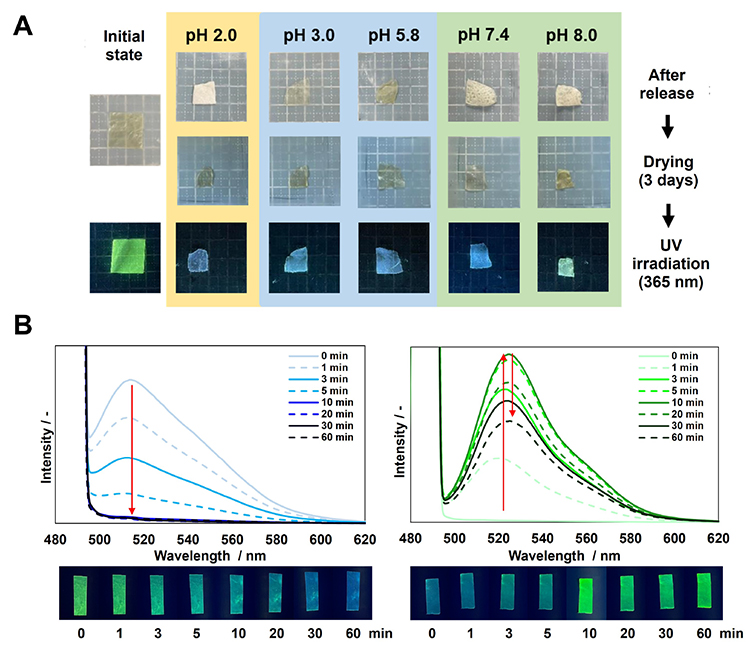
ここでは多糖複合フィルムの物質担持能について紹介する。CS/CHIフィルムは薬物モデル分子の担持および放出が可能であり、媒体のpH環境に応じて分子の放出速度が変化することを見出している24。さらに、フィルムに担持された分子のpH応答性およびフィルム中での多糖との相互作用を明らかにするため、フルオレセイン(FL)を担持した多糖複合フィルムを作製してFLのイオン化と放出挙動について評価を行った16。FLを担持したフィルムは、PIC作製時の溶液にFLを添加して熱プレス法によって作製した。得られたフィルムは薄黄色で、365 nmの紫外光を照射するとFL由来の発光を示した(図 4 (A))。このフィルムをリン酸緩衝液(pH 2.0, 3.0, 5.8, 7.4, 8.0)に浸漬したところ、溶液のpH、多糖間の静電相互作用、およびFLの構造に応じてFLの放出挙動が変化した。ただし放出実験後でもFL分子の半分以上がフィルム中に残存しており、いずれのフィルムも紫外光照射によりFL由来の蛍光が観察された(図 4 (A))。ここで、各pHの緩衝液に浸漬後のフィルムに残存したFLのイオン化状態は溶液中のものとは異なっていることを確認した。この違いは、フィルム中のFLがフィルムを構成するCHIやCSと静電相互作用や水素結合を形成することにより生じたと考えられる。さらに、乾燥状態のフィルムを塩化水素、アンモニア雰囲気下に静置することでフィルム中のFLのpH応答性を確認したところ、どちらの場合もフィルム中のFLの構造が変化することがわかった(図 4 (B))。これらの結果は、担持した分子のイオン状態をフィルム内で制御できることを示しており、分子をフィルム内に特定のイオン状態で固定化することも可能となる。さらに、このフィルムは分子の形状や荷電状態に応じてCHIおよびCSが分子を3次元的に取り囲むように担持させることが可能であるため、様々な分子の担持が可能と考えられる。これらの特性は、本フィルムが薬物徐放担体などのpH応答性材料として使用できることを示している。
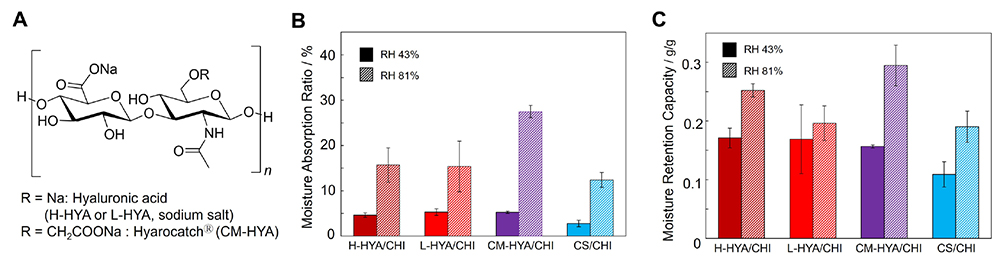
多糖PICからなる材料は、その構成多糖の性質を維持したまま成形加工できるという利点がある。HYAは優れた生体適合性、生分解性を持ち、細胞接着、遊走、分化を促進し、創傷治癒を含む多くの細胞プロセスに関与している25。また、HYAは優れた保湿能力、粘弾性、潤滑特性を有することから、創傷被覆材の湿潤環境を実現するのに有用であると期待されている。そこで、CHIとHYAのPICからなる多糖複合フィルム(以下HYA/CHIフィルムのように表記する)を作製し、HYAの分子量と化学修飾が膨潤状態における物性へ与える影響について調査した18。具体的には、高分子量体のHYA(H-HYA, 分子量1200000から2200000)、低分子量体のHYA(L-HYA, 分子量 ≧ 10000)およびHYAの第一級ヒドロキシ基にカルボキシルメチル基を導入した誘導体(CM-HYA, 分子量800000から1200000, 修飾率65から95%)を使用して作製した(図 5 (A))。得られたフィルムはいずれも薄黄色に着色した柔軟性のあるフィルムであった。引張試験により各フィルムの機械的強度を測定したところ、H-HYA/CHI (81.3 ± 5.9 MPa)やL-HYA/CHI(70.2 ± 5.9 MPa)と比較してCM-HYA/CHI(98.8 ± 4.1 MPa)が最も高い強度を示した。これはフィルム中のカルボン酸基の量とイオン架橋密度の増加によるものであると考えている。HYAは二糖繰り返し単位あたりのカルボキシ基の数は1であるのに対し、CM-HYAは1.65〜1.95となっている。また超純水およびPBS(pH 7.4)中におけるフィルムの膨潤率を確認した。超純水中では、L-HYA/CHI > H-HYA/CHI > CM-HYA/CHIの順番に膨潤率が大きくなった。一方PBS中ではL-HYA/CHIの膨潤率が時間経過とともに減少した。これは、フィルム中のL-HYAが溶液中に溶け出したことが原因である。HYAの分子量が同程度のHYA/CHIフィルムで比較すると、H-HYA/CHIよりもCM-HYA/CHIの方が膨潤率は低かった。以上の結果より、CM-HYA/CHI フィルムは、作製したフィルムの中で最も高い最大応力と最も低い膨潤度を示し、CM-HYAが多糖複合フィルムの物理的特性を改善することがわかった。さらに、各フィルムの吸湿性と保湿性についても調査した。フィルムの吸湿性は相対湿度43%, 81%環境下で48時間静置したときの重量変化から、保湿性はPBS中に浸漬して膨潤させたフィルムを相対湿度43%, 81%環境下で48時間静置したときの重量変化から評価した。CM-HYA/CHIフィルムは他のHYAフィルムおよびCS/CHIフィルムと比べて最も高い吸湿性と保湿性を示した(図 5 (B), (C))。これらの結果は、多糖複合フィルムの物理的特性に対する多糖類の種類、分子量と電荷密度の重要性を示し、CHIとCM-HYAからなるフィルムはその高い吸湿性、保湿性から創傷被覆材や細胞足場材料などバイオマテリアルとして有用であることを示している。
CHIとアニオン性多糖からなるPICから操作性の高い多糖複合フィルムの作製を行い、その物性や機能を評価した。我々が開発した多糖複合フィルムは、水に可溶な多糖から作製しているため成形加工が容易であり、様々な構造材料への応用も期待できる素材である。非共有結合を駆動力として構造形成をしており、CHIおよびアニオン性多糖以外にもさまざまなサイズや電荷の分子を内包した複合フィルムを作製することができる。多糖の種類や分子量を変えることでフィルムの膨潤性や吸湿性、保湿性など物性の制御が可能となる。これらの特性は多糖複合フィルムが薬物徐放担体や創傷被覆材などバイオマテリアルとして有用であることを支持している。CHIと複合化できるアニオン性高分子電解質は多糖に限らず多種にわたり、このようなアプローチによりCHIの材料としての応用可能性がさらに拡がると期待される。