
氏名:黒河内 政樹
東海国立大学機構 名古屋大学 糖鎖生命コア研究所 研究員
1998年北海道大学理学部卒業、2004年博士(理学)取得。2004年北海道科学技術総合振興センター主任研究員、 2005年北海道大学 博士研究員を経て、2006年北海道大学大学院先端生命科学院 特任助教。 2012年(公財)野口研究所に入所、糖鎖生物学研究室 研究員、糖タンパク質工学研究室 室長、糖鎖有機化学研究室 研究員に従事。 2024年より現職。研究テーマは有機化学、分析化学、糖鎖工学、グイコミクス、グライコプロテオミクス。

氏名:古川 潤一
東海国立大学機構 名古屋大学 糖鎖生命コア研究所(iGCORE))特任教授
北海道大学 整形外科学教室 客員教授
1996年北海道大学理学部卒業、2001年博士(地球環境科学)取得。2001年日本学術振興会特別研究員(北海道大学 理学部)、博士研究員を経て、2007年より理学部 特任助教。2016年より医学研究院 先端的糖鎖臨床生物学分野 特任准教授。2022年より現職。研究テーマは生物有機化学、糖鎖分析化学。独自の開発した分析ツールを用いた包括的な糖鎖分析について研究を進めている。
ヒューマングライコームプロジェクト(HGA)のセグメント2では、大規模な糖鎖カタログ(ヒト血漿総合グライコーム)を作成して、TOHSAと呼ばれる大規模データベースの構築することが最も重要なミッションの一つである。本セクションでは、ヒト血漿/血清中に含まれるO結合型糖鎖の前処理方法と解析を含む最近の私たちの研究ついて紹介する。
生体内のタンパク質の50%以上は、糖鎖が結合している糖タンパク質である。糖タンパク質の糖鎖は、タンパク質のフォールディング、構造安定性に関与しており、生体分子の輸送、分泌、認識、代謝、シグナル伝達に重要な役割を果たしている。この糖鎖は、大きくN結合型糖鎖とO結合型糖鎖に分類される。N結合型糖鎖はアスパラギンの側鎖に、O結合型糖鎖はセリン、スレオニンの側鎖に結合している。従来、O結合型糖鎖はムチンやムチン様タンパク質に見られる比較的に稀な翻訳後修飾と考えられてきた。しかし、最近、分泌タンパク質の約80%がO結合型糖鎖の修飾を受けている事が明らかになった1,2。O結合型糖鎖の構造変化は、IgA腎症3やTn症候群4、クローン病5、腫瘍形成6などに関与している為、O結合型糖鎖の生物学的および臨床的機能を解明するために、多くの研究が行われている。網羅的に糖鎖構造を切断する酵素を持つN結合型糖鎖の糖鎖解析は進んでいるが、O結合型糖鎖は、網羅的に糖鎖を切断する酵素が存在しない為、化学的手法を用いて糖鎖切断を行い、糖鎖解析を行う必要がある。近年、我々は、糖鎖切断と糖鎖標識化を同時に行う手法(BEP法)を報告した7。BEP法(アルカリβ脱離+ピラゾロン標識法)は、アルカリ処理によるタンパク質からのO結合型糖鎖の切断(アルカリβ脱離反応)と遊離した糖鎖の還元末端側のアルデヒド基へのピラゾロン誘導体の標識反応が連続的に進行し、ピラゾロン化糖誘導体が生成する事を利用している。現在、O結合型糖鎖解析の新しい技術開発や改良を続けており、シアリル化糖鎖異性体を質量分析法で識別する技術、シアル酸結合様特異的アルキル化法(SALSA)と組み合わせた蒸発BEP法を用いたヒト血漿/血清中のO結合型糖鎖解析を開発している8。
ヒューマングライコームプロジェクト(HGA)のセグメント2では、大規模な糖鎖カタログ(ヒト血漿総合グライコーム)を作成して、TOHSAと呼ばれる大規模データベースの構築することが最も重要なミッションの一つである。本セクションでは、2-1)新しい蒸発BEP法によるO結合型糖鎖の回収量の向上について、そして2-2)SALSA法を用いたシアル酸含有O結合型糖鎖のMALDI-TOF MS測定上の検出の高感度化について報告し、3)大規模解析の為のヒト血漿/血清中に含まれるO結合型糖鎖の前処理方法と解析を含む最近の私たちの研究ついて紹介する。
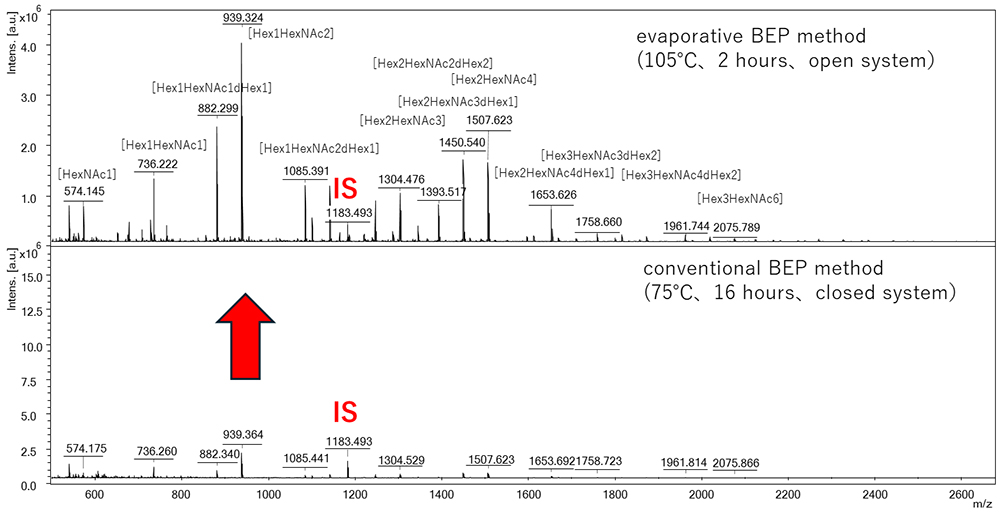
O結合型糖鎖付加はタンパク質の翻訳後修飾の一つであり、O結合型糖鎖はSer,Thr残基の側鎖に結合している。O結合型糖鎖は、特徴的な構造に応じて、コア1型~8型の8つのタイプに大きく分類される。N結合型糖鎖は、市販されているペプチド-N-グリコシダーゼF(PNGase F)によってタンパク質から網羅的に様々なタイプ(ハイマンノース型、複合型、混合型など)の糖鎖を切断することはできるが、O結合型糖鎖は、コア1型、コア3型を切断できるエンドグリコシダーゼは存在するが、網羅的にすべてのタイプの糖鎖を切断する酵素は存在しない。その為、網羅的に糖鎖を切断して解析するには、化学的手法により、糖鎖を切断する必要がある。アルカリ条件下でSer,Thr残基のαプロトンの引抜きによって、Ser,Thr残基の側鎖に結合している糖鎖は切断される(アルカリβ脱離)。これによって、O結合型糖鎖を網羅的に切断する事ができるが、O結合型糖鎖の分解を引き起こすピーリング反応が進行しやすい。よって、ピーリング反応を抑えたO結合型糖鎖の切断手法が求められる。我々は、アルカリ条件下で糖鎖切断と同時に還元末端側をピラゾロン化合物で標識する事によって、ピーリング反応を抑える事が可能なBEP反応を開発した7,9,10。このBEP反応は、当初、75℃、16時間、密閉系の条件で行っていたが、マイクロウェーブ反応装置を用いた110℃、2時間、密閉系で糖鎖回収量を向上させ11、現在、反応装置の汎用性、簡便性を考慮し、105℃、2時間、開放系による蒸発型BEP反応を開発し、さらに糖鎖回収量を向上させる事に成功した8。
同じ試料(porcine stomach mucin, PSM)を用いて、従来型BEP反応(75℃、16時間、密閉系)と蒸発型BEP反応(105℃、2時間、開放系)を行い、ISを混合して、糖鎖誘導体を調製し、MALDI-TOF MS測定を行った。測定したスペクトルのメインの糖鎖ピークを比較すると糖鎖回収量が劇的に向上している事が分かった(Figure 1)。これは、高い温度による反応促進と溶媒蒸発による試薬濃縮が要因であると考えられる。
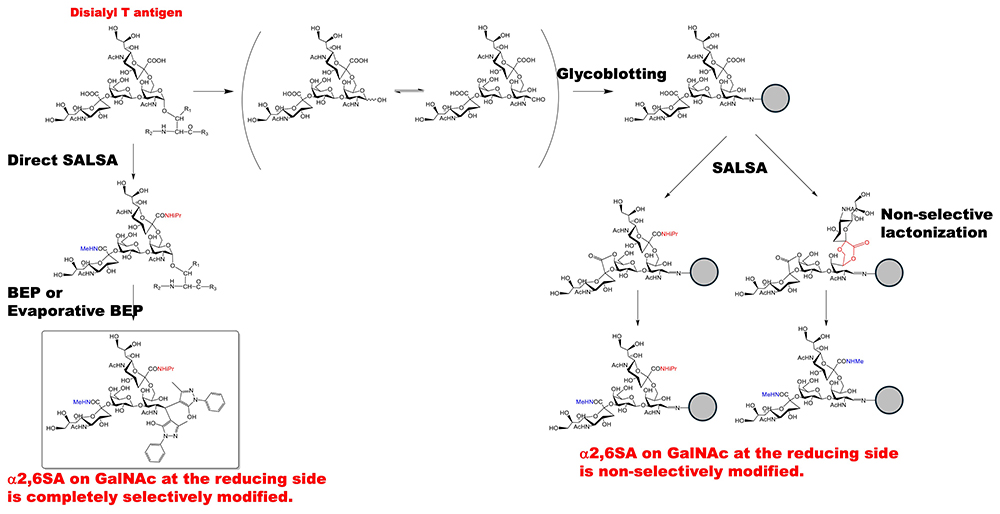
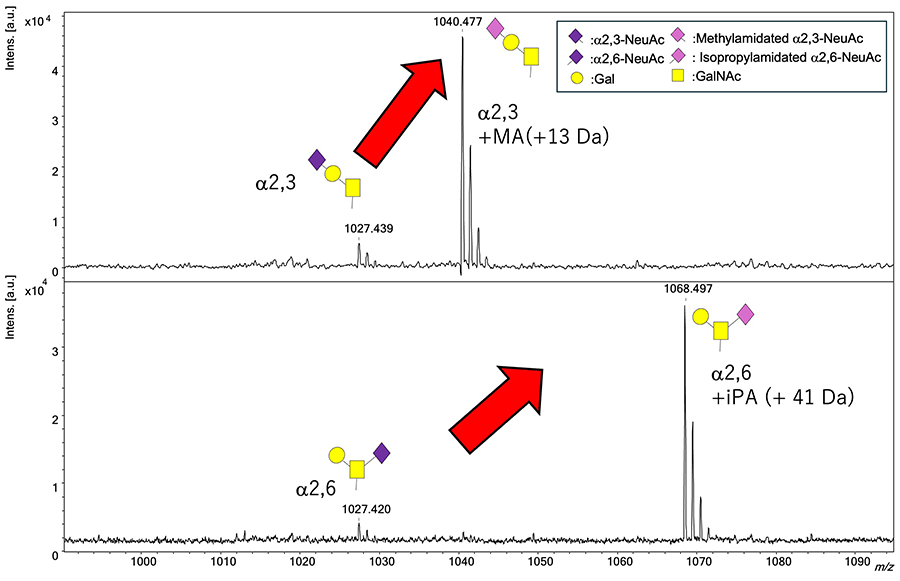
最近の研究では、シアル酸の糖鎖異性体を質量分析法で区別するためにいくつかのシアル酸の結合様式特異的な誘導化が報告されている12。我々は、分子量の異なる分子でアミド化修飾するシアル酸結合様式特異的な誘導化法を開発した。これは、N結合型糖鎖、糖脂質の遊離糖鎖に対して開発され、遊離糖鎖の還元末端のアルデヒド基をヒドラジドビーズ上に捕捉するグリコブロッティング法を行い、糖鎖上のα2,6-結合のシアル酸をイソプロピルアミド化、α2,3-やα2,8-結合のシアル酸はラクトン形成を介したメチルアミド化を行う事(SALSA反応)によって、結合様式の違いを分子量差で識別できるようにシアル酸を修飾する手法であった13,14。O結合型糖鎖も同様に固相上に捕捉した時にSALSA反応を行うと、O結合型糖鎖のジシアリルT抗原の還元末端側のGalNAc残基に結合しているα2,6-結合のシアル酸がイソプロピルアミド化とメチルアミド化の混合になる事が分かった15。これは、固相上に捕捉した還元末端側のGalNAcが開環し、GalNAcの5位のOH基とα2,6-結合のシアル酸のカルボキシル基が非選択的にラクトン化し、その後メチルアミド化が引き起こされる為である。その模式図をFigure 2の右側に示す。よって、ジシアリルT抗原の選択的なアミド化を行う為には、還元末端側のGalNAcが閉環した状態である糖タンパク質上でSALSA反応を行い、その後、蒸発型BEP反応を行う必要がある8。そこで我々は、Figure 2の左側の反応を進めるべく、糖タンパク質上でSALSAを行い、メチルアミド化されたα2,3-結合のモノシアリルT抗原とイソプロピルアミド化されたα2,6-結合のモノシアリルT抗原を調製した。次に、SALSA法の利点を示す為に、未修飾のα2,3-結合のモノシアリルT抗原とα2,6-結合のモノシアリルT抗原と等量ずつ混合し、MALDI-TOF MS測定を行った。その結果、SALSAによって、修飾されたα2,3-結合のモノシアリルT抗原とα2,6-結合のモノシアリルT抗原は両方とも、MALDI-TOF MSスペクトルの糖鎖ピークの強度が劇的に向上している事が分かった。これにより、シアル酸含有糖鎖のシアル酸の結合様式の違いを分子量の違いとして検出でき、かつ高感度で測定する事が可能となった。
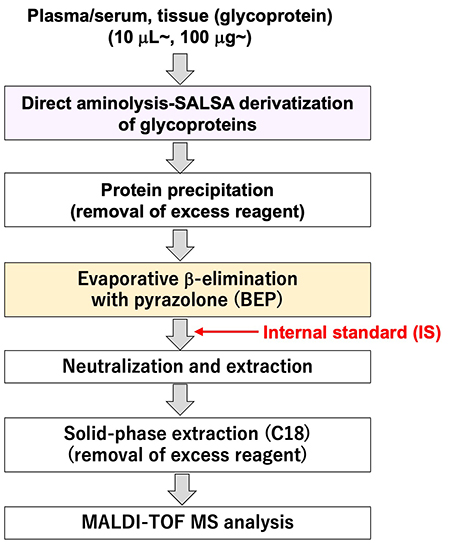
上述したようにO結合型糖鎖を解析する準備は整った。よって、我々はヒト血清/血漿中の大規模解析を行うためのO結合型糖鎖解析のプロトコールを作製した。O結合型糖鎖解析のプロトコールをFigure 4に示す。このプロトコールに要する時間は、合計約4時間と短く、大規模解析で懸念される処理時間の問題並びに測定の問題を解決できたと考えている。
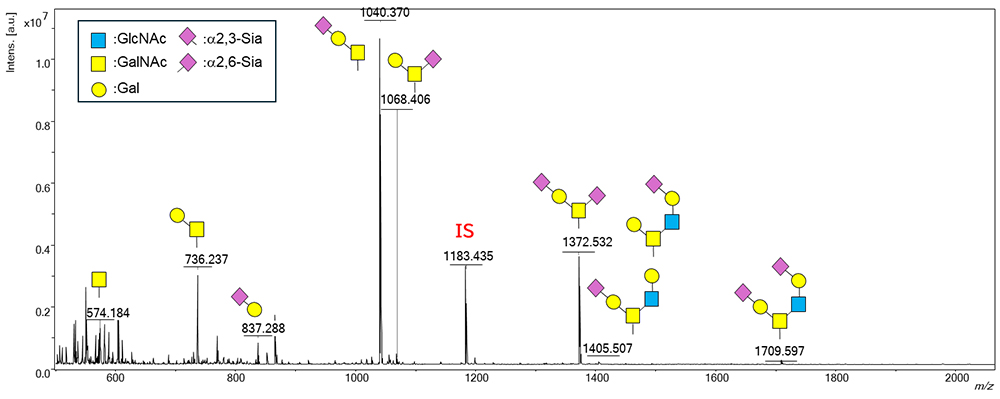
Figure 5に市販の血清のO結合型糖鎖のMSスペクトルを示す。これにより、ヒト血清中に存在するシアル酸の結合様式を識別した7種類のO結合型糖鎖を確認できた。
O結合型糖鎖は、大規模コホート研究へ向けた血清/血漿中のO結合型糖鎖を測定する準備ができ、O結合型糖鎖を定量的に解析するための開発を行っている。現在、多検体試料を処理できる自動前処理装置を作製している。これらの装置開発は、大規模コホート研究の総合グライコミクスを達成するには必要不可欠である。