
氏名:門松 健治
東海国立大学機構理事、名古屋大学統括副総長、糖鎖生命コア研究所所長
1982年九州大学医学部を卒業し、小児外科に入局。1989年医学博士を取得し、1990年に米国NIH研究員、1993年に帰国し、2004年名古屋大学大学院医学系研究科教授(生物化学講座)、2017年同研究科長に就任。2021年糖鎖生命コア研究所所長、2022年東海国立大学機構理事、名古屋大学統括副総長。近年は糖鎖と神経軸索再生を中心に研究。より広い視野を求めてヒューマングライコームプロジェクトを提案し、現在に至る。
2023年4月ヒューマングライコームプロジェクトが日本で始動した。本プロジェクトは、これまで3大生命鎖(核酸、タンパク質、糖鎖)の中で格段に少なかった糖鎖情報を他の生命鎖と同等のレベルまで引き上げる。そのために、ヒト糖鎖構造と生合成機構を網羅的に取得する。ヒト糖鎖構造は臨床情報や表現型とともに大規模な集団の個人別のデータとしてカタログ化される。これらの情報はナレッジベースTOHSAに格納され、世界のすべての研究者はこれまで避けてきた糖鎖を容易に日常の研究に取り入れられるようになる。こうしてューマングライコームプロジェクトは、科学者に新しい生命像を与え、生命科学の新しい時代を開く。
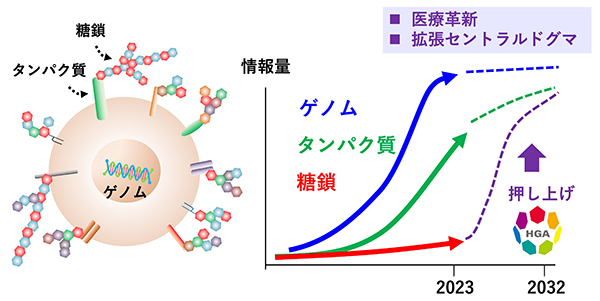
地球上には870万種類の生物種が生息し、バイオマスとして約550ギガトン炭素に相当する。そのうち植物が450ギガトンを占め、動物はわずか2ギガトンである。さらにヒトは0.06ギガトンであり、地球上のバイオマスの0.01%に過ぎない1。一方で、これらすべての生命体をつくる分子は驚くほど似通っている。例えば、核酸(DNA、RNA:ヌクレオチドの鎖)、タンパク質(アミノ酸の鎖)、糖鎖(単糖の鎖)はまさに共通してこれらの生命を紡ぐ鎖である。ただ、これら3大生命鎖に関する情報量を比較すると、糖鎖の情報量は核酸、タンパク質に比べて、圧倒的に少ない。このことが生命を解く科学の力を極めて限定的にしてきた。
すべての細胞は、例外なくその表面を糖鎖の森で覆われる。ヒトを作る37兆個のひとつひとつの細胞が、ウイルスなどの外来物と出会うとき、細胞同士が出会うとき、その最前線には糖鎖がある。事実、インフルエンザの治療薬タミフルは糖鎖を標的に作られた薬であり、SARS-CoV-2の感染にも糖鎖は必須である。さらにABO型の血液型は糖鎖が規定するものであり、がんマーカーの多くが糖鎖もしくは糖鎖を有する分子である。このように糖鎖は生命活動へ寄与するが、上述の事例はいわば例外的なものであり、実は、我々は糖鎖をほとんど知らない。糖鎖に関する基礎的情報量が圧倒的に少ないからである。だから、これまで大多数の研究者は糖鎖を避けて生命を理解しようとしてきた。
糖鎖研究の最大のボトルネックは糖鎖構造の複雑性、多様性であった。しかし、今やそれを解決できる技術的基盤が整おうとしている。そこで、我々はヒト全糖鎖の構造を取得し、糖鎖の情報を核酸、タンパク質並みに底上げする基盤整備事業を立ち上げたいと考えた(図 1)。そしてヒューマングライコームプロジェクト(Human Glycome Atlas Project: HGA)を文部科学省大規模学術フロンティア促進事業として2023年4月に開始することができた(https://www.mext.go.jp/a_menu/kyoten/20230727-mxt_kouhou02-1.pdf)2。大規模学術フロンティア促進事業は文部科学省が支援する学術のための基盤整備事業である。この事業はこれまでカミオカンデやアルマなどに代表される物理学・宇宙科学分野のプロジェクトがほとんどであり、HGAは生命科学分野初となる。
HGAによって、我々は、いわば生命というジグソーパズルの最後のピースである糖鎖を埋めることができる。糖鎖情報を自在に活用し、新しい生命の姿を見ることができる。それは、これまで達成できなかった認知症、老化、難治性がん、糖尿病性腎症などの予防法、治療法の開発へとつながる。
生命科学の基盤整備事業として歴史的に最も際立っているのはヒトゲノム計画であろう。1990年に米国主導で始まったこの事業は一人のヒトの全ゲノム配列を決定しようとするものであった。イギリス、日本、フランス、ドイツ、中国の5か国も加わり分担して解読を進めた。Celera Corporation も独自に同様のプロジェクトを進めた。これは競争を呼んだが、データ公開を旨とするバミューダ原則(1996年2月)を生み、分析技術を発展させ、結果として事業を加速させた。2001年には全ゲノム配列のドラフトが両者から発表された3,4。これによりゲノム構造の規律と複雑性が明らかとなり、やがてエピゲノムやノンコーディングRNAをはじめ新たな機構が次々と発見され、分子生物学の爆発的な拡大につながった。科学者はまるで新しい生命像を得たかのごとくであり、生命科学への貢献は計り知れない大きさであった。加えてSARS-CoV-2のRNAワクチンやゲノム診断による予防的がん治療などに見られるように、ゲノム医療が当たり前の時代を我々は迎えているのであり、ヒトゲノム計画の社会的貢献も計り知れない。
第2の生命鎖タンパク質への基盤整備事業も大きな足跡を残した。タンパク3000は、2002~2006年度、文部科学省支援の下でタンパク質の3次元構造解析を推進した(http://www.tanpaku.org/e_index.php)。2000年に始まり現在も進行中のHuman Protein Atlasはスウェーデン主導である。インド、韓国、日本、中国、ドイツ、フランス、スイス、アメリカ、カナダ、デンマーク、フィンランド、オランダ、スペイン、イタリアが参画している。抗体を開発し、トランスオミクスを進め、タンパク質の時空間分布を明らかにしてデータベース化してきた。多くの生命科学者はそのデータベースを日常的に使っている(https://www.proteinatlas.org/)。
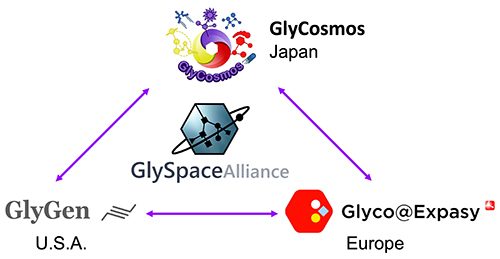
第3の生命鎖糖鎖については、アメリカ5、日本6、ヨーロッパ(https://www.ludger.com/images/news/A-roadmap-for-Glycoscience-in-Europe.pdf)で研究の指針を示すロードマップが各々作られた。この3つの地域は独立に糖鎖インフォマティクスを進めてきたが、2018年に互いに協力し統合するGlySpace Allianceが始まった(http://www.glyspace.org/)(図 2)。そして糖鎖は、HGAとして上記の生命鎖の基盤整備事業と同じ旅路に着こうとしている。
ヒト糖鎖情報量を核酸、タンパク質のレベルまで押し上げ生命科学の革新を目指すHGAのビジョンは高邁であり、その実現には相応の準備が必要である。中でも(1)実力(2)体制(3)計画の3つの要件が重要である。
糖鎖科学は他の生命科学領域と同様に国際的な協働と競争によって発展してきた。日本のこの領域への貢献は大きく、例えば糖鎖関連遺伝子の約60%は日本人科学者によって同定されたし、多くの糖鎖分析技術も日本発である。現在も分析やインフォマティクスなどHGA遂行のための基幹技術は世界に伍する実力を有している。一方で世界にも多くの優れた研究者と研究機関が存在する。HGAがやがて世界とのハーモナイゼーションを遂げ、他分野の研究者も巻き込んで生命科学の変革を引き起こすことを目指したい。
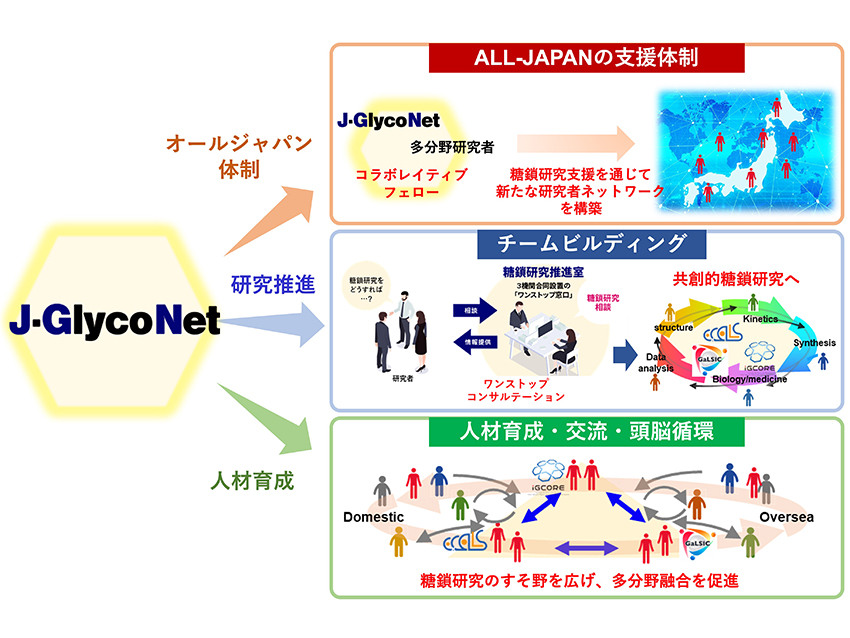
オールジャパン体制を確立:文部科学省の支援による共同利用・共同研究拠点J-GlycoNetを2022年4月に始動した(https://j-glyconet.jp/)(図 3)。J-GlycoNetは3つの機能を持つ。まず、オールジャパン体制の基盤整備である。J-GlycoNetでは全国の独立した100名を超える糖鎖研究者にcollaborative fellows(CF)として他分野研究者との共同研究の推進などに尽力いただく。2つ目は研究支援である。他分野研究者を意識したone stop consultationによって研究チームビルディングを行う。3つ目は次世代育成である。そのためにセミナーや若手研究者支援活動を行う。
研究者コミュニティの支持を獲得:HGAは日本の学会および学会連合の厚い支持を得た。具体的には日本生化学会、日本分子生物学会、日本糖質学会、日本糖質科学コンソーシアム、多糖の未来フォーラム、日本農芸化学会、日本神経科学学会、日本バイオインフォマティクス学会、生物科学会連合(日本の生命科学関連32学会の連合)、日本脳科学関連学会連合(日本の脳関連学会31学会の連合)であり、合わせて20万人の科学者コミュニティからの支持と期待を得た。
国際ネットワークを構築:Lille大学(仏)、Griffith大学(豪)、Macquarie大学(豪)、Academia Sinica(台)、Harvard大学(米)、Genos Glycoscience Research Institute(クロアチア)とは協働のための協定を結んだ。さらに上述の糖鎖インフォマティクスの世界連合であるGlySpace Allianceと欧州の糖鎖科学連合であるCarboMetからも支持が表明された。2023年時点で既に、Glyco26(2023年)、米国Society for Glycobiologyのannual meeting(2023年)などの国際的会議でもHGAを紹介し、期待と支持が集まっている。
HGAの研究体制を構築:東海国立大学機構(名古屋大学と岐阜大学から成る大学法人)が実施主体となり、自然科学研究機構、創価大学を加えた3機関が中心となってプロジェクトを動かす(https://human-glycome-atlas.org/)。J-GlycoNetによるオールジャパン体制を基盤にして、バイオバンクを有するコホート研究機関、糖鎖分析技術を有する機関などと協働する。計画と運営上の重要なこととして、本プロジェクトの成果が糖鎖科学者に留まることなく幅広い分野の研究者に活用されることを強く意識する。
お手本:ヒトゲノム計画はゲノム配列の解読に留まらず、DNAシークエンス技術の発展にも寄与し、さらには既述の通り、生命科学と社会に大きなインパクトを与えた。HGAはその糖鎖版と言ってもよく、まさにヒトゲノム計画をお手本にしてビジョン、計画を策定した。また、Human Protein AtlasのデータベースはHGAが構築する糖鎖ナレッジベースTOHSA(後述)が究極的に目指す姿である。分野を問わず生命科学に関わるすべての研究者が躊躇なく活用できるナレッジベース構築を目指したい。
科学目標:DNA→RNA→タンパク質というセントラルドグマは生命活動の中心に位置するが、一方で、セントラルドグマだけで生命を理解することは不可能である。このことはほとんどの生命科学者が知っている。セントラルドグマの制御を超えた分子群の機能を知ることが重要である。このいわば「拡張セントラルドグマ」の中でもアプローチが難しかったのが糖鎖である。HGAは拡張セントラルドグマの実像を明確にする基礎を与えるものであり、それが本プロジェクトの科学目標である。
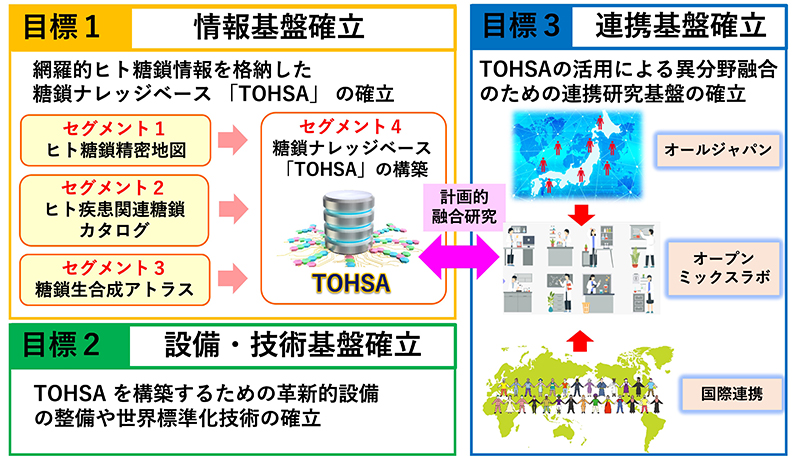
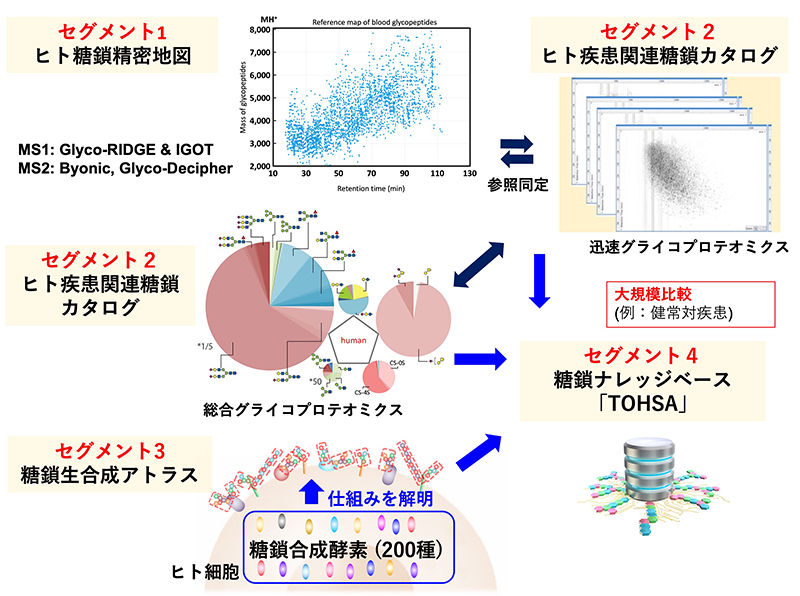
科学目標到達のための施策:この科学目標に到達するために我々は4つのセグメントを設けた(図 4、5)。
セグメント1.ヒト糖鎖の精密地図を作成する。これをグライコプロテオミクスのレベルで行う。
セグメント2.ヒト糖鎖カタログを作る。ヒト糖鎖精密地図を参照に大規模な集団の個人別のグライコプロテオミクス解析を行う。また、「総合グライコミクス」によって、N型糖鎖、O型糖鎖、糖脂質、グリコサミノグリカン、遊離糖鎖の5カテゴリーの糖鎖構造を同時に個人別に取得する。以上の糖鎖構造データ取得のためにバイオバンクを持つコホート研究機関と協働する。こうして個人別の糖鎖構造を臨床情報や表現型とともにカタログ化する。糖鎖は個人によって、また疾患によって異なるので、これによって疾患や人種、年齢、性別などによる特徴を見出すことができる。
セグメント3. 糖鎖生合成機構を解明する。ヒトの全ての糖鎖合成酵素の活性を標準化し、また、合成酵素の細胞内局在と糖鎖生合成の関連を明確にする。このことによって糖鎖構造の予測と糖鎖の自在な改変ができ、医療への応用も可能となる。
セグメント4.上記セグメント1~3で取得したデータを臨床データとともにナレッジベースTOHSAに格納する。TOHSAはすべての研究者が容易に使えるようにユーザーインターフェースを充実させ、世界で共有する。
これらのセグメント1~4は「情報基盤確立」として研究目標1の中で遂行する。一方、これらを支えるために「設備・技術基盤確立」を研究目標2の中で行う。さらにTOHSAに象徴される本プロジェクトの成果は糖鎖科学コミュニティに閉じて使われるのでは意味をなさない。そこで研究目標3「連携基盤確立」の中で計画的融合研究を遂行する。例えば疾患と糖鎖の関係性の解明を臨床医学研究者との共同研究で目指す。同様に糖鎖を含むトランスオミクス研究をゲノム研究者などと、糖鎖改変細胞作製を細胞生物学者・臨床医学研究者などとの共同研究で行う。
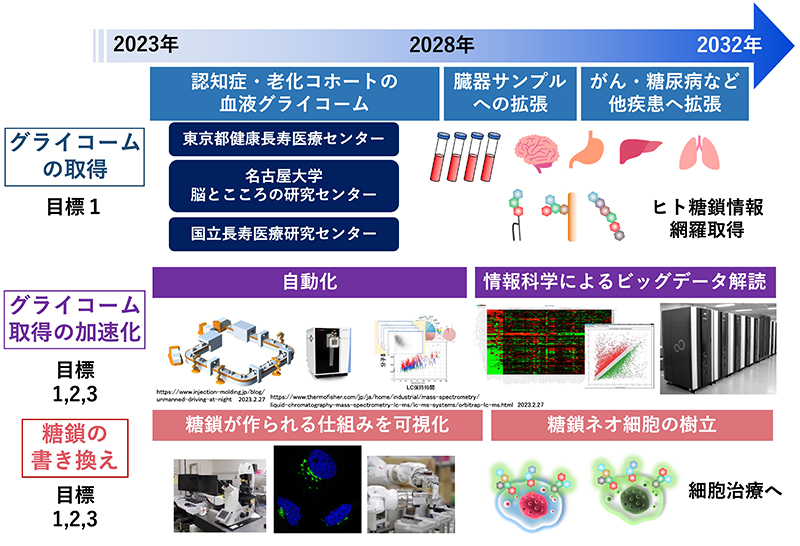
年次計画:前期5年間は研究対象として認知症と老化に焦点を絞り、血漿と血清を中心に2万件を解析する(図 6)。後期5年間は研究対象を難治性がん、糖尿病などに拡大し、血漿・血清に加えて、死後脳やがん組織・正常組織などの糖鎖を20万件解析する。多数のサンプルを分析し、また、専門家でなくても分析を可能にすることを目標に自動分析装置を開発する。また、インフォマティクス技術を向上させる。さらに糖鎖改変細胞の創出を行い医療への応用も見据える。
HGAの糖鎖情報の特徴:ナレッジベースTOHSAに収められる糖鎖情報の特徴は次のようにまとめることができる。1.網羅的グライコプロテオミクスは挑戦的であり、それが完成すると極めて有用なデータとなる。2.5つのカテゴリーの糖鎖構造を同時に取得する「総合グライコミクス」は世界的にもユニークである。3. 糖鎖合成酵素の活性と局在の網羅的解析は初の試みであり、遺伝子発現に基づく糖鎖の構造予測を大きく向上させる。4.20万件に上る臨床情報や表現型も紐づいた個人別糖鎖カタログが完成すれば、それは世界に例を見ないものであり、認知症や老化その他疾患の分別、予知、診断、予防、治療に有用となる。
Glycoforumでは今後HGAに関する情報を定期的に掲載する。その一部にはHGAの進捗報告も含まれる。繰り返しになるが、HGAはひとり糖鎖科学のためのものではない。それが核になって多分野の研究者が自分の日常の研究に糖鎖情報を取り入れ、やがて新しい生命像を得ることが目的である。世界各国が本プロジェクトに参画し、ムーブメントとなることを望んでいる。
本論文について貴重なコメントをいただいた佐藤ちひろ博士、安藤弘宗博士、岡島徹也博士、木塚康彦博士、木下フローラ聖子博士、Morten Thaysen-Andersen博士に感謝する。