
氏名:山村 初雄
名古屋工業大学大学院工学研究科工学専攻生命・物質科学プログラム 教授
1984年に九州大学薬学部を卒業し、1986年に同大学大学院薬学研究科修士課程を修了。1986年アサヒビール株式会社、1989年福山大学薬学部助手を経て、1991年に名古屋工業大学工学部助手に就任し、同年、長崎大学薬学部で博士(薬学)を取得。1998年から1999年に文部省在外研究員としてオーストラリア国立大学(C. J. Easton教授)へ留学。2001年名古屋工業大学助教授、2003年同大学大学院助教授、2006年同教授となり現在に至る。2023年シクロデキストリン学会賞。
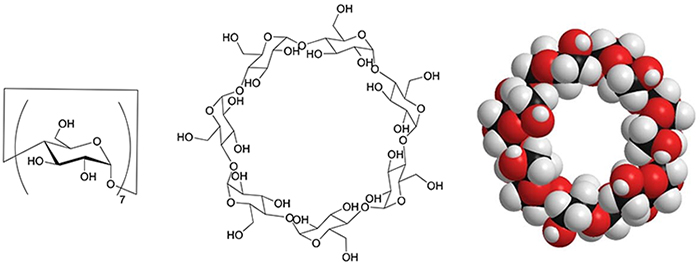
シクロデキストリン(CD)はブドウ糖が環状に連なった1ナノメートルの大きさを持つオリゴ糖である(図 1)。その環状構造がつくる空洞にさまざまな分子を取り込む性質をもつ。この現象は包接と呼ばれ、CDは学術的な研究の対象であるだけでなく、実際に食品、化粧品、医薬品などにも広く利用されている。このようにCDは包接という大変興味深く有用な性質を示すが、多数のヒドロキシ基を持つ分子であることも重要な特徴である。一般にヒドロキシ基は有機化学的な手法によってさまざまな官能基に変換することができる。したがってヒドロキシ基を反応点にしてCDに化学修飾を施すことで新たな機能を持つ誘導体が合成できる。ここでは、著者らがCDに陽イオン性基と疎水性基を導入することで細菌の細胞膜を障害して抗菌性を示す物質の創成に取り組んだ研究について述べる。
「新型コロナウイルスは、薬剤耐性の「サイレント・パンデミック」を含む国際保健の脅威に対する備えを強化することの重要性を示した。薬剤耐性は、既に我々の経済や保健システムに大きな影響を与えており、薬剤耐性感染症による死亡者数は世界全体で年間推定70万人に達する。このような薬剤耐性の脅威にも関わらず、市場の失敗を含む様々な要因により、新しい抗生物質の開発が進まず、30年以上もの間、新しい抗生物質が市場に投入されていない」 (抗生物質の開発を促進するための取組に関するG7財務大臣文書 2021年12月13日)。
上記のように薬剤耐性とそれを獲得した病原菌による感染症は人類に対する脅威の一つとみなされ、先進国首脳会議(G7)でも継続して議論されている。わが国でも薬剤耐性は静かに、しかし着実に進行し、2019年にはメチシリン耐性黄色ブドウ球菌(MRSA)(図 2)とフルオロキノロン耐性大腸菌の2種の菌血症に限っても合わせて年間8000名が死亡していたことが初めて明らかになった1。世界的には最悪の場合には2050年に死亡者が年間1000万人に達するとする試算も出ている2。
多くの抗菌剤は酵素などの細菌の生存に必須なタンパク質を阻害して効力を発揮する。これに対して細菌は遺伝子を変異させることでタンパク質を変化させて薬剤耐性を獲得してしまう。この薬剤耐性に対抗するために近年注目されているのが細菌の膜を障害する抗菌ペプチドである3。この作用は強力で速やかに細菌を死滅させることができる。さらにタンパク質などを阻害する従来の抗菌剤とは作用機序が異なるために、それらに対して耐性を獲得した細菌にも有効である。そして細菌膜を変化させるのは細菌にとっては代謝的に容易ではないので新たに耐性を獲得するリスクが低いとされる。ただ残念なことに、多くの抗菌ペプチドは細菌膜と同様に動物細胞の膜も障害するために溶血などの副作用を引き起こす。そして毒性を下げるための構造の改良と製造が必ずしも容易ではなく、学術的な研究の多さに比べて治療薬として実用化された例は非常に少ない。
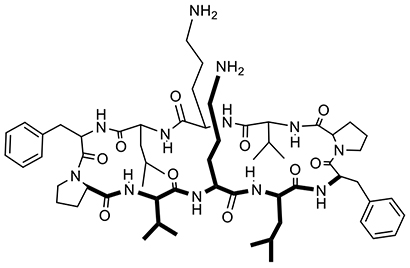
著者はCDの化学修飾による誘導体合成の研究に携わり、キラル認識を含む精密な分子認識のために官能基をCD上に導入配置する研究を行ってきた4-6。一方で、抗菌ペプチドの研究にも携わった7,8。そこでβシート構造をとる抗菌ペプチドであるグラミシジンS(図 3)がカチオン性のアミノ基と疎水性のアルキル基を分子の中に備え、それらが協同的に細菌膜表面の脂質リン酸基と脂質二重膜内部に作用して膜障害するのを目の当たりにした。その合理的構造と巧みな作用に感心するとともに、そこからペプチドと同様の大きさであるCDに然るべき官能基を備えれば抗菌性が発現するのではないかと思いつき、抗菌ペプチドのバイオミメティクスとしてのCD誘導体の研究を開始した。
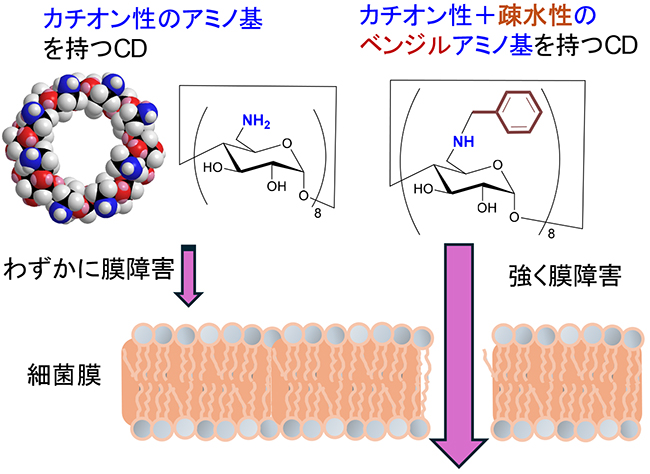
ただ、抗菌ペプチドは複数種類のアミノ酸からできており、そのまま模倣するとCD誘導体の構造が複雑になる。そこで、できるだけ単純な構造で抗菌機能を再現することを目指した。それは官能基の構造と活性の関係を理解しやすくするためであり、また実用化も視野に入れて煩雑な合成を避けるためである。まず、膜脂質リン酸と相互作用するためのアミノ基のみをCDに導入した9。それを細菌に作用させたところ、細胞内からのカリウムイオンの漏出が観察され、細菌膜を障害することが確認できた(図 4)。しかし細菌の増殖を抑えることはできず、やはり脂質二重膜内部をかく乱する疎水性基を併せ持つことが必要と示唆された。そこでアミノ基と疎水性基を一つにまとめたベンジルアミノ基を求核置換反応によってCD分子中の全てのグルコースに導入した9。8個のベンジルアミノ基を持つCD誘導体は効果的に細菌膜を障害し、それが黄色ブドウ球菌の増殖を抑えるのに必要な最小濃度(minimum inhibitory concentration, MIC)は5 μMであり、抗菌ペプチドであるグラミシジンSの値(4 μM)に匹敵した。このようにペプチドに比べれば驚くほど単純で一種類の官能基のみしか持たない構造であるにも関わらず、強い抗菌性を示したことからCDを用いて抗菌ペプチドを模倣することのアイディアの正しさと可能性の高さが明らかとなった。ただ、より良い抗菌性を目指して他のアミン求核剤による類縁体合成を試みたが、複雑な反応混合物を与えるものばかりで目的物を収率良く合成できるものが残念ながら見つからなかった。おそらくアミン求核剤は塩基として脱離反応を引き起こすこともあるので全てのグルコース上で置換反応を起こした目的物を与えるのが難しかったと考える。
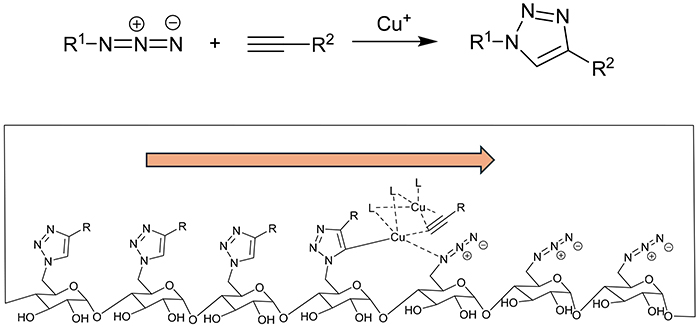
そこで、求核置換反応に変わる膜障害性基の導入方法としてクリックケミストリーに注目した。銅触媒の存在下、アジドとアルキンが選択的に収率良く、生成物を“One Click”で与えるはずの反応は、CDを構成する全てのグルコースに膜障害性基を導入するのに理想的に思えた。しかし実際にCDで反応をしてみると通常の加熱では収率良く目的物は生じなかった。そこでマイクロ波加熱を検討した10。この加熱は分子を振動させることによって内部から迅速に加熱することを可能にする。試したところ、驚くほど飛躍的に反応効率は向上し、CDを構成する全てのグルコースで反応した生成物を短時間で定量的に与えた。さらに興味深いことに原料がまだ残っている反応の途中でも、生じたのは目的物だけで、一部のグルコースのみが反応した中間体は観察されなかった。このall or none型反応となる理由として、触媒である銅とアルキンがアジドと生じたトリアゾール環の間で錯体を作り、それがあるグルコースから隣のグルコースへと移動しながら分子上の全てのアジドが反応するまで連鎖的にクリック反応が進行すると推定している(図 5)。この高効率な反応は1000個のグルコースが連結したアミロースにおいても起こり3分間という短時間でその全てのグルコース上に置換基が導入できた11。反応を起こすアジド基の間隔と配置が重要と考えられるため、おそらくグルコースのみならず、他の糖が連なったオリゴ糖においてもマイクロ波支援クリック反応は効率よく進行すると推定できるため様々なオリゴ糖誘導体合成に広く役立つと期待する。
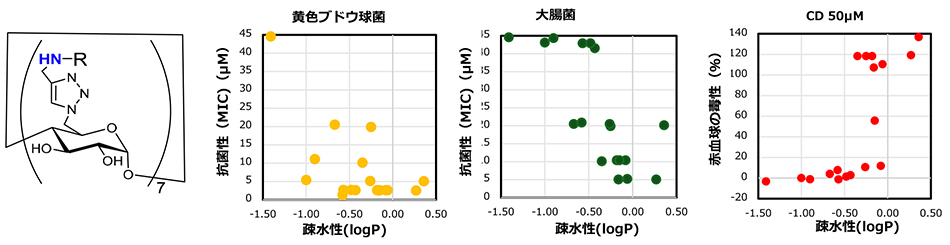
マイクロ波支援クリック反応を用いて種々の膜障害性基を導入した誘導体を合成して構造と抗菌性の相関を調べた。まず、CDを構成するグルコースの第一級ヒドロキシ基の代わりに種々のアルキルアミノ基を導入した誘導体ではアルキル部の違いにより抗菌性が現れた12-15。アルキル基の炭素数が6~7個のものに強い抗菌性が見られ、例えば黄色ブドウ球菌に対するMICは1~3 μMと非常に小さくなった。さらに検討した結果、抗菌性は鎖状、分枝、あるいは環状というアルキル基の立体構造ではなく、もっぱら分子の疎水性に依存することが示唆された(図 6)。そして抗菌ペプチドでよく見られる赤血球を破壊する溶血性も同様に疎水性に依存するが、溶血を引き起こす疎水性は細菌に抗菌性を示す疎水性と異なることがわかった。細菌細胞と赤血球の膜障害で見られたこの違いはそれぞれの細胞膜の脂質と膜構造の違いに起因すると考えられ、これによって分子の疎水性をコントロールすることで動物細胞を障害せずに細菌に抗菌性を示すことができることを明らかにした。一方で、グルコースやマルトースの誘導体では同じ置換基を持っていてもほとんど活性は現れず、したがって7個程度以上の置換基を持つ分子であることが望ましく、それを実現するCDが抗菌物質のための優れた原料であると明らかにできた11。
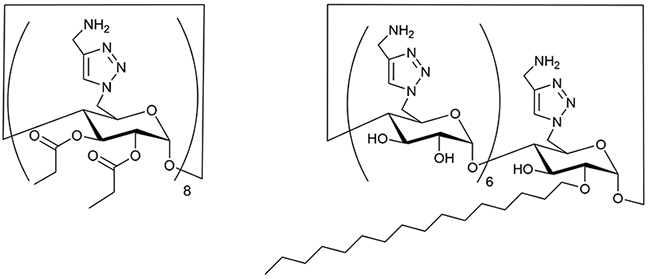
次にCDの一級ヒドロキシ基側をカチオン性に、二級ヒドロキシ基側を疎水性にした両親媒性構造を持つ誘導体(図 7)を合成した16。これは抗菌ペプチドであるグラミシジンSがβシート平面の上側にカチオン性のアミノ基を、下側に疎水性のアルキル基を持つことを模倣したものである(図 3)。まずアミノ基とアシル基を導入したCD誘導体について、アシル基を変化させて調べたところ、プロパノイル基を持つものだけが抗菌性を示した。これもアシル基を選ぶことで前述のように抗菌に適した疎水性となったとして説明できる。ただし、その中でも比較的、親水的であるので溶血性は前述のアルキルアミノ基を持つものより抑えることができた。そこで全ての二級ヒドロキシ基をアシル化するかわりに1本の長鎖アルキル基を結合してみた17。そうしたところ、これまで合成した強い抗菌性を示す誘導体の中では最も親水的で、それゆえに溶血性を示さないものを見出すことができた。このように官能基の種類とCD上の配置を工夫することで抗菌ペプチドが動物細胞膜も障害するのに対して細菌に選択的な誘導体を発見し、細菌膜の障害による抗菌性と動物細胞膜の障害による毒性を乖離して安全にする目処をつけることができた。
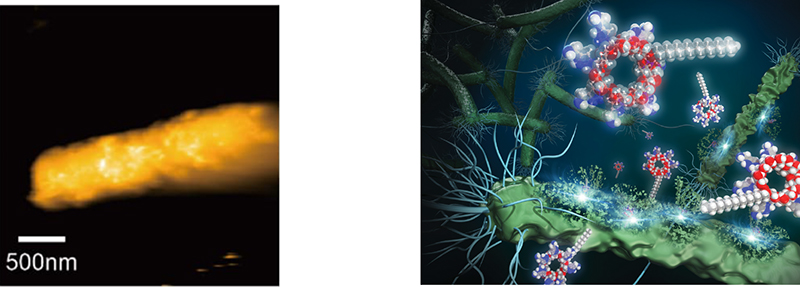
そして、これらの抗菌機序がペプチドと同じく細菌膜障害であることを確認した。黄色ブドウ球菌などのグラム陽性細菌は細胞質膜のみを、大腸菌などのグラム陰性細菌は細胞質膜と外膜と呼ばれるもう一つの膜の二つの膜を持つ。まずグラム陰性菌の外膜障害を蛍光プローブの取り込みを用いて評価したところ、抗菌ペプチドであるポリミキシンBと同程度であることがわかった11,15。そして細胞質膜の障害については細胞内部のカリウムイオンの顕著な漏出が見られた。同時に速やかな生菌数の減少が観察されたことでCDは細胞膜を障害することで殺菌することを明らかにした13-17。さらに直接的な証拠として高速原子間力顕微鏡(AFM)によってCDが生きている大腸菌の膜表面を障害する動画を撮影することに世界で初めて成功した(図 8)15。
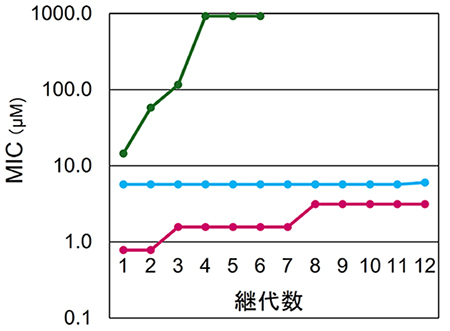
これらの抗菌CD誘導体は膜障害を引き起こすことで、一般の細菌だけではなく、既存の抗生物質に耐性を獲得した耐性菌に対しても抗菌性を示す。実験の結果、病院で患者から単離された薬剤耐性菌株にも有効であるとわかった。例えば院内感染で有名になったメチシリン耐性黄色ブドウ球菌(MRSA)に対する最小発育阻止濃度MICは2 μMになるものがあり、これはMRSA感染症治療薬であるバンコマイシンのそれ(1 μM)とほぼ同じであった。さらに世界保健機構(WHO)や米国疾病対策センター(CDC)が危険視し我が国の日本医療研究開発機構(AMED)感染症創薬産学官連絡会が定めたPriority1病原菌である、基質特異性拡張型βラクタマーゼを産生する大腸菌およびカルバペネマーゼを産生する大腸菌に対するMICはそれぞれ4μMおよび6 μMとなり、多剤耐性グラム陰性菌感染症治療薬でありWHOが必須医薬品18と定めるポリミキシンBのそれとほぼ同じであった。さらにCD誘導体に対する耐性の発現をアミノ基とプロパノイル基を持つ誘導体で調べたところ、細胞壁合成を阻害する抗生物質ホスホマイシンが連用により64倍超、DNA合成を阻害するノルフロキサシンが30倍程度のMICの増加を見せたのに対して、CD誘導体のそれは変化しなかった(図 9)16。このように細菌膜膜障害を引き起こすCD誘導体への新たな耐性の発生は起こりにくく薬剤耐性リスクが低いことが期待できる。したがって、上記のように耐性菌に抗菌性を示すCD誘導体が実用化されれば、すぐに耐性菌が生じて使用できなくなるのではなく長い期間にわたって病原菌に対抗する武器として多くの人々の命を救うのに役立つと期待する。
以上のように抗菌ペプチドに発想を得てCD分子の特徴を活かして抗菌性を現す誘導体を研究した。その過程でCDならではのユニークな反応と合成法も見出した。系統的に合成した誘導体は抗菌性と構造の関係を理解する情報を与えるとともに実用化が期待できる性能を現すことを示した。また、本研究はオリゴ糖CDが新規な機能を発現するために合目的な化学修飾が可能な特徴を持つことをあらためて示したものである。学術的にも実用上も興味深いCDが「中分子」化学の中心的存在としてますますその能力を発揮して活躍することを期待する。