
氏名:尾形 慎
福島大学農学群食農学類准教授 博士(農学)
2008年岐阜大学大学院連合農学研究科生物資源化学専攻博士課程修了、2008年博士号(農学)取得(岐阜大学)、ポスドクトレーニング期間を経て2012年福島工業高等専門学校助教、2015年同校准教授、2020年福島大学准教授。化学酵素合成法を基盤とした糖質複合分子の機能設計に関する研究に従事。
受賞:日本キチン・キトサン学会奨励賞(2024)、日本応用糖質科学会奨励賞(2021)、日本応用糖質科学会技術開発賞(2020)、日本農芸化学会奨励賞(2020)、インテリジェント・コスモス奨励賞(2017)など。
キチンは有望なバイオマス資源であり、カニやエビ、イカ、カブトムシ、コオロギ、シイタケなどのキチンを生合成可能な生物によって、地球上で年間推定1000億トンも生産されている。その構造は、β-1,4-グリコシド結合を介して連ったN-アセチルグルコサミン(GlcNAc)の直鎖構造が、分子内および分子間で数多くの水素結合を形成することで、結晶性の高い繊維構造をとる。現在、多くの研究者によって環境や資源、エネルギー問題の観点から、キチンの構造特性や生物機能を活用したバイオリファイナリー研究が盛んに行われており、その分野は成形や獣・医薬材料、バイオテクノロジー、化粧品、食品、農林水産、工業など多岐に渡る1。しかし、キチンのバイオマスとしての潜在能力から考えると、その利用は十分とは言えない状況にある。それは、キチンが木質バイオマスであるセルロースと比較して、一般有機溶媒への溶解性が低く、それが加工性や利用性の低下をもたらしているためである。我々の研究グループでは、キチンのバイオリファイナリー研究の一環として、キチンに比べて水への溶解性が高く、加工特性も格段に向上するキチン分解物に着目している。キチン分解物はキチンから工業的に製造されるGlcNAcとキチンオリゴ糖(2糖~6糖程度)の混合物である。本稿では、我々がバイオマス資源であるキチン分解物の利活用に焦点を当てて行った研究の内、生体内糖鎖の再構築と生物機能分子の創製について紹介する。
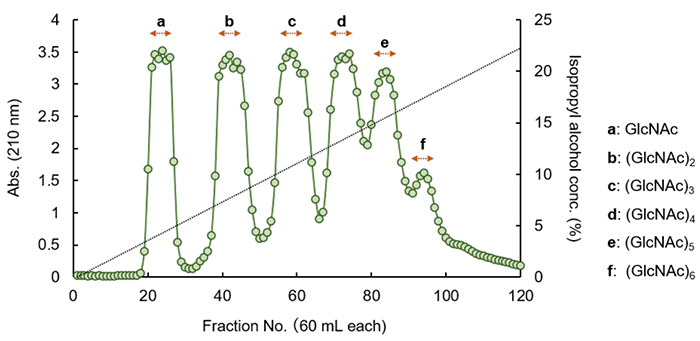
キチン分解物はGlcNAcとキチンオリゴ糖の混合物であり、精密な材料開発の原料として利用するためには、それらをさらに単離・精製する作業工程が必要である。当然、単一重合度に調製されたGlcNAcやキチンオリゴ糖を一般試薬として購入することも可能であるが、キチンオリゴ糖に関しては、2糖類であるN-アセチルキトビオースですら非常に高価である。キチン分解物からの単糖・オリゴ糖の精製技術に関しては、研究室ごとに独自の手順や秘訣があると思うが、折角の機会なので我々の研究グループの手法について紹介したい。ここでは、東京化成工業株式会社製のキチン分解物を5 g使用した例を示す。キチン分解物からのGlcNAcおよびキチンオリゴ糖の精製には、活性炭粉末とセライトとを等量で混合したスラリーを用いて作製した直径4.5 cm、高さ40 cmの活性炭セライトカラムを用いた。この方法は、活性炭粉末に対する単糖およびオリゴ糖の結合親和性が重合度ごとに異なるという特性を利用したもので、セライトはろ過助剤の役割を果たしている。溶出は10 Lの0→31%イソプロピルアルコール直線濃度勾配法により行い、キチン分解物中に含まれるGlcNAc~(GlcNAc)6を順次溶出することで各重合度の画分を得た(図 1)。画分の回収フラクションは高速液体クロマトグラフィー(HPLC)分析によって決定し、結果、GlcNAcは1.5 g、(GlcNAc)2と(GlcNAc)3はそれぞれ約0.8 g、(GlcNAc)4は0.5 g、(GlcNAc)5は0.3 g、(GlcNAc)6は0.1 gで得ることができた。また、HPLCによる純度分析の結果、GlcNAc~(GlcNAc)5の純度は96~99%であり、(GlcNAc)6の画分は60%以下であった。植物の生長や動物免疫賦活作用などが見い出された生理活性オリゴ糖である(GlcNAc)6に関しては、さらにBio-Gel P2ゲルなどを用いたゲル濾過カラムクロマトグラフィーによって再精製することで、純度98%以上の高純度体を得ることも可能である。以上のように、キチン分解物から一段階の簡単なカラム分離操作で単一重合度に調製されたGlcNAcやキチンオリゴ糖をグラムから数百ミリグラムスケールで得ることができる。
20世紀後半、糖鎖生物学分野の発展によって、生体内糖鎖の構造や生合成、さらには生命現象との関わりが次々と明らかになった2。糖鎖の機能については、構造成分の供給やタンパク質の物性の改変などに関わる糖鎖固有のものから、複合糖質の輸送管理や細胞接着および情報伝達の仲介と調節などの糖鎖とレクチン間相互作用によってもたらされるものまで、実に多種多様である2。程無くして、糖鎖生物学研究で得られた情報に基づいて、ライフサイエンスに寄与する様々な糖物質を人工的に創り出す糖鎖工学分野が誕生した3。しかし、自然界や生体内にごく微量に存在する様々な生理活性糖鎖を単離・精製し、工学的な材料開発へ展開するには、多くの課題が存在する。よって、安価な糖質同士を組み合わせて生理活性糖鎖をボトムアップ式で再構築する方法が、機能性糖鎖ライブラリーの調製法として有効である4。
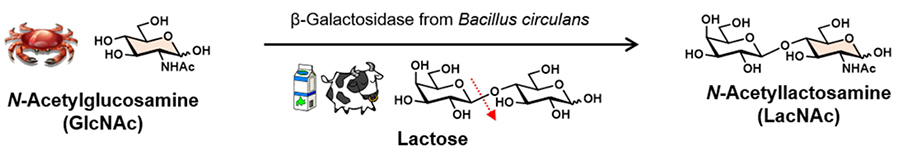
複合糖質のオリゴ糖鎖の構造に着目すると、構成糖にGlcNAcを含む糖鎖がいくつか存在することに気付かされる。例えば、N結合型糖鎖の付け根にはアスパラギンにGlcNAcの二量体であるN-アセチルキトビオース(GlcNAcβ1,4GlcNAc)構造がN-グリコシド結合を介して結合しており、N結合型糖鎖の非還元末端付近には分子認識に関わるN-アセチルラクトサミン(Galβ1,4GlcNAc; LacNAc)構造が普遍的に存在している5。LacNAcは人乳中に含まれる生理活性オリゴ糖の部分構造としても知られている6。つまり、海洋バイオマスであるキチン分解物から調製した糖素材を生体内糖鎖研究の材料として利用することができる。ここでは、一例として糖加水分解酵素を用いたLacNAcのin vitro酵素合成法について紹介する。糖供与体であるラクトース(18 g, 50 mM)と糖受容体であるGlcNAc(22 g, 99 mM)とを50 mM酢酸ナトリウム緩衝液(pH 5.0)に溶解後、Bacillus circulans由来β-ガラクトシダーゼ(15 U)を添加し、30 ℃で24時間反応を行うと、GlcNAcの4位ヒドロキシ基へのβ結合選択的なガラクトシル基転移反応が進行し、LacNAcを収量5.1 g、糖供与体あたりの収率として20%以上で得ることができる(図 2)7。この反応では副生成物がほとんどできないため、LacNAcの単離・精製も容易で、さらに糖受容体として用いたGlcNAcは回収し、再利用することができる。本法は、開発者の名にちなんで碓氷法と呼ばれており、安価なラクトースとバイオマス糖質であるGlcNAcを用いて高価な生体内オリゴ糖を量産化する画期的な手法である7。なお、オリゴ糖のin vitro酵素合成法は、その他に糖転移酵素や糖質加リン酸分解酵素を用いる方法があるので、興味がある方は参考文献を参照して頂きたい8,9。
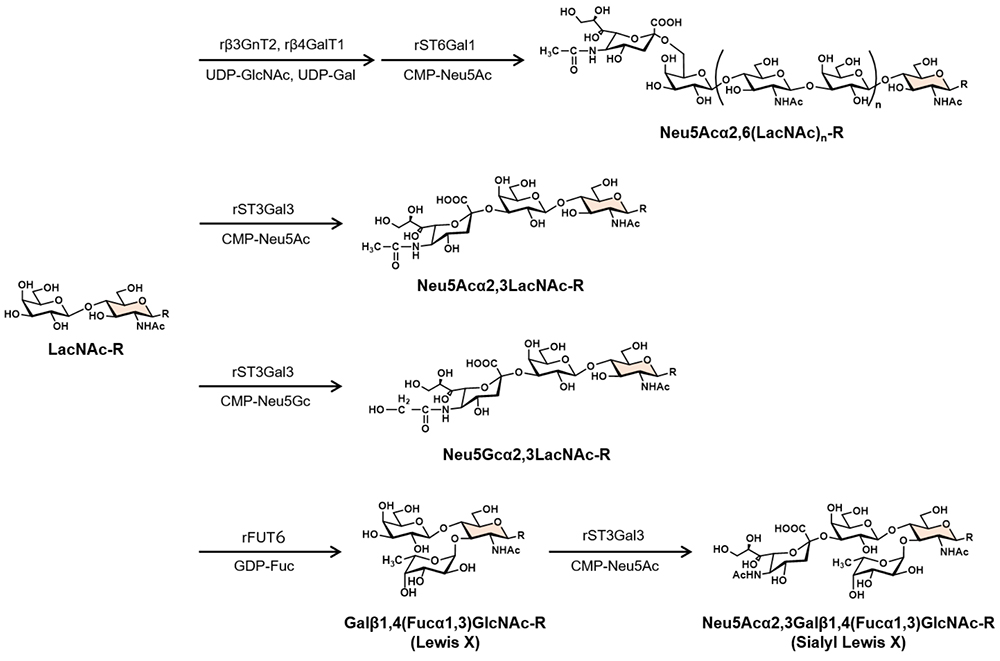
さらに、LacNAcと各種糖核酸供与体および糖転移酵素を組み合わせることで、インフルエンザウイルスレセプターであるNeu5Acα2,6(LacNAc)n(ヒト型)やNeu5Acα2,3LacNAc(トリ型)、Neu5Gcα2,3LacNAc(ウマ型)、細胞接着に重要な血液型糖鎖抗原であるGalβ1,4(Fucα1,3)GlcNAc(ルイスX抗原)やNeu5Acα2,3Galβ1,4(Fucα1,3)GlcNAc(シアリルルイスX抗原)など、様々な生体内分子認識に関与する機能性糖鎖を酵素合成することができる(図 3)10-12。
量的供給が可能になった機能性糖鎖を分子認識素子と見なしポリペプチドやタンパク質、脂質などに導入することで、天然の複合糖質を模倣したネオ複合糖質を合成することができる13。これらネオ複合糖質の利点は、構造が明確であることや必要量調製できる点、天然素材以上の物質特性を設計・付与できる点などが挙げられる。このような人工的に創製されたネオ複合糖質と呼ばれる生物機能分子群が、日々、多くの研究者によって開発され、生物科学研究に還元されている。ここでは、我々の研究成果である人工ムチンの合成とそれらを活用したタンパク質および病原性ウイルス吸着体について紹介する。ムチンはコアタンパク質に糖鎖が多価に結合した化合物群の総称で、多価配位した糖鎖が糖クラスター効果を誘起することで、様々な生体内分子間相互作用に関与してることが明らかになっている14。
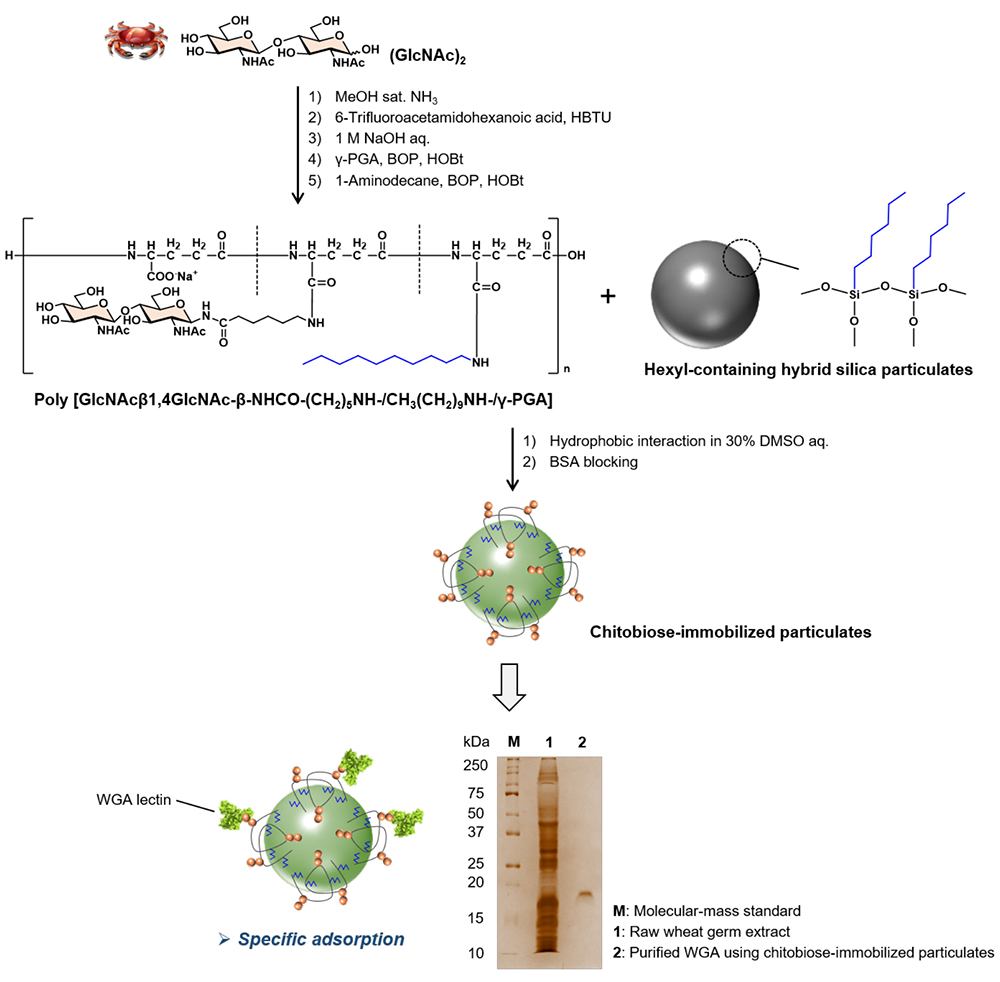
始めに、キチン分解物より調製した(GlcNAc)2を配糖化後、微生物発酵によって製造されたポリペプチドであるγ-ポリグルタミン酸の側鎖カルボキシ基に対して20%程度配糖体を導入することで生体内のムチンを模倣したキトビオース含有糖鎖ポリペプチドを作製した。さらに、キトビオース含有糖鎖ポリペプチド内に残存する側鎖カルボキシ基に対して、さらに20%程度デシル基を導入することで疎水基導入型キトビオース含有糖鎖ポリペプチドを合成した。続いて、別途調製した直径1μmの表面ヘキシル化シリカ粒子と疎水基導入型キトビオース含有糖鎖ポリペプチドとを30%ジメチルスルホキシド(DMSO)水溶液中で数時間振とう混合するだけで、糖鎖高分子が疎水性相互作用によって粒子表面に実に簡単にコーティングできることを実証した(図 4)15。さらに、合成したキトビオース固定化シリカ粒子表面の多価糖鎖は、設計通り、分子認識素子として糖鎖クラスター効果を発現し、目的タンパク質に対する結合親和性と結合特異性に優れた吸着体として機能することを明らかにした。合成粒子をアフィニティ吸着体として利用した実験では、生小麦胚芽抽出液中からGlcNAc結合性レクチンである小麦胚芽レクチンが構造選択的に吸着し、さらに、吸着物を粒子表面から取り外すことで、目的レクチンの一段階精製が可能であった(図 4)15。
この成果に基づき、馬インフルエンザウイルスの宿主細胞への接着および感染に関わる糖鎖構造を粒子表面に多価結合したウイルス吸着体の設計を行った。馬インフルエンザ感染症は、馬インフルエンザウイルスの感染による急性呼吸器疾患の総称である。伝染力が極めて強く、馬関連産業で最も警戒すべき伝染病である。馬インフルエンザウイルスはヒトやトリインフルエンザウイルス同様、ウイルス表面に存在するヘマグルチニンと呼ばれる糖結合性タンパク質が馬の呼吸器細胞表面にある馬に特異的なN-グリコリルノイラミン酸(Neu5Gc)含有糖鎖に結合することで感染に至る16。我々は、キチン分解物より調製および合成したNeu5Gcα2,3LacNAcを、前述の方法を用いて粒子表面へ固定化し、Neu5Gcα2,3LacNAc固定化シリカ粒子を作製した(図 5A)17。本粒子は、馬インフルエンザウイルス(A/equine/Malaysia/M201/2015)を感染させた馬より得られた鼻腔スワブ中からウイルスを選択的に吸着した。さらに、我々が開発した馬インフルエンザウイルス吸着技術とリアルタイムRT-PCR法を組み合わせることで、これまで困難であった感染初期等の超微量ウイルスの検出に成功した(図 5B)17。
本稿では、キチンから工業的に製造されるキチン分解物に着目し、それらを原料として設計・合成した分子認識能を有する生物機能分子について紹介した。はじめにでも述べたように、キチンを利用したモノづくり研究は多岐に渡り、常に研究者を楽しませてくれる、実に魅力的な研究素材である。今回は、主にキチン単糖および2糖を活用した分子認識材料の開発研究について紹介したが、我々の研究グループでは、GlcNAcを利用した簡便な生理活性物質の全合成研究や18、(GlcNAc)4を利用した酵素阻害剤および酵素活性測定用基質の開発19-22、(GlcNAc)6を利用したインジェクタブルゲルの開発などにも取り組んでいるので、また何かの機会に紹介したいと思う。