
氏名:半澤 健
東海国立大学機構岐阜大学 糖鎖生命コア研究所 研究員
2012年 新潟大学理学部卒業、2017年 理学博士取得 (新潟大学)、大阪国際がんセンター研究所 研究員を経て、2022年より現職。

氏名:中嶋 和紀
東海国立大学機構岐阜大学 糖鎖生命コア研究所 准教授
2001年 近畿大学薬学部卒業、2006年薬学博士取得、理化学研究所 基礎化学特別研究員、2009年 大阪大学 グローバルCOE 特任助教、2013年理化学研究所 脳科学総合研究センター研究員、2016年 藤田医科大学 研究支援推進本部 講師を経て、2022年より現職。
2023年4月に始動したヒューマングライコームプロジェクト(HGA)では、科学目標の一つとして、ヒト糖鎖精密地図を参照に大規模な集団の個人別のグライコプロテオミクスを行い、ヒト疾患糖鎖関連カタログを作ることを計画している。その年次計画では、前期5年間は研究対象として認知症と老化に焦点を絞り、血漿と血清を中心に2万検体を解析する。後半5年間は、さらに対象の疾患を拡げて、20万検体の解析に挑む。我々のユニットでは、グライコプロテオミクスの世界標準法を確立、さらに全自動化し、大規模コホートのグライコプロテオミクス解析を進めていく。
近年、人工知能やロボティクスなどの技術進展に伴い、研究プロセスそのものをロボットで加速する研究アプローチが世界的な潮流になりつつある。その発端の一つは、新型コロナウィルスの感染拡大によって自動PCR検査が普及したことであろう。臨床検体の取り扱いは感染の危険があるため、安全面とスピードを考慮すると、ロボットの導入による分析自動化が不可欠であった。また自動化は、単に1日あたりの検体処理数を増やせるだけでなく、熟練技術者を必要としないことや、検体取り間違えのリスクも軽減できるという利点がある。
プロテオミクスやグライコミクスは数十工程からなる複雑な工程をへて実施される。その自動化にはリキッドハンドラーと呼ばれる自動液体処理システムが用いられる1。しかしながら、現在のところ、実験作業は途切れ途切れに半自動で行われている。 次に、血液試料におけるグライコプロテオミクスの前処理自動化の難しさについて述べる。前処理操作は、プロテオミクスと類似する。具体的には、血液由来のタンパク質は、還元アルキル化、ペプチド断片化、糖ペプチド精製、さらに乾固・再溶解を行い、LCMSプレートに分注される(図 1)。
まずグライコプロテオミクスにおいて根幹となる課題は、糖ペプチドが糖鎖配列とキャリヤータンパク質由来のペプチドからなり多様な分子種が生成しうることである。一方、多検体分析では、1検体を1回の分析により実施することが望ましい。よって、分析深度とスループットのバランスを考えた前処理法を選択することが重要になる。
2つ目の課題として、MS測定における糖ペプチドのイオン化効率がペプチドに比べて低く、検出感度が低いことである。また非糖鎖付加ペプチドが多く存在すると、糖ペプチドのイオン化が抑制されるため、非糖鎖付加ペプチドを除去して、高純度な糖ペプチド試料を調製しなければならない。3点目は、血液試料の場合、血中タンパク質存在量のダイナミックレンジが広いこと、少なくとも事前にアルブミンや免疫グロブリンなどを除くことが望ましい。最近では、以上の課題を克服した堅牢な方法が報告されつつある2,3。
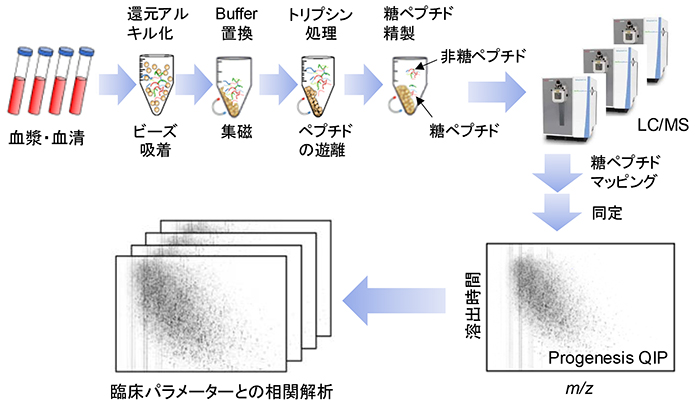
我々は、HGAの大規模コホート展開に備え、分析の網羅性と深度、スループット、さらに自動化適用性を兼ね備えたプロトコルを構築してきた(図 1)。データ解析では、ヒト糖鎖精密地図を参照するアプローチの一つとして、LCから溶出されるピークをProgenesis QIP(Nonlinear)注1)を用いて2次元マップを描写し、糖ペプチドをByonic注2)により同定、比較定量を行っている。ここでは、HGAにおいて取り組んでいるN-グライコプロテオミクスの前処理方法と自動化に向けた課題について概説する。
注1)Progenesis QI for proteomics:LCMS測定における差異解析ソフトウェア
注2)Byonic:タンパク質の翻訳後修飾を同定するソフトウェア
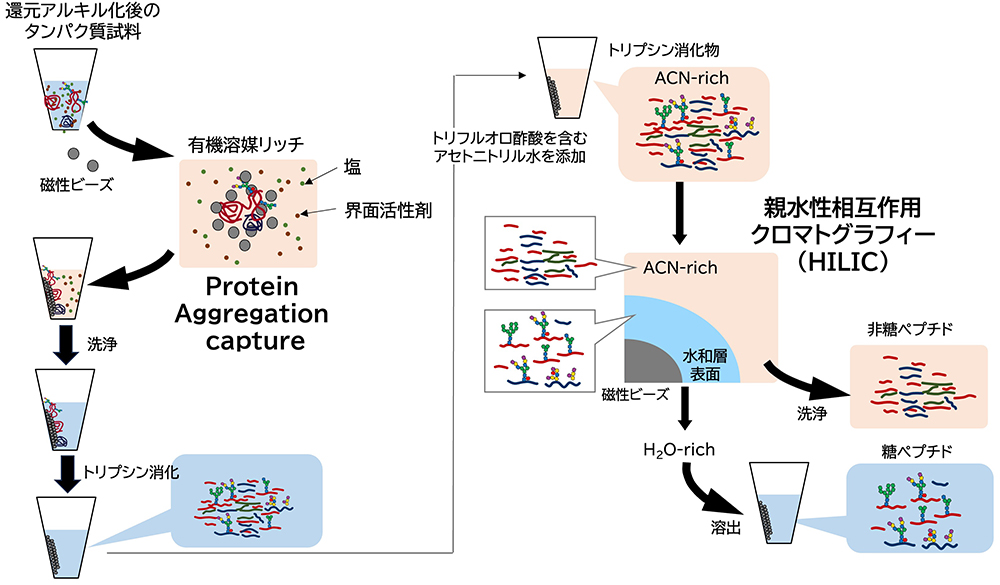
生体試料由来のプロテオミクスでは、タンパク質同定数、定量再現性などの向上、作業の効率化、自動化対応のために様々な前処理法が検討されている。例えば、SP3(Single-pot, solid-phase-enhanced sample-preparation)法は、磁性ビーズを用いて、1チューブ内で試料調製を行うことができる4。SP3法は糖ペプチド調製にも適用できる5。グライコプロテオミクスにおいてSP3法は、1)ペプチド断片化と(図 2左)、それに続く糖ペプチド精製において異なる原理に基づいて行われる(図 2右)。
SP3はProtein aggregation captureとも呼ばれ、有機溶媒(50-80% (v/v) エタノール、アセトニトリルなど)がリッチな条件下において、タンパク質は磁性ビーズ上に凝集されて保持させる。その後、磁性ビーズは2-3回洗浄し、塩や界面活性剤を除いたあと、トリプシンによるタンパク質消化を行う。SP3法では、ビーズの洗浄過程にて界面活性剤を除去できるため、トリプシンの消化効率が向上する。またドデシル硫酸ナトリウムなどの強力な変性剤を使用できるため、組織グライコプロテオミクスにも適用できる。
糖ペプチドを回収するためには、トリプシン消化後のペプチド混合物に高有機溶媒(主にアセトニトリル)のローディング液を加えて精製を進めていく。糖ペプチドの精製は、親水性相互作用クロマトグラフィー(HILIC)に基づいて行われる。HILICでは主にアセトニトリル条件で、親水性の固定相上に生じた水和層に糖ペプチドが保持される。非糖鎖付加ペプチドはアセトニトリル層に移行しているため洗浄すると除去できる。糖ペプチドは、水比率が高い溶媒によって溶出される。
SP3法によるペプチド断片化では、カルボン酸修飾ビーズがよく使用される。カルボン酸ビーズでも糖ペプチドは精製できるが、多糖などの修飾を施した担体を用いたほうが、糖ペプチドの回収率や純度が向上する6。また糖ペプチド精製に使用するローディング液にトリフルオロ酢酸を添加すると、糖ペプチドの純度を高めることができる。
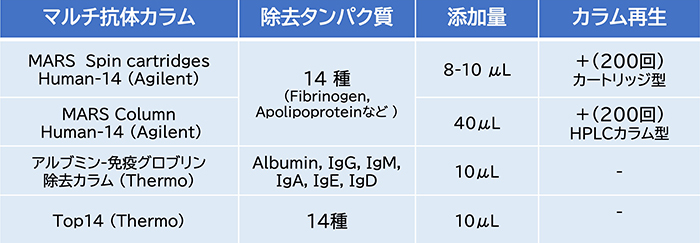
マルチ抗体カラムを用いるImmunodepletion法は、血液試料のプロテオミクスにおいて最も典型的な方法であり、これらではいずれも6種あるいは14種程度の高含量タンパク質が除去される。アジレント社のMARSカラムはカートリッジタイプとHPLCのカラムタイプがあり、血液試料の添加量に応じて使い分ける。しかしながら、カラムタイプはオフラインのHPLCで使用される。一方、カートリッジタイプは形状が特殊なため、自動化装置に組み込むことは困難である。
一方、Thermo社のカラム(アルブミンーグロブリン除去カラム、およびTop14)はレジンをバルク購入できるため、自動化プロトコルに適用しやすい。グライコプロテオミクスにおける両者の性能を比較した結果、血漿10μLから約2400個の糖ペプチドが同定された。しかし、マルチ抗体カラムを使用する際、非特異的な吸着により目的糖タンパク質が失われる可能性もある。また、マルチ抗体カラムは高価なため、大規模コホートの推進には制約がある。
多検体の定量再現性を得るうえで、調製済の糖ペプチドの化学変化にも注意を払う必要がある。典型的なものは、LCMSプレートのセット後に生じるメチオニンの酸化反応などがある。メチオニンの酸化体とデオキシフコースの質量数の和(Met+O+deoxyHexose)は、メチオニンとヘキソースの組み合わせ(Met+Hexose)と同じであるため、グライコプロテオミクスにおいて糖鎖の誤同定をもたらすことがある。
微量の疎水性ペプチドや糖ペプチドはチューブやマルチプレートに吸着しやすく、試料調製時においてロスが生じる。プロテオミクスでは一般に、親水加工した低吸着性のものが使用される。しかしながら、これらの吸着問題は分析結果において一部の糖ペプチドシグナルの低下として認められる。
ペプチドはLCMSシステム内のトラップカラムや分離カラム、バルブなどに吸着することが知られている。キャリーオーバーは直前に分析したものが混入してくるクロスコンタミネーションとして現れる。たとえ僅かなキャリーオーバーでさえも、タンパク質同定や定量精度に疑陽性の結果をもたらす。LCMS装置側の対応策として、Vanquish Neo(Thermo社)には溶出溶媒と平衡化溶媒を交互に送液するゼブラウオッシュ機能がある。分析の運用面においては、糖ペプチド試料の分析の間に、試料を含まないブランクの分析を行うことがある。
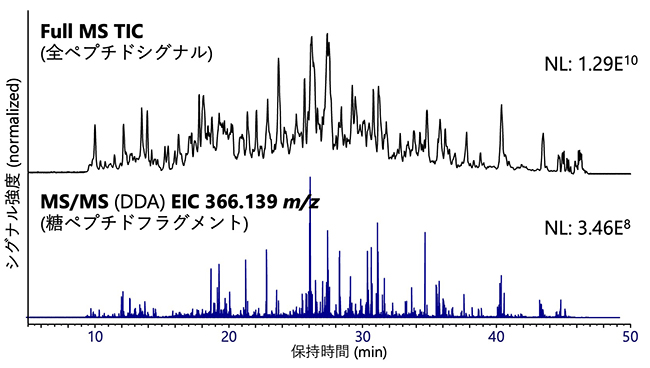
血漿(10μl)からアルブミンー免疫グロブリン除去カラムにより処理後、SP3法により得た糖ペプチドの分析結果を示す(図 4)。MS/MSにより脱離したラクトサミン由来のフラグメントイオン(m/z 366.139)の抽出クロマトグラムに示されるように、糖ペプチドが高純度に回収できている。本実験系により糖ペプチドの同定数 2037個(そのうちシアリル化糖ペプチドは 1735個)、糖鎖修飾サイト 497 個、糖タンパク質 173 個が同定されている。
質量分析計を用いる自動分析システムは、試料調製が簡便なメタボロミクスや、薬剤の血中濃度測定などから使用されつつある。実際は、血液試料に有機溶媒を添加、遠心分離した上清をLCMSにより測定する。
一方、プロテオミクスの自動化で用いられるリキッドハンドラーは、液体分注や攪拌、磁性ビーズの集磁・回収、温調機能、バーコードリーダーなどを搭載している1。その1回の処理能力は多様で、ピペティングの分注量も0.5μl~数mLまで広く対応している。また分注機の大きさによってはデッキに置けるマイクロプレートの数が異なり、作業内容は異なる1。
HGAにおける20万検体の大規模コホート解析では、こういった試料調製を途切れることなくシームレスに全自動で行うことが必須になるので、市販のリキッドハンドラーでは不十分であると考えられている。全自動装置の開発には、図 5に示すような遠心機やフリーザーなどの新しいパーツを開発することも必要である。特に、前処理装置では少なからずエラーが発生するため、各検体の一連の流れを追跡することが必要である。さらに溶血など血液検体の品質は、分注の精度や前処理に影響を及ぼす。したがって、LCMS測定結果に基づいた追跡が必要であり、大規模解析には、前処理と分析結果を一元管理する統合管理システムも必要である。

現在、アメリカやクロアチアでは、HGAと並んでヒューマングライコームプロジェクト(HGP)が進んでおり、LCMSやリキッドハンドラーなどの自動化装置も用いられている。HGPでは免疫グロブリンや高含量糖タンパク質を対象にした標的グライコプロテオミクスが大規模に解析されている(The Human Glycome Project (human-glycome.org))。一方、HGAの特長の一つは、全糖鎖ペプチドのカタログ作りであり、創出される情報量は、他のプロジェクトを凌ぐものと期待されている。この開発には日本が有する分析機器やロボット技術を結集し、産官学が一丸となって挑む時が到来したと筆者は考えている。