
氏名:早下 隆士
上智大学理工学部客員教授
1985年九州大学大学院工学研究科博士課程修了、工学博士。1985年神奈川大学工学部助手、1989年米国テキサス工科大学博士研究員、1991年佐賀大学理工学部助教授、1997年東北大学大学院理学研究科助教授、2005年上智大学理工学部教授、2010年上智大学理工学部長・研究科委員長、2014年上智大学第15代学長。2014年日本カトリック大学連盟会長、2020年シクロデキストリン学会会長、日本イオン交換学会会長、ホスト-ゲスト・超分子化学研究会会長、2021年日本分析化学会会長。
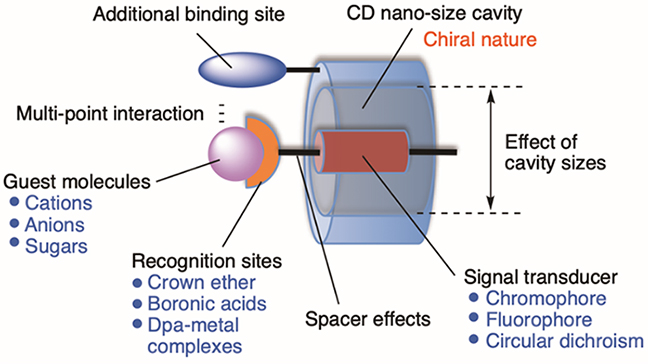
非共有結合相互作用で結びつけられた超分子は、環境の変化に応答して再配列し、複合体としての機能を変化させることができる1。これまでに我々は、これら超分子が示す動的分子認識機能に着目した超分子分析試薬の開発を進めてきた。特に水溶性の環状オリゴ糖であるシクロデキストリン(CDs: 6量体をα-CD、7量体をβ-CD、8量体をγ-CDと呼ぶ)の包接能を使って、分子認識プローブのCD空洞内での組織構造変化に基づく金属イオン認識、リン酸誘導体認識、糖認識や、天然物由来のCD空洞のキラリティーに着目した超分子キラリティーの発現に基づく分子認識系を開発した(図 1)2,3。またカチオン性両親媒性化合物を乳化剤に用いることで、CD配向の揃った球状の超微細ナノゲルの開発に成功し、その優れた包接機能を明らかにしている4,5。本稿では、CDを用いるこれら超分子分析試薬の開発について解説する。
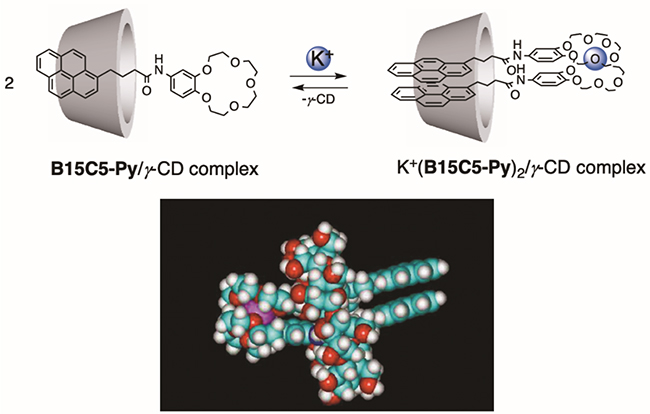
アルカリ金属イオンを認識する分析試薬として、1977年に高木らはクラウンエーテル型の比色試薬を世界に先駆けて報告している6。しかしながらアルカリ金属イオンとクラウンエーテルの相互作用は水中では小さいために、この比色応答はクロロホルムのような有機溶媒中で行う必要があった。我々は、CDが疎水性化合物を水中に溶かす機能があることに着目し、クラウンエーテル型蛍光プローブB15C5-Pyとγ-CDの複合体を用いた水中でのアルカリ金属イオンの優れた応答機能を明らかにしている7。ベンゾ15-クラウン-5-エーテルがK+イオンとサンドイッチ型の錯体を形成することから、水中であるにもかかわらず最も大きな空洞を有するγ-CDを用いると、空洞内に蛍光プローブが二分子で入り込み、蛍光団であるピレンの二量体発光がK+イオン選択的に起こることを報告した(図 2)8 。同様にポダンド型の認識サイトを有する蛍光プローブでは、Pb2+イオンに選択的は二量体発光が起こる9。このようにγ-CDの空洞は、ナノサイズの分子フラスコのように機能し、空洞内での金属イオンに依存した二量体形成が、新しい超分子分析試薬の設計に極めて有功であることを明らかにしている。
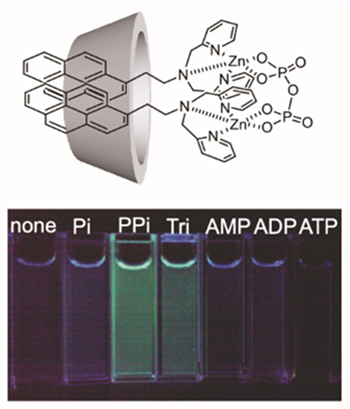
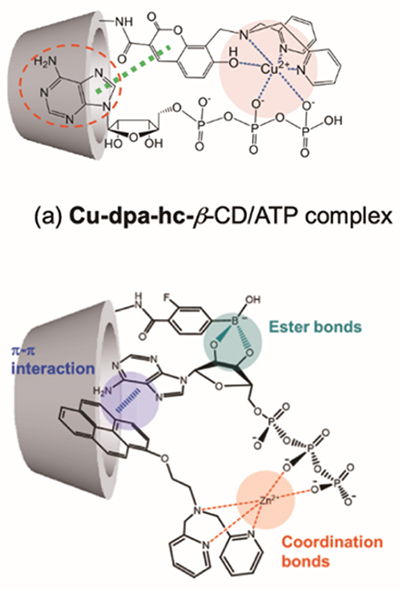
分子認識サイトをクラウンエーテルからジピコリルアミン(dpa)の金属錯体に変えた蛍光プローブでは、リン酸誘導体に応答してγ-CD内で二量体発光を示す。アデノシントリリン酸(ATP)には応答しないが、ピロリン酸イオンやトリリン酸イオンに応答し、二量体発光により蛍光色も変化する(図 3)9。しかしながら無機リン酸イオンではなく、ATPのような生理活性の高いイオンを識別するには分子設計に工夫が必要である。我々は、dpa-Cu2+錯体をβ-CDの2級水酸基側に化学修飾したCu-dpa-hc-β-CDでは、β-CDの空洞にATPのアデニン部位を認識させたATP選択的な蛍光試薬の開発に成功している(図 4a)10。得られたATPとの結合定数は、3.3x103 M-1であった。一方、3位にフッ素基を有するフェニルボロン酸(3-FPB)をγ-CDの2級水酸基側に化学修飾した修飾CD (3-FPB-γ-CDと、様々なスペーサー長のZn-dpa-OCnPyプローブと組み合わせた複合体では、Zn-dpa-OC2Py/3-FPB-γ-CD複合体が優れたATP選択性を示し、結合定数は6.2x106 M-1とCu-dpa-azo-γ-CDに比べ1000倍近く結合力が増加することを明らかにしている(図 4b)11。興味深いことにスペーサー長を長くしたZn-dpa-OC6Py/3-FPB-γ-CD複合体ではATP選択性は全く見られなくなる。これはCD複合体のATPに対する多点認識に基づく空間配置が選択的な結合能を高めるために重要な役割を果たしていることを示している。超分子複合体にしか見られない特徴と言えるだろう。
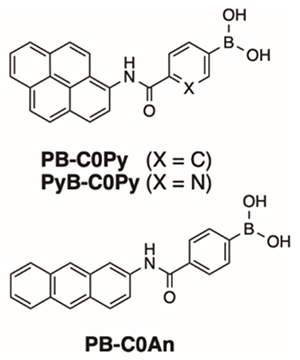
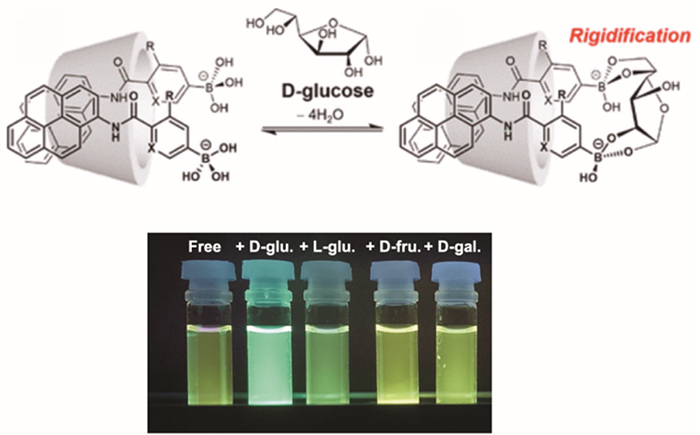
フェニルボロン酸は水中で糖のシスジオール部位と安定なエステルを形成することが知られている。単糖類の中では、フルクトースに高い選択性を示すが、グルコースは分子内の2ヶ所でフェニルボロン酸とエステル結合できるために、フェニルボロン酸の適切な配置によりグルコース選択性を得ることができる12。我々は単純な骨格のフェニルボロン酸型アゾプローブBA-Azo-Phがγ-CDの空洞内で、グルコースと選択的な二量体を形成することを見出している(図 5)13。フェニルボロン酸型蛍光プローブ(図 6)では、ピレン蛍光団とフェニルボロン酸を直接アミド結合で繋いだプローブ分子PB-C0Pyが、γ-CDの空洞内でグルコースを認識して二量体を形成し、グルコース選択的な二量体発光を示す。興味深いことに、蛍光団をピレンからよりスリムな骨格のアントラセンに代えたPB-C0An(図 6)では、グルコース選択性からガラクトース選択性に変化する14。この結果は、2分子の蛍光プローブのγ-CD空洞内の空間配置が選択性に影響を与えることを示している。アントラセン型プローブでも3-FPBを化学修飾した3-FPB-β-CDの複合体では、CD側のフェニルボロン酸とボロン酸型蛍光プローブの間での2点認識となり、2量体と同様のグルコース選択性を得ることができる15。フェニルボロン酸に導入したフッ素基は電子求引性であり、フェニルボロン酸のpKaを減少させ、生理条件下(中性pH)でのグルコース認識を可能とする。同様の目的でピリジルボロン酸を用いた蛍光プローブC0-APyBも設計しているが、興味深いことにC0-APyB/γ-CD複合体は、鏡像異性体であるD-グルコースとL-グルコースを識別出来ることを明らかにした。これはCD空洞のキラル環境に基づくキラル識別機能である。剛直なピレン型プローブが2分子入ることにより、非常に高いキラル識別機能を実現している (図 7) 16。円偏光発光(CPL)材料としても、期待できる新機能と言える。

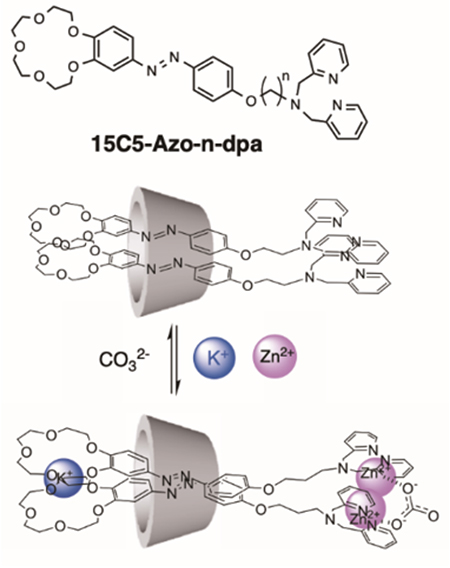
前節で述べたように、天然のCDは、水に溶けて、その空洞の中に分子を包接するキラルな疎水場を提供する。我々は2カ所の分子認識部位を有するジトピック型アゾブローブ15C5-Azo-n-dpaと、このプローブ2分子を水中で包接できるγ-CDの超分子複合体が、複数のゲスト分子やイオンが存在するときのみ、特異な超分子キラリティーを示すことを報告している(図 8)17。この超分子複合体は、クラウンエーテル部位とサンドイッチ錯体を形成するK+イオン、もう一方のジピコリルアミン(dpa)と錯体を形成するZn2+イオン、そして2カ所のdpa-Zn2+錯体を架橋するCO32-イオンが存在するときのみ、γ-CD空洞内で2つの分子プローブが時計回りのねじれ構造を誘起し、応答機能を示す。従って、この超分子複合体からねじれ構造を誘起する構成要素の1つ取り除くと、取り除かれた要素イオンに対して選択的に応答し、アゾ部位のねじれ構造に基づく円二色性スペクトル変化や紫外・可視吸収スペクトル変化を示す。さらに興味深いことに、アルキルスペーサーをエチレン鎖(n = 2)からブチレン鎖(n = 4)に変えると、金属イオンに対する応答選択性が、Zn2+イオンからCu2+イオンへ劇的に変化する18。いずれも同じ分子認識サイトをもつジトピック型プローブであるが、その応答選択性がスペーサー長のみで変化する系は、これまでの分子認識反応では知られていない。これらの結果も、γ-CDのナノ空間包接場における複数のゲストイオン認識に基づく空間配置の重要性を示す、超分子複合体のユニークな特徴と言えるだろう。
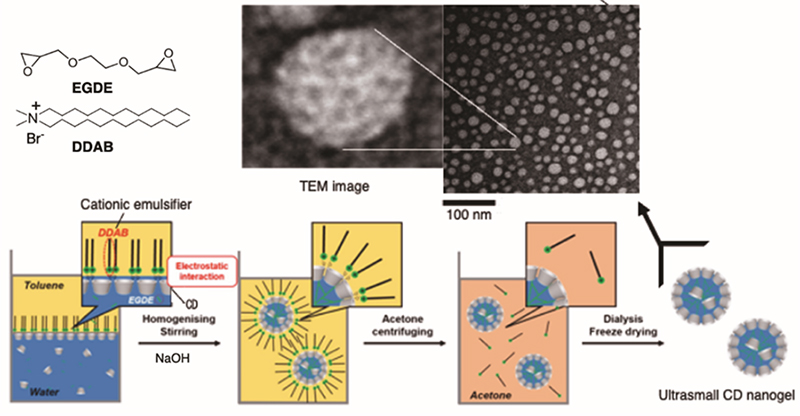
CDは分子内に複数の一級や二級水酸基を有するため、エチレングリコールジグリシジルエーテル(EGDE)などの架橋剤とアルカリ条件下で反応させることにより、水に不溶なCDゲルを得ることができる。我々は糖と結合して発光するナフタレンボロン酸型蛍光プローブをこのCDゲルに包接させることで、微量のフルクトースをCDゲル内に濃縮して蛍光応答を示すCDゲル型センサーや19、分子鋳型に基づくグルコースに選択的なCDゲル吸着剤の開発に成功している20。しかしCDの魅力は、水に不溶のプローブや薬物を水に溶かし活性化する点にある。そこで我々は、カチオン性の臭化ジラウリルジメチルアンモニウム(DDAB)を乳化剤とするナノサイズの乳化液滴中でのCDのゲル化法を考案した。DDABからなるトルエン中の乳化水滴の界面は正に帯電しており、NaOHを用いたアルカリ条件下でのEGDEとの反応では、CDの広口側の二級水酸基(pKa = 12.1)が解離してDDAB界面に配向した状態でゲル化を行うことができる。このためCDの二級水酸基側が外側に配向した5 nm程度の均一な球状の超微細ナノゲルの開発に成功した(図 9)4。Langmuir型の結合解析から、モノマーのCDに比較して超微細CDナノゲルは非常に優れた包接機能を有することも明らかとなった4。今後、生体内の薬物輸送や生体イメージングなど様々な分野での活用が期待される5,21。
全く新しい分析試薬を開発するためには,従来の合成化学的アプローチとは異なる新しい方法論が必要である。この方法論として、我々はCDのナノ空間包接場を用いる超分子分析試薬の設計を考案した。非共有結合相互作用で結びつけられた超分子は、環境の変化に応答して再配列し、複合体としての機能を変化させることができる。本稿で紹介した様々なCD複合体や超微細CDナノゲルとの組み合わせに基づくナノ空間での多彩な分子認識機能の発現は、超分子分析試薬のユニークな特徴と言えるだろう。
東北大学でご指導頂いた寺前紀夫名誉教授(東北大学),共同研究者の西澤精一博士(現 東北大学教授),山内晶代博士(現 奈良県立医科大学助教),そして上智大学で一緒に研究を支えてくれた遠藤 明准教授(平成30年12 月にご逝去),橋本 剛教授,博士研究員として実験指導してくれた土戸優志博士(現 早稲田大学講師),藤原章司博士(現 神奈川大学助教),および鈴木陽太博士(現 埼玉大学助教)、そして直接に実験を担当してくれた物質生命理工学科分析化学研究グループの200名近い卒業生の成果であり,紙面をお借りして感謝を伝えます。なお本研究の遂行にあたり,日本学術振興会科学研究費・基盤研究(A) (26248038),基盤研究(B) (20H02772; 22350039; 18350043),基盤(C) (16550066),挑戦的萌芽研究(24655069; 21655030) から代表として研究助成金を支援頂いたことにも感謝申し上げたい。