
氏名:天野 良彦
信州大学 工学部 教授
信州大学大学院工学系研究科博士後期課程生物機能工学専攻修了 博士(工学)
長野県農村工業研究所研究員を経て、1995年より信州大学工学部助手、助教授を経て現在に至る。この間、信州大学地域共同研究センター長、評議員、学部長、副学長を歴任。
また、テキサス大学オースチン校及びカルフォルニア大学デービス校に博士研究員として1.5年ほど滞在。

氏名:水野 正浩
信州大学 工学部 准教授
東京農工大学大学院連合農学研究科生物工学専攻修了 博士(農学)
日本学術振興会特別研究員を経て、2006年より信州大学工学部助教、2017年より現職。
セルロースは地球上で最も多く再生産される天然の高分子であり、近年再生可能な資源として注目されている。セルロースの多くは植物由来で、パルプ製造から種々の材料として利用されている。しかしその生合成のメカニズムは、未解明の部分も多く、生物起源による違いも顕著である。それらを人為的にコントロールできるようになれば、応用面もさらに広がることが期待される。そこで我々は、酢酸菌を用いたセルロース合成の機構に関する研究と、その生産物を使った応用研究を展開してきているので、その一端を紹介する。
セルロースは地球上で最も多量に生産される有機高分子といわれるが、これは陸上植物の植物細胞壁の主要成分として、光合成により生産されるためである。一方で、細菌の中にもセルロースを生産し、巧みに利用しているものがいる。こうした細菌が生産するセルロースは、植物由来のセルロースと区別してバクテリアセルロース(BC)と呼ばれる。
1886年にA. J. Brownにより酢酸菌 Acetobacter xylinusの培養液中にセルロースが含まれることが報告されて以降1、細菌によるセルロースの生合成に関する研究は、A. xylinum(現在はKomagataeibacter xylinusと表記されるが、本稿では長年使用されてきたGluconacetobacter xylinusとして記載する)を中心に進められてきた。その大きな理由の一つとして、G. xylinusのセルロース生産量は非常に高く、実際に得られたセルロースの構造を詳細に解析できたという点が挙げられる。その後、分子生物学的手法によるセルロース生合成に関与する遺伝子群の解析が進んだ際に、実際のセルロースの構造情報との相関関係から様々なセルロース生合成に関するモデルが報告されることになった。一方、ゲノム解析技術の進歩により、今日では迅速かつ容易にゲノムDNAの解析が可能になった。その結果、実際のセルロース生産の有無や量に関係なく、多くの細菌のゲノムDNA中にセルロース合成酵素に相同性を有する蛋白質をコードする遺伝子が見出されている。
真正細菌は細胞壁の構造の違いに基づくグラム染色により、グラム陽性菌とグラム陰性菌の2種類に大別される。ペプチドグリカン層が発達した細胞壁を有するグラム陽性菌では、細菌によるセルロース生合成が本格的に開始された1960年代にSarcina ventriculiにおいて報告されて以降、ほとんど報告例がなかったが、2013年に放線菌の一種であるRhodococcus sp. MI 2において報告された2。一方、ペプチドグリカン層の薄いグラム陰性細菌におけるセルロース生産菌は、シアノバクテリア門及びプロテオバクテリア門の2群に分布する。シアノバクテリア門はいわゆる藍藻類であり、光合成による酸素生産を行う菌類である。シアノバクテリアは非常に多様な細胞外多糖(EPS)を生産することが知られており、乾燥や紫外線等からの防御、付着等の運動性の制御のためにそうしたEPSを生産すると考えられている。これらのEPS中にセルロースが含まれることは古くより示唆されてきたが、2001年にNoblesらが電子顕微鏡や機器分析を用いてセルロースの存在を明確にした3。
プロテオバクテリア門は、真正細菌の巨大な分類群であると同時に、現在までに報告されているセルロース生産菌のほとんどを含む。プロテオバクテリアは更に6綱に細分化されるが、セルロース生産菌はその内のアルファ、ベータ、ガンマプロテオバクテリアに分布する。アルファプロテオバクテリア綱には、酢酸菌科が含まれており、光合成細菌であるRhodobacter sphaeroidesでは、セルロース合成酵素(BcsA)及びセルロース合成関連蛋白質 BcsBの複合体構造がX線結晶構造解析によって明らかにされている4。また、近年、ガンマプロテオバクテリアに分布するエンテロバクターの仲間から、多くのセルロース生産菌に関する報告がなされている。エンテロバクター目に分類される細菌の多くは、セルロースを単体で生産するのではなく、バイオフィルム形成を行う際にEPS中の一成分としてセルロース生産を行うものが多い。
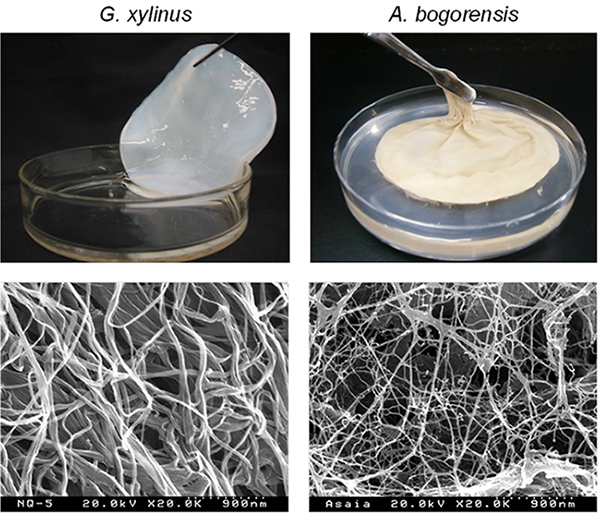
当研究室でG. xylinus以外のセルロース生産を行う微生物の探索を行った結果、周毛性の鞭毛を有する好気性のグラム陰性桿菌であるAsaia bogorensisが、培養液の気液界面にセルロースを含む膜(ペリクル)を生産することを見出した5。G. xylinusはしっかりとしたマット状のペリクルを形成するが、A. bogorensisは柔らかくもろい薄いペリクルを形成する(図 1上)。A. bogorensisのセルロースの生産量はG. xylinusと比較すると低く、また、不純物を多く含むため、通常のアルカリ洗浄だけでは、ナタデココのような白い半透明な状態にはなり難い特徴がある。ペリクルを精製した後に電子顕微鏡によりセルロース繊維の微細構造を見てみると、A. bogorensisが生産するセルロースは、G. xylinusのものと比較して、より細い繊維となっており、繊維幅は約5 nm程度であった(図 1下)。このペリクルの主体がセルロースであることは、セルラーゼを作用させると分解生成物としてセロビオースが得られることからも確認している。また、乾燥物のFT-IR及び13C-NMRのスペクトルからも、G. xylinusが生産するセルロースと同様の波形であることが示されている。
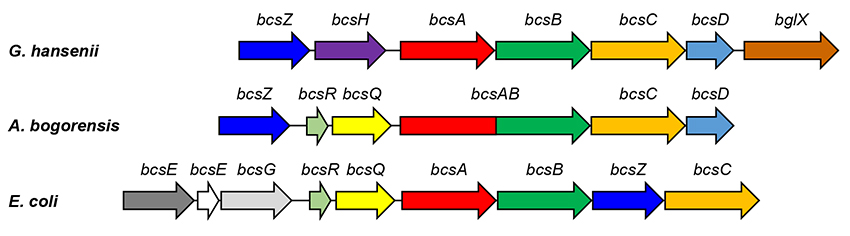
次に、A. bogorensisのセルロース合成に関わる遺伝子の解析を行った結果、ゲノムDNA中に1セットのセルロース生合成オペロン(bacterial cellulose synthase operon)を有していることが明らかとなった。近年多くの微生物からbcsオペロンが見出されているが、A. bogorensisの場合ではG. xylinusと非常に似ている一方、大腸菌等との共通性も見出されている(図 2)。セルロース合成量を見ても、A. bogorensisはG. xylinusよりも低いものの、ペルクルから分離・分析する程度の量を得ることが可能であり、E. coliなどの生産量よりは高い。このように、A. bogorensisはBC生産量が高いG. xylinusとBC生産量が僅かであるその他の微生物との中間的な性質を有していると考えられ、セルロース生合成のメカニズムを解明していく上で、非常に興味深い微生物種である。
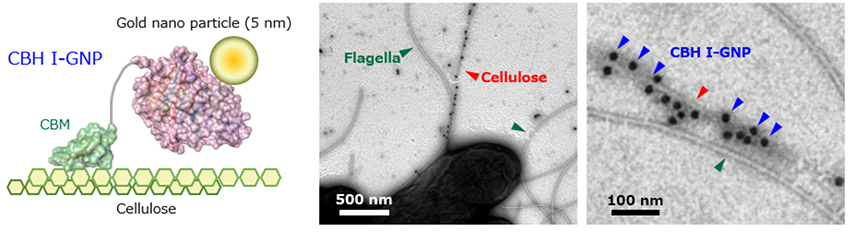
A. bogorensisのセルロース繊維の細さの理由については、現時点では明らかとなっていない。図 1で示したSEMは、得られたペリクル中のセルロース繊維であるため、菌体から分泌された直後のセルロース繊維の形態を明らかにするために、TEMによる観察を行った(図 3)。この際、A. bogorensisは周毛性の鞭毛を有するため、セルロースに特異的に吸着するセルロース結合モジュール(CBM)をもつセロビオヒドロラーゼ(CBH I)を金ナノ粒子(GNP)で標識したCBH I-GNPを用いた。その結果、CBH I-GNPが特異的に吸着した繊維が確認され、鞭毛とセルロース繊維とを明確に区別することに成功した。また、A. bogorensisのセルロース繊維はG. xylinusのセルロース繊維と比べると菌体から排出された時点で既に繊維幅が約5–20 nm程度と非常に細いことが明らかとなった。
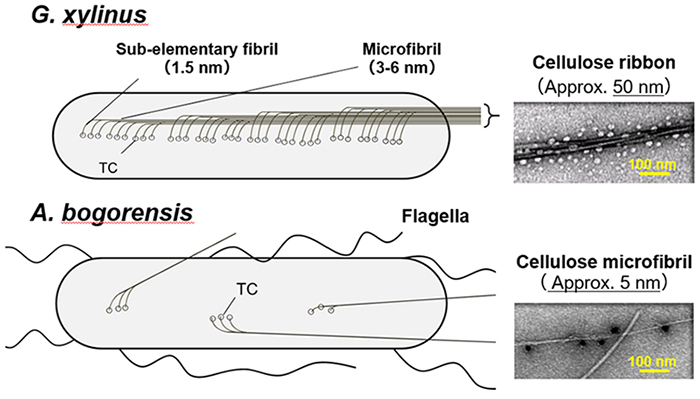
生物によって生産されるセルロース繊維の形状は、細胞膜上に局在するセルロース合成酵素複合体(ターミナルコンプレックス:TC)の配置と関連することが明らかとなっている。G. xylinusのTCの配列についてはInder Saxenaらが、フリーズフラクチャー法を用いて、菌体の内膜上に一列に配置していることを報告している(図 4)6。これらのことを踏まえ、我々はTCが菌体の内膜上に並ぶ配置のされ方が異なるのではないかと予想している。A. bogorensisから生産されるセルロースファイバーの細さを考えると、TCが数個くらい並んだレベルであり、それゆえにサブエレメンタリーフィブリルが数個集合したナノファイバーとなっているものと考えている。その模式図については、図 4に示した
植物由来のセルロースは、植物細胞壁の一成分として生産されるため、機械的・化学的な手法によって他の成分を分解し、高次構造を崩しながらパルプとして取り出される。一方、BCはナノレベルのセルロースとして生産され、菌体の動きに応じてセルロース繊維同士が網目状に絡まり合った大きな構造体を形成する。つまり、セルロースを生産する細菌の動きを制御することで、立体的なセルロース整形物を作ることが可能となる。純粋なセルロースのみからなる点や3次元網目構造を有する等の利点を、設計した形に自在に製造できる点に応用し、様々な機能性セルロース材料が世界中で報告されている。もっとも簡単な手法としては、回転培養を行うことで球状や花弁状のセルロースを得ることが可能である。本稿では、チューブ状BCの生産について紹介したい。
先にも述べたように、酢酸菌は気液界面にセルロースを生産する。そこで、通気性は確保しつつ液体を透過させない多孔性テフロンチューブを培養容器として用いることを着想した。新鮮な培地に酢酸菌を懸濁させた培養液をテフロンチューブ内に密閉し、湿度を高めた容器内で静置培養を行うと、テフロンチューブの内壁に沿う形でBCチューブが生産された(図 5)。
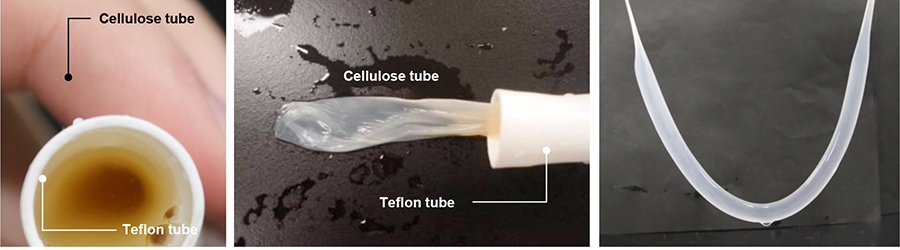
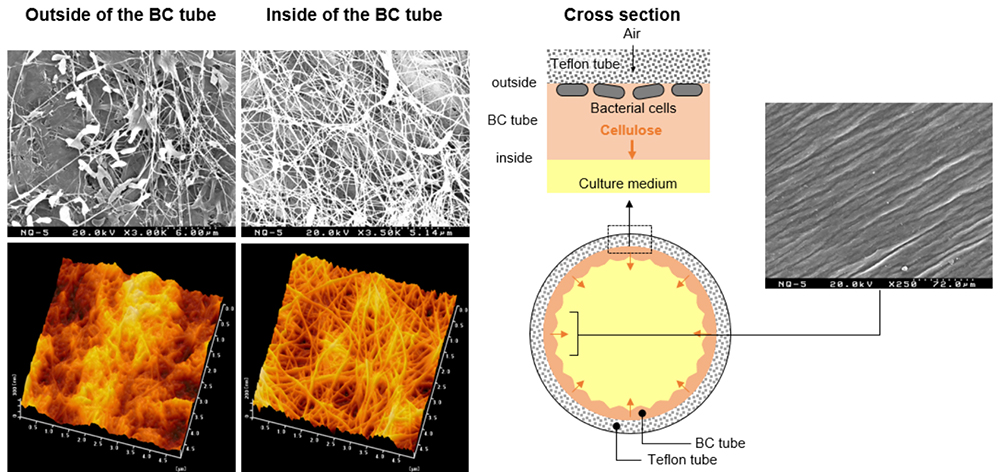
本手法で得られたBCチューブの表面構造を分析すると、BCチューブの内面と外面で異なることが明らかとなった(図 6)。BCチューブの内面ではセルロース繊維がきれいな網目構造を形成しており、菌体もまばらにしか存在していない。一方、BCチューブの外面では、セルロース繊維の網目構造は一部でしか見られず、網目の穴がつぶれたような構造になっている。セルロースを合成する酢酸菌は水ともなじみ易い一方で、やや疎水性の表面にも良く吸着する。テフロンチューブの通気性に加え、疎水性表面が酢酸菌の足場としても作用し、チューブの壁面に菌体が固定化された状態でセルロースが生産されると考えられる。その結果、セルロース生産が進むにつれてテフロンチューブとセルロースとの間で酢酸菌の動きが抑制され、きれいな編目構造の形成が進まなくなると考えられる。また、低倍率でBCチューブの内面像を観察すると、ひだ状の筋が観察された。これは、菌体はBCチューブの外面に多く局在するため、最初に形成された膜は内側に押し出され、半径が小さくなるため、しわが寄るものと考察される。このように、本手法で得られるBCチューブは、内外面の構造が異なり、それぞれに異なった性質を有するユニークな構造である。
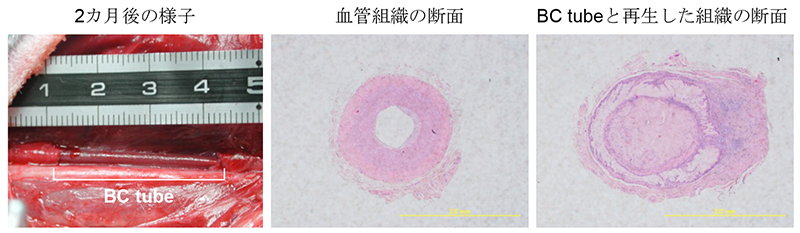
次に、得られたBCチューブの応用例として、人工血管への応用を考えた。海外では、Klemmらが別の方法で人工血管代替としてのBCチューブを作製している7。その報告では、厚い膜のBCチューブが作製されているが、今回の作製法とは全く異なっているが、人工血管としての可能性について報告されている。我々の研究では、京都大学医学部耳鼻咽喉科の金丸医師の協力を得て、動物実験を行った。ビーグル犬の頸動脈をBCチューブで置換して、2ヶ月後に切開した状態が図 7左の状態である。内径 6 mmのテフロンチューブを用いて作製したBCチューブ(約5 cm)を用いて、血管の一部を代替し、その後2ヶ月間普通に飼育した。血管中には血栓ができることなく、その機能を果たすことができた。その後、通常の血管組織と、埋め込んだBCチューブの横断面の組織像を観察した(図 7 中央及び右)。通常の血管組織は厚い組織であるが、BCチューブはそれよりは膜の厚さは少ないが強度としては十分にあると考えられた。作成したBCチューブを用いてより糸を作り、この引っ張り強度試験を行ったところ、ナイロン66の繊維に比べて、2–3倍の強度を有していた。この点からも血管組織としての強度的には特に問題はないと考えられた。また、BCチューブの表面には、血管組織の再生があるようにもみえ、動物細胞の再生の足場としても、有用であるかもしれない。実際に、信州大学繊維学部の阿部教授の協力を得て行った骨芽細胞の再生の実験では、BC表面での骨芽細胞の増殖は良好であり、カルシウムの沈着が対照区として用いた親水性シャーレを用いた培養よりも、早く分化が起こっていることが示唆された。以上のことから、ナノセルロースでできたセルロース素材については、動物細胞との親和性が高いことが考えられた。海外では、創傷の被覆材として、皮膚の再生が促進されるという報告8もあり、医療分野での利用は注目されている。しかしながら、医療分野での応用は認可のハードルが高いため、さらなる検討が必要と思われる。
BCの応用に関しては、BCの特徴である高強度、親水性、生体親和性等の機能性を活かした様々な報告がある。静置培養によって得られるペリクルと呼ばれるゲル状の膜については、ナタデココのように食用にも利用されているし、創傷被覆材などとしても利用されている。前項で紹介したBCチューブは、ペリクル利用の応用例として捉えることも可能である。一方で、ペリクルを解繊して使用することもあるが、この解繊には特殊な装置やエネルギーを必要とすることが多い。我々は、キシログルカンを主成分とするタマリンドシードガムをBCペリクルと混合し、家庭用のミキサーで処理すると、ナノサイズのファイバーを含む解繊スラリーが容易に得られることを発見した9。また、このスラリーは、プラスチックなどの疎水性基板に対して吸着性を示し、疎水表面を親水化できることを見出した。BC繊維の微細化に関する詳細なメカニズムについてはまだ検討が必要であるが、解繊したBCの新たな活用方法として期待される。
また、BCの表面改質に関しては、セルロースのヒドロキシ基に種々の官能基を導入して行うことも検討されている。我々は、セルロースの6位のヒドロキシ基をカルボニル化したTEMPO酸化セルロースに対して、アミド結合によりオリゴDNA分子を導入することに成功した10。導入したオリゴDNA分子は、相補配列を有するオリゴDNA分子と温度依存的に相補・解離することを確認した。ただし、二重鎖の形成及び開裂に関する温度依存性は、溶液中に溶解した遊離状態のDNA分子とは異なる挙動となった。セルロースは、セルロースの分子やミクロフィブリル単位でも会合するため、今回の複合体は種々の条件下で、高次構造形成と分子の分散状態を制御できることに興味がもたれる。
以上のように、BCはその特異な特性ゆえに、様々な用途に使用されるポテンシャルを持っていると考えられる。しかしながら現在利用されているのは比較的付加価値が高い領域に限られている。今後は大量生産によりコストを下げることにより、様々な分野での応用が期待される。
本研究を遂行するために、多くの卒業生に関わって頂いた。また外部との連携も行っており、関係各位には感謝申し上げたい。特に今回取り上げた生体への応用に関しては、当時京都大学医学部に所属されていた金丸先生に深く感謝を申し上げたい。