
佐藤 祥子
ラヴァル大学医学部・医学部付属研究所、薬学博士
千葉大学薬学部卒業。1987年より東京大学医科学研究所大学院で木幡教授の指導を受ける。その間ロンドンの国立医学研究所にてR. Colin Hughes博士の下でガレクチン-3の研究を行う。1994年東京大学博士号取得。ついでスタンフォード大学のDr. Ron Kopito研究室でポスドク研究員として、遺伝性嚢胞性線維症への化学療法に関する研究を行った。1999年よりカナダ・ラヴァル大学医学部感染症研究センター糖質生物学研究室主任研究員、ラヴァル大学医学部准教授。2010年同大学同部教授。2003年以降同部門Bioimaging platformの長兼任。
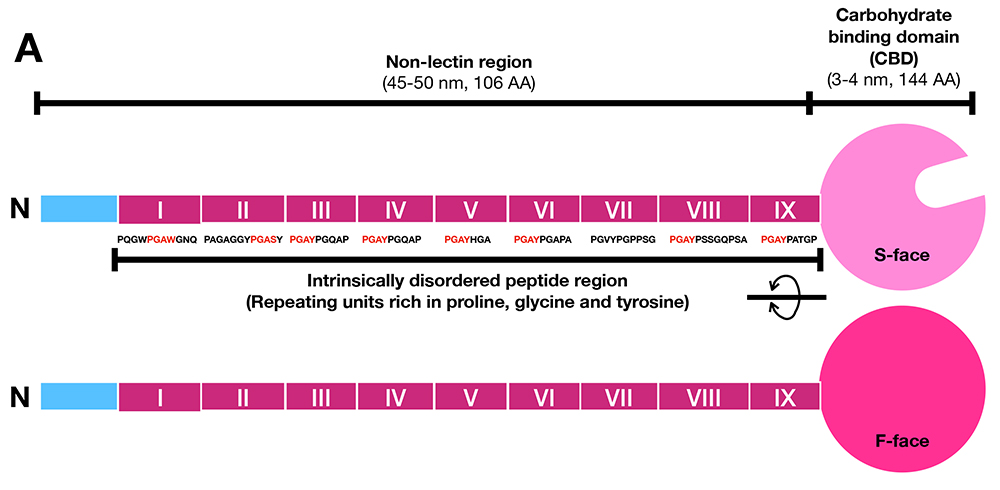
ガレクチン-3はガレクチン家系において、ガレクチン-1と共に最も研究されているガレクチンである。ガレクチン-3がin vitroでは、細胞内および細胞外で、そしてin vivoにおいてはさまざまな器官の機能に関与していることが報告されており、その範囲は多岐に及ぶ。前編で述べた様に、ガレクチン-3はそのN末端に、他の動物レクチンには見られないペプチドの繰り返し構造が続く「天然変性領域」注1)を含む領域を含み、そのペプチド長はC末端のレクチンドメイン(Carbohydrate-binding domain: CBD)とほぼ同じである(図 3)1,2。報告されているガレクチン-3の活性の多くはこの天然変性領域に依存している。また、通常は単量体で存在するガレクチン-3は糖鎖リガンドと結合したのちに、天然変性領域に依存して多量体化する。従って、ガレクチン-3の活性のほとんどは、天然変性領域が仲介する多量体形成によって調節されていると考えられている。では、他のレクチンに見られないこのユニークな天然変性領域がどのようにガレクチン-3の多量体化に関与しているかについて、後編では最近の知見を取り入れながら、さらに掘り下げ、そこから多量体化とガレクチン-3の多岐にわたる機能との関係について探っていきたい。
注1)ガレクチン-3特異的なN末端領域は通常N末端非レクチンドメインと呼ぶが、元来、ドメインという名称は二次ないし三次構造を形成したポリペプチドについて用いるべきであるので、本稿では、前編と同様に、この部分をあえてドメインでなく、非レクチン領域(Non-lectin region)と呼ぶ。また、その領域内の特に繰り返し配列部分を天然変性領域(N-terminal intrinsically disordered peptide region)と呼ぶ
特記すべきことは、糖鎖に結合したガレチン-3が、このN末端の天然変性領域に依存した多量体化を介して、液―液相分離(Liquid-liquid phase separation、以下LLPS)現象に関与しているとする報告が増えてきていることだ3–7。膜のないオルガネラLLPSについては前編で説明したが、LLPSのおきた空間は、様々な生命現象が効率よく起きたり制御されたりする可逆的な凝縮空間である。この空間の形成にガレクチン-3が関与しているということは、以下の点と密接に関係する:(1)ガレクチン-3の活性が非常に多岐多様であること。(2)細胞膜に形成されるガレクチン-3ラティスがさまざまな生体反応(例えばシグナル伝達やクラスリン非依存的エンドサイトーシス)を動態的に制御していること。さらに、(3)活性を誘導するために必要なガレクチン-3のリガンドの多くは特定できないこと(一つに絞ることができないため、曖昧であり詳細な解明が困難)。
本フォーラムでは、まず、他の系で既に明らかにされているLLPSと、今まで示唆・提唱されたガレクチン-3の細胞膜上での挙動の類似性を考察したい。次に最近報告されたガレクチン-3とLLPSの論文について紹介し、さらに、フォーラムである特徴を生かして、LLPSの観点からガレクチン-3の活性の考察を深め想像を膨らませていきたい。また、ガレクチン-3のCBDが他のガレクチンのCBDと相互作用する報告があることから、今後発展する(または発展が予想される)、ガレクチン-3によるLLPS形成を中心にしたガレクチンネットワークの可能性についても考えを巡らしてみたい。前編と同様に、本稿を執筆するにあたり、LLPSを中心に論文をたぐっている。とはいえ、30年以上の歴史があるガレクチン-3の天然変性領域や多量体化について全ての論文を網羅できていないことをあらかじめ申し上げておく。
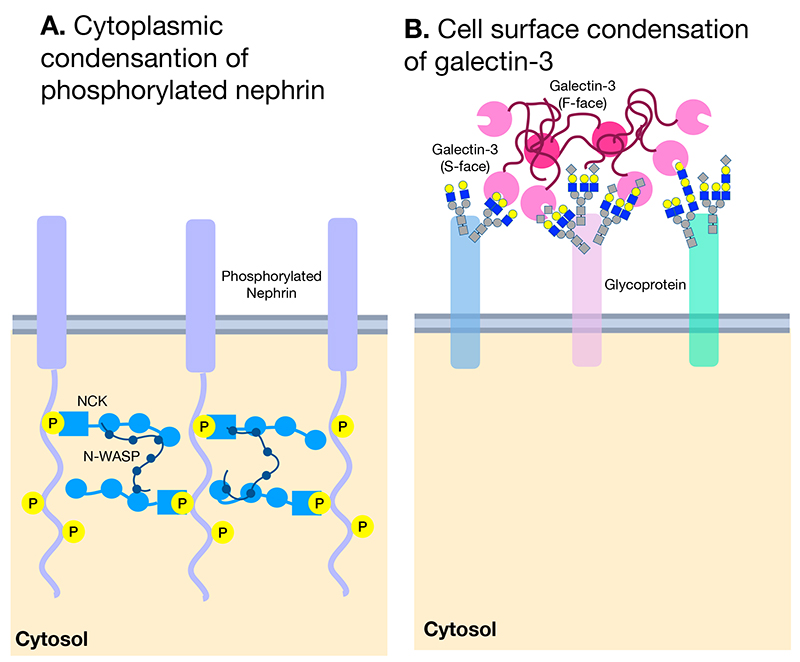
細胞内には、ストレス顆粒や核小胞体などのように、膜がないにもかかわらずRNAやタンパク質が濃縮されている空間がある。近年の研究でこれはLLPSが3次元空間で起きることにより形成されることが明らかになっている。これに対して、細胞膜のような2次元の空間注2)においても、LLPSが起きているのかはつい最近まで明らかでなかった。2014年にMichael Rosenのグループは人工膜上で、リン酸化されたNephrin、その細胞質内結合パートナーであるNck 、そして天然変性領域がその分子内にあるN-WASPを用いて、LLPSが2次元の膜の上でも起きることを示した(図 4A)8。さらに、Arp2/3複合体の存在下において、この三分子のクラスター形成により、膜上に局所的なアクチンフィラメントのアセンブリー化が促進されることも示唆した。
注2)2次元:膜上、例えば細胞膜上の膜タンパク質は蛋白の一部が脂肪膜の中にあるため、その動的移動はXY方向のみ、すなわち2次元方向のみの拡散である。これに対して、可溶性のタンパク質の場合はその動的移動はXYZ方向になので、3次元方向の拡散となる。
ガレクチン-3とLLPSの考察を進めるにおいて、この報告には注目すべき大事な点がいくつか含まれている。第一に、LLPSは上記の三分子の濃度がある一定の濃度に達したとき、突然起こること、第二に、LLPSの起きやすさは、三分子の結合の多価性に依存していること、すなわち、Nephirnのリン酸化が多所にあり、Nckにはこのリン酸化されたNephrinへの結合サイトに加えN-WASPへの結合サイトが複数あり、さらにプロリンが多く含む天然変性領域を持つN-WASPのNckへの結合も多価である(図 4A)こと、第三に、この三分子からなるLLPS・クラスターは非常に可動性があり、中にある分子はクラスターとその周囲との間で交換が行われていること、そして、第四に、最も重要な点として、LLPSに必要な三分子の濃度は2次元(すなわち膜上)の場合、3次元(すなわち溶液の状態)での状態と比較すると30分の1も低い濃度で起こることである5,8,9。
2015年にDennisはこの現象に注目した。すなわち、彼らが2000年以来示唆してきたガレクチンラティス10が、細胞外において起きているLLPSであると提唱した3。図 4AとBのイラストで、Rosenの研究が示唆した細胞質側で起こった膜上のLLPSと、Dennisらが示唆してきた細胞外側で起きる膜上のガレクチンラティスの相似性を比較してみた。彼らの研究から、すでに、ガレクチンラティスは結合した膜タンパク質の側方移動を遅くするが、同時に可動性もあり11,12、そのクラスターとその周囲との間で交換が行われていることも示されている13。さらに、前編で述べた通り、ガレクチン-3は細胞膜糖タンパク質と結合した後に多量体化するので、その結合は多価である。この多量体化に必要なガレクチン-3の領域はプロリンが豊富に含まれる天然変性領域である。この細胞外において、可溶性のガレクチン-3が数カ所で糖タンパク質の糖鎖に結合し、さらに、N末端にあるプロリンが豊富に含まれる天然変性領域により多量体化する。本現象は、Rosenが示唆した細胞膜の細胞質側で数カ所リン酸化されている膜タンパク質がこのリン酸化タンパク質に結合する可溶性のパートナーと天然変性領域を持つタンパク質によりLLPSを起こす現象と非常に相似している。
2017年に台湾のHuangのグループは、2つの濃度(40 µMと400 µM)のガレクチン-3の更なる構造解析をNMRで行った4。糖リガンドがない状態で、ガレクチン-3は40 µMでは、単量体で存在するが、400 µMでは多量体で存在することが再確認された。それぞれの領域、すなわち、N末端天然変性領域およびCBD単独の挙動を調べたところ、N末端にある天然変性領域は単独でも多量体化するのに対し、CBDは単量体のままであることも再確認した。前編で、電子顕微鏡でシャドウイングしたガレクチン-3及びN末端天然変性領域部位のイメージを撮影したHughesのグループの論文14を紹介した。ガレクチン-3は糖鎖に結合しない限り多量体化を起こさないのに対して、N末端天然変性領域のみだと多量体化を起こしているイメージが得られた。このことから、Hughesらは、CBDがN末端天然変性領域部位とリンクすることで、多量体化を阻害するのではと考察していたのだが、まさに、Huangのグループの上記の結果はこの論文の考察14と一致している。40 µMにおいて、以前の研究と同様に、ガレクチン-3の分子サイズが予想されるものより小さいことが再確認され、さらに、分子内において、天然変性領域はCBDのF面(糖と結合する側と反対側)のアミノ酸200−220の領域と結合・解離を速い速度で繰り返し行っていることも確認された。このF面と天然変性領域との相互関係は、この領域の繰り返し構造の数が多ければ多いほど強かった。多量体化が見られる400 µMでも上記と同様な現象が見られるので、多量体は、いくつもの天然変性領域が一つのCBDに対して速い速度で結合・解離していると示唆している。言い換えれば、ここで見られる相互作用は、特定の領域同士が結合する1対1、鍵と鍵穴のような特異的な結合と異なり、ある部位(CBDのF面のアミノ酸200−220)に対して、特定の領域(この場合は繰り返しのある天然変性領域)が1対多で、あたかもスキャンニングするように、速い速度で結合・解離している動的な現象である。このような動的相互作用(ときに曖昧な(Fuzzy)相互作用とも呼ばれる)は、天然変性領域が関与するLLPS内の相互作用でよく見られる現象である(15, 16)。実際にHuangらは、天然変性領域が温度依存的に可逆的なLLPSを起こすことを初めて示した。
これらの結果は、可溶性のガレクチン-3というタンパク質が物理的性質においてLLPSを引き起こすポテンシャルを持つことを示している。この報告で使われた条件は、ガレクチン-3が機能する生理的条件−2次元空間で、数µM以下の濃度で、膜糖タンパク質に結合する条件−とはかなり異なる。すなわち、3次元で(溶液中)非常に高濃度、しかも糖鎖がない状態である。しかしながら、Rosenが示唆したように5、2次元空間でのLLPSを引き起こすタンパク質濃度は3次元に比べて30倍以上低いのであれば、2次元では10 µMあたりまで下がってくる。さらに、ガレクチン-3が膜の上でいくつかの糖タンパク質に結合することで、局所的な濃度は、おそらく10 µM以上になる可能性が高い。LLPS現象は必要なタンパク質濃度がある臨界濃度に達したとき、急速に起こるので8、生理的な条件でガレクチン-3が膜上でLLPS現象を起こしている可能性は非常に高まると考えられる。このような可能性についてさらに追求した最近の2報の論文を見てみよう。
2020年にHuangのグループはlipopolysaccharide(LPS)のミセル存在下で40 µMのガレクチン-3がLLPS現象を起こすが、CBDでは起きないことを示した6。ラクトースでこれらの現象が消失するのでこの現象は可逆的である。天然変性領域のPGxY注3)またはPGxWの配列の繰り返しにあるYおよびW全てをGに変異したガレクチン-3ではLLPS現象が見られず、CBDのF面への相互作用も検出できなかった。従って、天然変性領域内の芳香族残基がLLPSの誘導に関与していることが示唆された。彼らは、ガレクチン-3の分子サイズを考慮した場合、LPSミセル表面上に結合した理論上のガレクチン-3の濃度は15 mMにも及ぶと指摘する。すなわち、ガレクチン-3が膜上の糖鎖に結合することにより、LLPSが誘導され得るガレクチン-3臨界濃度に容易に達することができるだろう。
注3)プロリン(P)、グリシン(G)、チロシン(Y)、トリプトファン(W)
2021年にTaiとZhouのグループは、溶液状態で、ガレクチン-3と膜糖タンパク質CD7, CD45, CD71, CD146注4)がLLPSを誘導するかを調べた7。糖タンパク質の種類によりその度合いは若干異なるが、ガレクチン-3は濃度依存的にLLPSを誘導し、これは結合拮抗剤のラクトース添加により解消された。また、糖鎖結合活性が弱いガレクチン-3変異タンパク質(R186S)や、天然変性領域を短くした(繰り返し構造の9個のうち6個が欠損)ガレクチン-3ではLLPSが起きなかった。また、同じ条件で行っても、ガレクチン-1や2ではLLPSは誘導されなかった。これにより、ガレクチン-3は糖に結合後、天然変性領域に依存してLLPSを起こすことが示唆された。もっとも注目すべき点は、天然変性領域やCBDのみではこれらの糖タンパク質とのLLPSは起こらないが、天然変性領域とCBDが共存するとLLPSが起きる点である。すなわち、これらの2つの領域が必ずしも1分子としてつながっていなくてもよいことを示唆する。一方、Huangらが以前示唆した天然変性領域と相互作用するCBDのF面(アミノ酸200-220 )に変異を入れた(L203A)CBDに天然変性領域を加えた場合はLLPSを起こさない。以上の結果から、ガレクチン-3のLLPS誘導初期にもっとも重要なのは、天然変性領域とCBDのF面の相互作用であることが示唆された。
注4)LLPS誘導を調べる一つの方法として彼らは、タンパク質を混合し、その混合物が白濁するか、その白濁が温度変化や阻害剤で可逆的に消滅するかを調べている。ここでは膜貫通型の糖タンパク質の可溶性の部分―エクトドメイン(細胞外に露出した部分)のみのものを使 用している。
では天然変性領域同士の相互作用はLLPS・多量体形成に貢献するのであろうか?前編で詳しく述べたが、ガレクチン-3は固定された糖タンパク質と結合すると、多量体を形成するため、結合は協調的なものになる(cooperative binding)。そこで、彼らは、変異ガレクチン-3(L203A)を用いて、T細胞表面上の協調的結合を調べた。この変異ガレクチン-3は天然変性領域同士の結合は起こすが、CBDのF面に変異があるため天然変性領域がCBDに結合できないため、LLPS・多量体化に天然変性領域同士の相互作用が重要かがこの変異体を使えば調べることができる。変異ガレクチンL203Aであっても、ガレクチン-3の4倍ほどの濃度0.2 µM以上で協調的結合が見られた。従って天然変性領域―CBD間の相互作用がLLPSの誘導初期に必要であるのに対して、現象が誘導された後、または高濃度のガレクチン-3存在下では、天然変性領域同士の相互作用もLLPS現象に関与していることが示された。
また、Taiらは、ガレクチン-3の天然変性領域のPGxY/Wの9個の繰り返し構造のうちの最初の6個の繰り返しに散在するPをそれぞれアラニンに変異させた15個のガレクチン-3変異体を作成し、LLPS現象の誘導および活性を調べた。Pの位置により強度の違いはあるが、変異体の多くでは活性が低下し、またLLPS誘導化能も低下していた。すなわち、領域中にあるPの役割の精査により、2017年にHuangらが推察したCBDと天然変性領域の相互関係が1対多であることが示唆された。
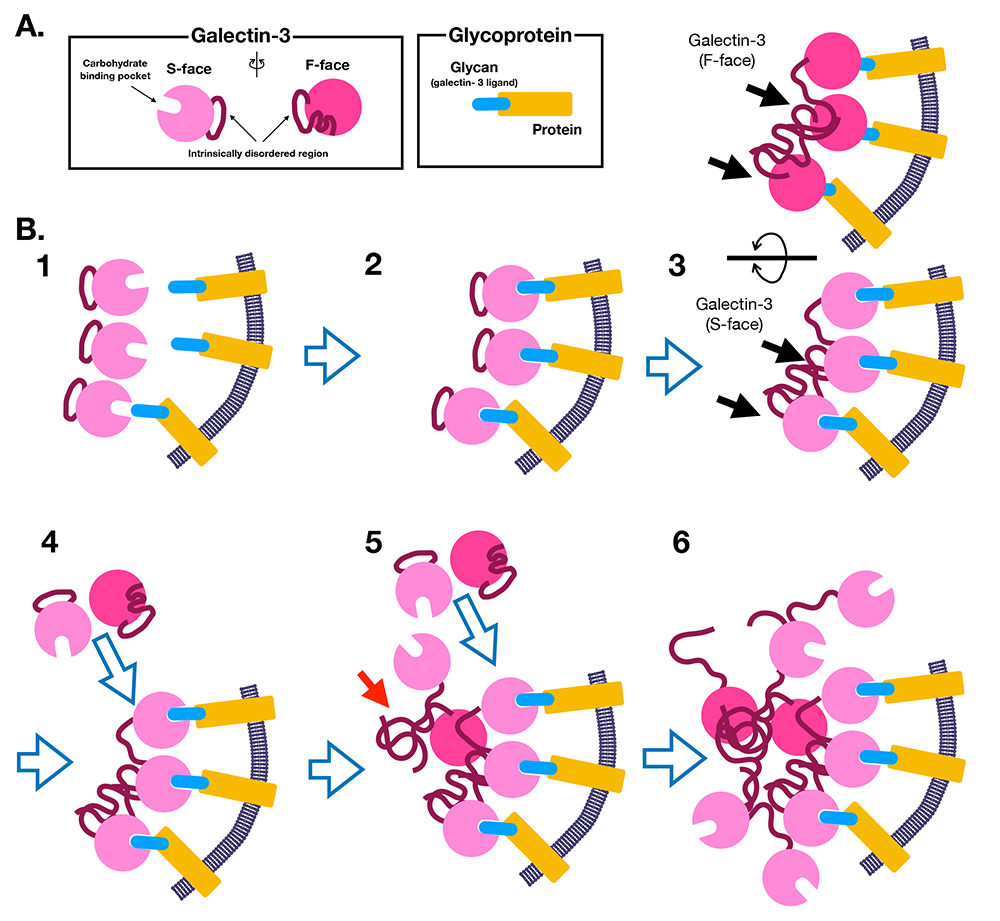
最近のガレクチン-3によるLLPS現象の誘導の3報の報告に基づいて、ガレクチン-3の多量体化の分子機構について、前編で推察したものを改訂していきたい。LLPS誘導によるガレクチン-3の多量体化は、以下のようにまとめることができる(図 5)。
| 1) | 単量体ガレクチン-3の天然変性領域はCBDのF面(糖結合部位の裏側)に結合・解離を繰り返している。(分子内相互作用—intramolecule interaction)(図 5 A、B -1) | 2) | ガレクチン-3が膜上の特定のリガンド(例えば糖タンパク質)に結合する(図 5 B -2)。 | 3) | 膜上におけるガレクチン-3の濃度・密集度が高くなり、LLPSを誘導する臨界点を超えるとともに、天然変性領域が別のガレクチン-3のCBDと相互作用をし始める(分子間相互作用―intermolecule interaction)。(図 5 B -3) | 4) | さらに膜上のガレクチン-3濃度が高くなり、天然変性領域同士も多量体化する(図 5 B -4、5) | 5) | ガレクチン-3の局所濃度がさらに上昇し、ガレクチン-3の多量体化が進む(図 5 6) | 6) | この天然変性領域が関与する相互作用は常に結合・解離を繰り返し、また、LLPS外のガレクチン-3とも相互移動する動的な関係である。 |
ガレクチン-3誘導のLLPSの結果できるガレクチン-3ラティスの形成はその結合パートナーである糖鎖の生合成過程で調整、コントロールされている。この詳細な説明はDennisとDimetriouのグライコフォーラムを参照にしてほしい11,12。
一方、ガレクチン-3側からのコントロールは、どうであろうか?すでに述べたが、ガレクチン-3誘導のLLPSは、天然変性領域が糖鎖に結合したCBDのF面をスキャンするように相互作用すること、および天然変性領域同士で相互作用することで保たれる非常に動的なクラスター形成現象である。天然変性領域はプロテアーゼに対して感受性が高いことをここで指摘したい。今まで報告された天然変性領域を切断できるプロテアーゼのいくつかをここに上げると、コラゲナーゼ17、メタロプロテアーゼ18、好中球エラスターゼ19、黄色ブドウ球菌のプロテアーゼ20、寄生虫リーシュマニアのセリンプロテアーゼgp 6321、シャーガス病を起こすクルーズトリパノソーマのプロテアーゼ22等が挙げられる。まだガレクチン-3とLLPSについての研究は始まったばかりなので、これらの酵素がある環境で実際にはLLPS現象が影響を受けるかは研究されていない。しかし、ここにあげた酵素は全てガレクチン-3の多量体化を解消すること、多くのプロテアーゼは活性が非常に高いこと、そして、LLPSの安定性は天然変性領域の長さに依存していることを考えると、プロテアーゼによる負の影響は大きいと推察する。例えば、炎症部位に遊走してきた好中球が活性化して脱顆粒し、エラスターゼを分泌した場合、感染部位で壊死した好中球からエラスターゼが放出された場合、あるいは感染微生物のプロテアーゼが存在する場合は、おそらくその近傍にあるガレクチン-3が関与するLLPSは急速に解消されると推定される。
自然界においては、細胞は、生命反応で起きる確率的なノイズを回避する仕組みを持っているが、逆にこのノイズを利用することにより多様に対応できる仕組みも持っていると考えられる。さまざまな内因性と外因性の影響と糖鎖合成特有な揺らぎにより、糖タンパク質の糖鎖構造には微少不均一性がある。糖鎖の微少不均一性に生物学的意味がある時もあるが、回避または克服すべきノイズである時もあろう23,24。大胆に言ってしまうと、ガレクチン-3誘導のLLPS現象により、糖鎖の微少不均一性レベルのノイズはキャンセルされているのかもしれない。このフォーラムの主旨はLLPSなので、ガレクチン-3の糖鎖結合特異性について突っ込んだ議論は行わないが、誤解を恐れずに極論すれば、ガレクチン-3の糖鎖への特異性は、他のガレクチンに比べてかなり寛容である。まず、精製した糖鎖の場合について考察したい。例えば、Galβ1-4GlcNAcβ1-3Galβ1-4GlcNA-注5)の糖鎖では、ガレクチン-1は、この糖鎖の非還元末端のガラクトースがシアル酸α2-6で修飾されると(Siaα2-6Galβ1-4GlcNAcβ1-3Galβ1-4GlcNAcβ1-3Galβ1-4GlcNAc-)結合できなくなる。これに対して、ガレクチン-3はこの糖鎖の内側にあるもう一つのラクトサミン(Galβ1-4GlcNA)が生きているので(α2-6 Siaで修飾されてなければ)、この糖を認識できる。さらに、ガレクチン-3の糖鎖への親和性の強さは、一つの糖鎖上にあるラクトサミンの残基数に比例する。この時、そのラクトサミンの配列が並列(複合型N-結合型糖鎖―3本鎖や4本鎖)か、直列(ポリラクトサミン)かは特に問題にならない25,26。
注5)Gal: ガラクトース、GlcNAc:N-アセチルグルコサミン、Sia:シアル酸
このガレクチン-3の緩い特異性は、細胞上でのガレクチン-3誘導のLLPS現象にも反映されるようだ。Dennisのグループがすでにさまざまな系で示しているように、膜タンパク質に存在する糖鎖の数、そしてラクトサミンの数により、ガレクチン-3ラティスによるその膜糖タンパク質の膜の上での動的移動調整・制御は異なる11,12。さらに、Demetriousのグループは、高分岐型の複合型N-結合型糖鎖合成が低下しても、その代わりにポリラクトサミンが増加している細胞においては、ガレクチン-3ラティスによる免疫制御が見られることを報告している27。
このようなガレクチン-3の許容範囲の高い糖鎖結合特異性を考えると、ガレクチン-3誘導のLLPSによるガレクチン-3ラティス形成の初期においては、膜タンパク質に存在する糖鎖の微小不均一性はあまり影響を及ぼさないのかもしれない。ガレクチン-3に局所的に提示された糖鎖のクラウドの中のラクトサミンの数や最適な密集度がLLPSの形成初期に大事であり、各々の糖鎖の多少の相違は、LLPSによりキャンセルされるのかもしれない。
むしろより重要なのは、LLPSの誘導に関与する糖鎖構造の柔軟性―つまりラクトサミンがどのように柔軟に提示されているかではないだろうか。例えば、bisecting GlcNAcは複合型N-結合型糖鎖のManα1-3及びα1-6アームのコンフォメーションを限定するため、この修飾によりラクトサミンを含む糖鎖の柔軟性が低下する。糖鎖単独の解析では、bisecting GlcNAcの有無がガレクチン-3に対する親和性に影響することはないようだが(岩城隼先生、私信)、LLPSの誘導の時にはその柔軟性が落ちていることから、影響が出るかもしれない。
また、密集していれば最適というわけではないかもしれない。例えば、膜ミミックとして自己凝集する糖鎖デンドリマー(Glycodendrimer)を用いてラクトースの密集度を変化させ、ガレクチンへの結合がどう変化するかを調べたPercecのグループの研究がある28。残念ながらガレクチン-1と-8のみを用いた研究であるが、注目すべきは、ラクトースの凝集が低い糖鎖デンドリマーの方がガレクチンへの結合が高いことである。すなわち、糖鎖密集度を低くすることにより、高い密集で起きる糖鎖同士の相互作用を抑制し、より多くのラクトースが効率よくガレクチンに認識されるようだ。ガレクチン-3においてもおそらく同様なことが起きていることを示唆する我々の報告がある29。HIV-1のT細胞への感染に必須のタンパク質であるgp120表面は糖鎖の密度が非常に高い。特に高マンノースが多いことで知られているが、数カ所のN-結合型糖鎖は複合型であり、これもタンパク質表面の一部に密集している。興味深いことに、ガレクチン-3は変性したgp120を認識する一方、変性していない(きちんと折り畳まれたインタクト状態の)gp120には結合しない注6)。この現象も上記のように、糖鎖―ラクトサミンの密集度が適度であることが、LLPSの誘導に重要であることを示唆している。
注6)興味深いことに、ガレクチン-1は変性していないgp120及びHIV-1ウイルスに結合し、HIV-1のT細胞への接着を増加する。これに対してガレクチン-3は未変性のHIVウイルスやgp120には結合しない。
ガレクチン-3誘導のLLPSで形成したラティスによる糖鎖結合特異性が緩やかで曖昧になるとすると、さらなる素朴な疑問がわいてくる。ガレクチン-3誘導の動的なラティスが形成された場合、その中に入る膜糖タンパク質はどのようにして選ばれるのだろう?
BertozziとWeaverの興味深い報告がある30。人工的に合成した嵩高いムチン型糖脂質ミメティックス(高さ80 µm)は、物理的に、嵩の低い(20 µm)膜上の細胞接着分子インテグリンをクラスタリングへと誘導させる(funneling)ことができるという結果である。さらに、嵩の高いMuc-1(200 µm)を強制発現させた細胞においても、Muc-1の物理的な障壁により、インテグリンをマトリックス接着部位に導くことができることも報告している。この効果にはMuc-1の細胞質側のドメインは必要なかった。したがって、この報告は、細胞膜上での糖タンパク質がその物理的性格(嵩高さなど)により、区画化される可能性を示唆している。ここで示されたモデル系はレクチンによる区画化の報告ではない。しかしながら、インテグリン、Muc-1共にガレクチン-3は結合する。
もしかしたら、ガレクチン-3誘導のLLPS・ラティスは細胞膜上では、単に一層ではなく、物理的に区画化された膜糖タンパク質の嵩の高さごとに、ある場所はMuc-1のように高い層(200 µm)で、ある場所ではインテグリンのように低い層(20 µm)という具合に区画化されているのかもしれない。そして、そこにいるガレクチン-3の局所濃度や相互作用している糖鎖により、ラティスの形成・解消がそれぞれの階層で適宜行われることで動的な制御がなされ、結合した糖タンパク質の機能やエンドサイトーシスに関与しているのではないだろうか。実際、Nabiのグループはガレクチン-3ラティスによる細胞接合部位でのN-cadherinと糖脂質GM1の挙動をFRAP(Fluorescence recovery after photobleaching)注7)で測定しているが、その挙動が全く異なることを報告している。この結果から、彼らもN-cadherinを含むガレクチン-3ラティス挙動がGM1のそれと異なるのは、異なるレベルのラティスがあるからではと推察している31。
注7)FRAP:生体分子の移動と動態を調べる方法。特定の領域の蛍光を消失させ、その後、蛍光標識された生体分子が周囲からその領域に移動する様子を観察することで、生体分子の移動速度や動態を計測することができる。
Dennisのグループがシミュレーションと実験結果を組み合わせて、ラティスによる糖タンパク質の機能制御とこれらの糖タンパク質の高分岐型のN-結合型糖鎖の生合成の制御(UDP-GlcNAcの可用性を通して)が、それぞれの糖タンパク質の糖鎖の数と関連していることを報告している32。すなわち、N-結合型糖鎖の数の多い膜タンパク質の場合は、UDP-GlcNAcの可用性に対して、その糖タンパクの糖鎖の分岐数と活性相関は、シグモイド状に制御されるのに対し、糖鎖数の少ない膜タンパク質はスイッチON・OFF状に制御される。この報告も、ガレクチン-3と膜糖タンパク質の相互作用には、膜糖タンパク質上の糖鎖のラクトサミン量・密度が鍵になることを示唆している。
ところで、ほとんどの多重膜貫通性(multi-transmembrane)タンパク質は、1または2個のN-結合型糖鎖しか持たない。また、これらの多くのタンパク質はチャネル・トランスポーターであり、細胞膜の外のエクトドメインがほとんどないタンパク質である。したがって、これらの糖タンパク質を含むガレクチン-3誘導のLLPS・ラティスは、細胞膜近くの嵩の低い層にあるものと考えられる。そのような観点で見てみると、ガレクチン-3誘導の膜上のLLPSは2次元で起こるものであるが、そのラティスを形成している糖鎖複合体(glycoconjugates―糖タンパク質・糖脂質)の嵩高さを考慮すると、ラティスは場所により嵩の高さが異なる3次元的な広がりを持つのかもしれない。
DennisとDimetriouのグライコフォーラムに詳細な説明があるのでそちらを参照してほしいが11,12、ガレクチン-3誘導のLLPSによるラティスは、一般的には、ガレクチン-3結合パートナーの膜糖タンパク質の側方(xy方向)の拡散速度を低下させる。この拡散速度低下によりエンドサイトーシスの速度が遅くなったり、あるシグナル伝達の初期に必要な受容体タンパク質のクラスタリングが遅延したりする。逆の例もある。細胞―細胞接合部では、ガレクチン-3多量体がラフト内にある糖脂質GM1やN-cadherinの側方移動・拡散を促進しているが、接合部以外ではこのような促進は見られないという報告がある31。これらの結果は、ガレクチン-3によるリガンドの凝集・クラスタリングによるエンドサイトーシスの調節が抑制的にも促進的にも働くことを示唆している。
クラスリン非依存的なエンドサイトーシス(clatherin-independend carriers: CLICs)におけるガレクチン-3の役割についてのJohannesのグループによる報告がある。この報告は、ガレクチン-3誘導の多量体化が、ガレクチン-3の濃度により細胞膜の糖タンパク質の挙動を多彩に調節することを示唆している33。CLICsでは、クラスリン依存性のエンドサイトーシスと異なり、細長く管のように膜が陥没した独特の形態を持った管状のエンドソーム輸送体が形成される。CLIC形成には、このエンドサイトーシスの起こる場所で、ガレクチン-3がCLIC型の取り込みをされる糖タンパク質(ここでは、CD44とインテグリンα5及びβ1)に結合することが必要であり、さらに、その過程には糖脂質の存在が必須であることが示されている。ただし、CLICで取り込まれるすべてのタンパク質がガレクチン-3依存ではないことも指摘してされている。興味深いのは、糖脂質、脂質を含む人工的なモデル細胞膜(すなわち糖タンパク質は存在しない条件)にガレクチン-3を強制的に近づけた状態を作ると注8)、CLIC特有の管状のエンドソーム輸送体がβ-ガラクトシド依存的に形成できることだ。この誘導にはN末の天然変性領域が必要なので、ガレクチン-3の多量体化がこの現象を起こしていることが明らかになった。この結果は、CLIC型の管状のエンドソーム輸送体の形成誘導には、ガレクチン-3が糖タンパク質に結合することが必須なわけでなく、ガレクチン-3が膜近くで凝集することが重要であることを示唆している。また、注目すべき点は、このCLICエンドサイトーシスは0.3 nM〜33 nMという非常に低い濃度で誘導できるのに対し、330 nMでは阻害される点である。
注8)ニッケルを含んだ脂質を人工膜に挿入することにより、His標識したガレクチン-3を強制的に膜に結合させた。
この点について彼らはさらに別の人工膜にα5β1インテグリンを挿入した系(microcavity-suspended liquid bilayer model)で研究を進め、2022年に報告している34。前編で述べた古典的な生化学の実験系では、ガレクチン-3は0.3 µM以上で協調的結合が見られたが、この感受性の高い系では、3.7 nMにおいても協調的結合が観察された。3.7 nMではインテグリンの凝集は小さく、その拡散速度は増加したのに対し、18.5 nM以上になると、側方拡散が低下したものと拡散が増加するものの2種類に分かれた。さらに膜が厚くなる現象も見られた。著者たちは、低濃度では、個々のα5β1インテグリンにガレクチン-3多量体が結合している状態、高濃度では、この凝集が大きくなりラティスを生成しているのではないかと推定している。
ここからは想像で述べるしかないのだが、LLPSが起こるにはガレクチン-3及びそのリガンドが特定の臨界濃度に達する必要があることを鑑みると、ここで見られた低濃度での現象は、11.節で考察したガレクチン-3の多量体の生成機構のステップ 3)天然変性領域が別のガレクチン-3のCBDと相互作用をする(分子間相互作用―intermolecule interaction)状態(図 5 B -3)ではないだろうか?CLIC現象の初期には、元々親和性が低めの糖脂質と密着することが難しいため、まず、ガレクチン-3の糖タンパク質への結合を介して、膜上のガレクチン-3を濃縮させ、その後、ガレクチン-3が糖脂質と相互作用してCLICを引き起こすのかもしれない。前編で糖脂質GM1とガレクチン-3の相互作用の研究を紹介したが35、この結合したガレクチン-3の大きさはガレクチン-3がラティス形成をしているときほどは大きくなく、CBDに対してわずか1.6倍未満であったことを合わせると、そのような推測も可能である。これに対して、高濃度では、LLPSが誘導されるためガレクチン-3の多量体化がラティス形成に至るのかもしれない。これらの非常に興味深い、一見相反しているように見えるガレクチン-3の多量体化に伴う現象の研究の発展が今後楽しみである。
上記の2022年の報告34の中で、天然変性領域が脂質膜とも相互作用していることを示唆する結果がある。変性領域には疎水性の高いアミノ酸、特にチロシン注9)が多いため、このようなことが起きている可能性も考えられる。Ochiengのグループは、2005年にプレートに固定化したリン脂質、ガラクトセラマイド、コレステロールにガレクチン-3が結合することを報告している36。この変性領域の疎水度がCLIC・ラティスの生成・解消にどのように影響しているかについても研究が進むことを期待したい。
注9)25ºCでの100mlの水に溶解するアミノ酸は、たとえばグリシンは25g、アスパラギンは0.51gである。これに対してチロシンは0.054gとどのアミノ酸に比べても二桁低い。ガレクチン-3の天然変性領域にはチロシンが106残基中8残基が比較的規則的に散りばめられている。
前編でも述べたが、哺乳類、例えばヒトの場合には15種類のガレクチンがあり、CBDのみからなるプロトタイプ、2つのCBDが比較的短いペプチドを介して繰り返されているタンデムリピートタイプ、キメラタイプのガレクチン-3がある。ここまでは他のどの動物レクチンにない天然変性領域を持つガレクチン-3とLLPSを中心に論文を紹介し、考察してきたが、ここで、他のガレクチンがこのLLPSに参加する可能性があるのかについて、少し想像をしてみたい。
2007年に平林のグループはタンデムリピートタイプのガレクチン-9と他のガレクチンとの相互作用について表面プラズモン共鳴法を用いて調べている37。ガレクチン-9を固定した場合、ガレクチン-3または8に結合するのに対してガレクチン-1はしないこと、さらにこの結合はラクトースで阻害されることを報告している。興味深いことに、ガレクチン-9のN末端側のCBDを固定化した場合、ガレクチン-8は結合するがガレクチン-3は結合せず、C末端側のCBDを固定化した場合にはガレクチン-3が結合することも示されている。これらのタンパク間の結合もラクトースの添加で解消されるようだ。もし、立体構造障害が起こらないのであれば、ガレクチン-9のN側CBDにガレクチン-8、C側CBDにガレクチン-3が結合するような状況も可能かもしれない。
この研究からは、これらの異なるガレクチン同士の相互作用にCBDのどこが関与しているかは不明である。不明なので、さらに想像になってしまうが、もしこのガレクチン同士の相互作用部位が天然変性領域との接触部位であるF面のAA200-220でないのであれば、ガレクチン-9上にガレクチン-3や、8がリクルートされる可能性はないだろうか?多くの細胞や組織には複数のガレクチンが細胞質で生成され貯蔵されている。ラクトースでこれらの相互作用が解消されることを考えると、糖鎖に結合していないガレクチン-3、8、9が共にある状況では、この3種が緩い複合体を作っており、どちらかが糖鎖に結合した時に、この複合体が解消される可能性はないだろうか?また、ガレクチンは細胞からシグナルペプチド非依存性の分泌経路(leaderless secretory pathway)経由で分泌されるか、または細胞膜が損傷した細胞(あるいは死細胞)から放出されるが38、この分泌・放出経路はどのガレクチンも同じ経路をとると思われるので、もしかしたら、ガレクチン同士の相互作用が起こっているのかもしれない。この点も今後の研究の発展を期待している。
ここまでは、細胞外で起きるガレクチン-3誘導のLLPSについて紹介議論してきた。さて、ガレクチン-3の遺伝子には通常の分泌経路に入るためのシグナルペプチド配列がないので、ガレクチン-3は、細胞質で作られ、貯蔵されている38。細胞内ガレクチン-3がさまざまな生体反応に関与していることも数多く報告されている。ここで全てを網羅することはしないが、2つの生体反応に関して—リソソーム損傷への防御機能とRNAスプライシング—の機能がLLPSと関連しているかを議論していきたい。
感染やその他の原因で細胞内にあるリソソームに損傷が起こることがある。たとえば白血球の貪食細胞の場合は貪食してリソソームに運ばれた微生物が膜を壊して細胞質に出てしまった時とかである。損傷したリソソームからさまざまな加水分解酵素(例:プロテアーゼ、グリコシダーゼ)が細胞質に流失してしまい、さらなる障害を引き起こすことがあるため、細胞は、この損傷に対する防御機能、MERiT(membrane repair, removal, and replacement)というシステムを備えている39。リソソームが損傷するとリソソーム膜上にある糖タンパク質が細胞質側に露出する。この露出した糖鎖を細胞質のガレクチンが認識し、その後損傷の度合いや、修復の進行度合いにより、膜修復、オートファジーによる損傷リソソームの除去、あるいは新しいリソソームの生成が誘導される。
少し詳細に述べると39、まず、損傷したリソソームの糖タンパク質にガレクチン-3がリクルートされMERiTが開始する。トランスフェリン受容体に結合したガレクチン-3がESCRTs(endosomal sorting complexes required for transport)のタンパク質の一つであるALIXなどと複合体を形成し、ESCRTs機構が活性化し、膜のリモデリング誘導により膜を修復する。ESCRTsによる修復が難しい場合は、リソソーム膜タンパク質―ガレクチン-3―E3ユビキチンリガーゼ、TRIM16(Tripartite motif-containing protein 16 )の複合体が損傷した膜をユビキチン修飾し、オートファジーを誘導することで損傷リソソームを除去する。また、LAMP2(lysosomal-associated membrane protein 2)に結合したガレクチン-9はAMPK(AMP-activated protein kinase)を活性化し、オートファジーを誘導する。この経路はmTORの活性化を阻害するので、さらにオートファジーによる損傷除去が進む。MERiTの最終ステージとしては、ガレクチン-8が損傷により露出したSLC38A9に結合し、mTORの活性化を阻害し、TFEBを通してリソソームの置換のために必要な転写を活性化する。損傷リソソームの修復過程の初期は、ガレクチン-3が他のガレクチンに比べてより重要な調整役を担っていることが示唆されている39。
この損傷したリソソームから露出した膜上において、ガレクチン-3が関与するLLPS現象は起こっているのであろうか?オートファジーにLLPSが関与していることはすでに報告されているので40、論文はまだないが細胞膜上で起きていることと同様に、ガレクチン-3はLLPSを起こしていることが推察できる。もう一点指摘したい点は、損傷リソソームに対する細胞防御機構の開始において、ガレクチン-3による露出したリソソームの膜タンパク質認識が要である点である39。想像しすぎかもしれないが、前章で指摘したように、ガレクチン-3はこの機構に関与しているガレクチン-8や9と複合体を作ることが報告されているので、ガレクチン-3と露出糖鎖との相互作用から始まる防御機構のカスケードに、このガレクチン同士の相互作用が関与している可能性もある。
最後に、約35年前の遺伝子配列解明後すぐに始められたガレクチン-3とRNAの相互作用41の研究について触れたいと思う。
1988年にWangのグループは、ガレクチン-3が核内で転写および新生RNA(pre-mRNA)の転写後修飾(キャッピング、スプライシング、polyA添加)に関与するhnRNPs(heterogeneous nuclear ribonucleoproteins)の一つであることを示唆する結果を発表した41。その後の彼らの核抽出液を用いた研究で、ガレクチン-3がpre-mRNAのスプライシングに関与し、その活性をガレクチン-3の糖鎖結合を阻害する人工糖であるthiodigalactoside、さらにN末の非レクチン領域が阻害することを示唆した42,43。ガレクチン-3はスプライシングに関与するU1snRNP(small nuclear ribonucleoprotein)と結合し、スプライソソームに組み込まれpre-mRNAスプライシングに関与することも示唆されている44,45。ただし、これは、ガレクチン-3特異的ではなく、プロトタイプのガレクチン-1にもその活性があるが、ガレクチン-3欠損(従ってガレクチンー1のみがある状態)の場合、スプライシングのパターンが異なるという46。
2016年にJacobのグループが、ガレクチン-3が14種類のhnRNPsに結合することを確認した47。さらに、Pignyのグループはガレクチン-3がMUC4のmRNAの安定性にhnRNP-Lを介して関与することを示唆している48。この効果はhnRNP-LがMUC4の3’UTRのCA repeat elementとガレクチン-3依存的に相互作用することで起こるので、このelementのないMUC1の安定性には効果がない。PignyはhnRNP-Lが翻訳されないmRNAを貯蔵するRNP顆粒の構成分子であることから、MUC4は、ガレクチン-3と共に、 RNP顆粒に貯蔵されているのではないかと推察している。
以上のように、ガレクチン-3はRNAの転写後修飾から安定性まで関与している。前編でも少し述べたが、細胞内にあるLLPSで形成される膜のないオルガネラにはRNAと天然変性領域を持つタンパク質により形成されているものが多い。ストレス顆粒、P顆粒、 RNP顆粒などである。ガレクチン-3の天然変性領域は、hnRNPに取り込まれているとき、この領域に対しての抗体(Mac-2; AA48-100に結合)で認識されない43こと、また。この領域がスプライシングを阻害することなどを考えると、ガレクチン-3のRNAの代謝への関与も何らかの形で天然変性領域依存のLLPSが起きているのかもしれない。ごく最近に上記のWangのグループは核におけるガレクチン-3とLLPSの関係について総論を発表している49。
ガレクチン-3は、核内、細胞質内、そして細胞外において非常に多岐にわたる生物活性が見出されているレクチンである。さらに、哺乳類レクチンとしては唯一の長い天然変性領域を持つレクチンでもある。ガレクチン-3とLLPSについての研究はまだ始まったばかりである。LLPSの観点から見れば、ガレクチン-3とそのパートナーの相互関係は1対多であり、CBDの糖結合部位は少し曖昧な特異性で糖鎖をスキャンし、天然変性領域は、CBDのF面や他のガレクチン-3の天然線領域の上をスキャンしながら、結合パートナーの動的な移動の調整をしている。これからのガレクチン-3の研究において、LLPSの関与やその動的な機能調節の研究がさらに発展し、その研究がガレクチン-3の多岐にわたる機能の機構解析にさらに貢献することを願ってやまない。
このフォーラムを書くにあたり、要になる論文(2014年のRosen論文)他を紹介してくださり、前編の感想を含めて、議論をしてくださったJim Dennis先生、糖鎖の柔軟性についての情報を教えてくださった山口芳樹先生、未発表のガレクチン-3とbisecting 糖鎖との結合に関しての情報を教えてくださった岩木隼先生、原稿を読み不明な点を指摘してくださったJohn Wang先生、Yves St-Pierre先生、丹念に編集(特に日本語編集)をしてくださった 平林淳先生に深くお礼を申し上げたい。