
氏名:山下 祐典
鹿児島大学大学院理工学研究科総合理工学専攻(博士後期課程)
新規バイオマテリアル開発に従事している。

氏名:武井 孝行
鹿児島大学大学院理工学研究科教授
2007年 九州大学大学院工学府博士課程修了 博士(工学)、2007年度 日本学術振興会特別研究員(PD)、2008年~2011年度 九州大学大学院工学研究院助教、2012~2019年年度 鹿児島大学大学院理工学研究科准教授、2020年~ 現職
受賞:化学工学会平成26年度研究奨励賞
界面化学をベースに新規バイオマテリアル開発に従事しており、様々な天然高分子を研究の対象としている。
キトサンは様々な生理活性を持つことが報告されている。その生理活性の中でも特に傷の治癒の促進効果は広く知られており、キトサンを主成分とした創傷被覆材が販売されるに至っている。しかし、その創傷被覆材は乾燥製材であり、ヒドロゲル型ではない。その理由は、安全性の高いキトサンのヒドロゲルを調製することが困難なためである。具体的には、キトサンからなるヒドロゲルを作製するためには、まずはキトサンを水に溶解させる必要がある。しかし、キトサンは酸性の水にしか溶解しないため、それから得られるヒドロゲルも酸性となり、傷口に貼付するには適さない。また、ヒドロゲルを調製するためには高分子水溶液中の高分子を化学架橋剤で架橋する必要があるが、化学架橋剤は毒性の高いものが多く、それを含むヒドロゲルも医療用途には適さない。本稿では筆者が開発した、化学架橋剤を含まずに凍結-融解処理またはオートクレーブ処理により調製可能であり、かつ中性であるキトサンヒドロゲルを紹介する。
事故や病気によりできた体表面の傷(創傷)を効率良く治癒させるためには、傷表面を湿潤状態に保つことが有効であることが報告されている1。この治療方法は“モイストヒーリング”と呼ばれ、従来の傷を乾燥させてかさぶたを作らせる乾燥療法よりも、傷の治癒が著しく早く、かつ傷跡が残りにくいことが報告されている。創傷被覆材はその名の通り、傷を覆って湿潤状態に保つことを目的とした医療用製品である。ヒドロゲルは、それ自体が多分の水分を含んでいるため、創傷被覆材として好適である。現在は、そのヒドロゲル型の創傷被覆材のモイストヒーリング効果をさらに高めるための研究が精力的に行われている。著者もそのような研究者の一人であり、治癒効果を高めるためにヒドロゲルの材料としてキトサンに注目した。
キトサンは様々な生理活性を持つことが報告されている。その生理活性の中でも特に傷の治癒の促進効果は広く知られており、キトサンを主成分とした創傷被覆材が販売されるに至っている。しかし、その創傷被覆材は乾燥製材であり、ヒドロゲル型ではない。その理由は、安全性の高いキトサンのヒドロゲルを調製することが困難なためである。具体的には、キトサンからなるヒドロゲルを作製するためには、まずはキトサンを水に溶解させる必要がある。しかし、キトサンは酸性の水にしか溶解しないため、それから得られるヒドロゲルも酸性となり、傷口に貼付するには適さない2。また、ヒドロゲルを調製するためには高分子水溶液中の高分子を化学架橋剤で架橋する必要があるが、化学架橋剤は毒性の高いものが多く、それを含むヒドロゲルも医療用途には適さない3。本稿では筆者が開発した、化学架橋剤を含まずに凍結-融解処理またはオートクレーブ処理により調製可能であり、かつ中性であるキトサンヒドロゲルを紹介する。
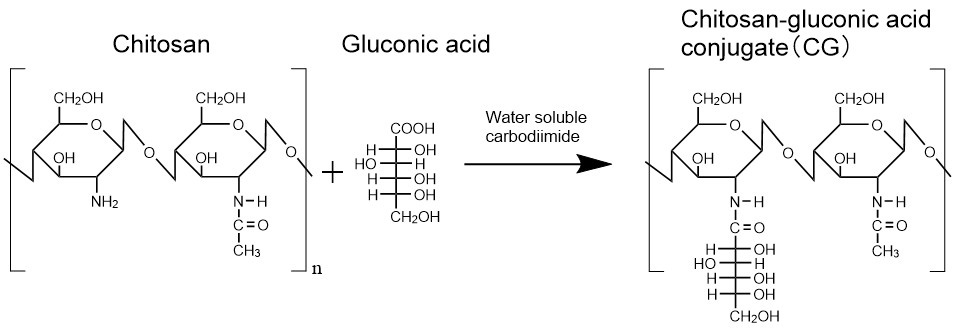
キトサンは安定な結晶構造をとることが報告されている。したがって、水に溶解させるためには酸性の水溶液にキトサン固体を投入し、アミノ基のプロトン化によって分子間を静電的に反発させる必要がある2。筆者は、キトサンのアミノ基部分に何らかの分子を修飾することによりキトサンの結晶化が立体的に阻害され、中性水にも溶解できるのではないかと考えた。キトサンに修飾する分子として、種々の食品やその塩が軟膏成分として利用されている生体安全性の高いグルコン酸を採用した。水溶性カルボジイミド縮合剤を使用して、キトサンのアミノ基とグルコン酸のカルボキシル基を脱水縮合させた(図 1)。予想に反して、得られたグルコン酸修飾キトサン(CG)の固体粉末を中性水に投入し撹拌してもCGは溶解しなかった。一方、一度酸性水溶液に溶解させた後、そこにアルカリ水溶液を徐々に加えて水溶液を中性にしたところ、CGの析出はほとんど見られなかった。未修飾キトサンも同様の処理をしたところ、中性に到達する前に高分子が析出した。このことを考慮すると、確かにグルコン酸がキトサンの結晶化を立体的に阻害していると考えられる。また、中性のCG水溶液を長時間(数日以上)放置すると、CGの固体が析出するサンプルもあることから、その水溶液は熱力学的に不安定な状態にあると考えられる(オートクレーブ処理をゲル化のトリガーとしたキトサンヒドロゲルの調製において重要)。なお、グルコン酸以外のアルドン酸を修飾しても同様の結果が得られた。
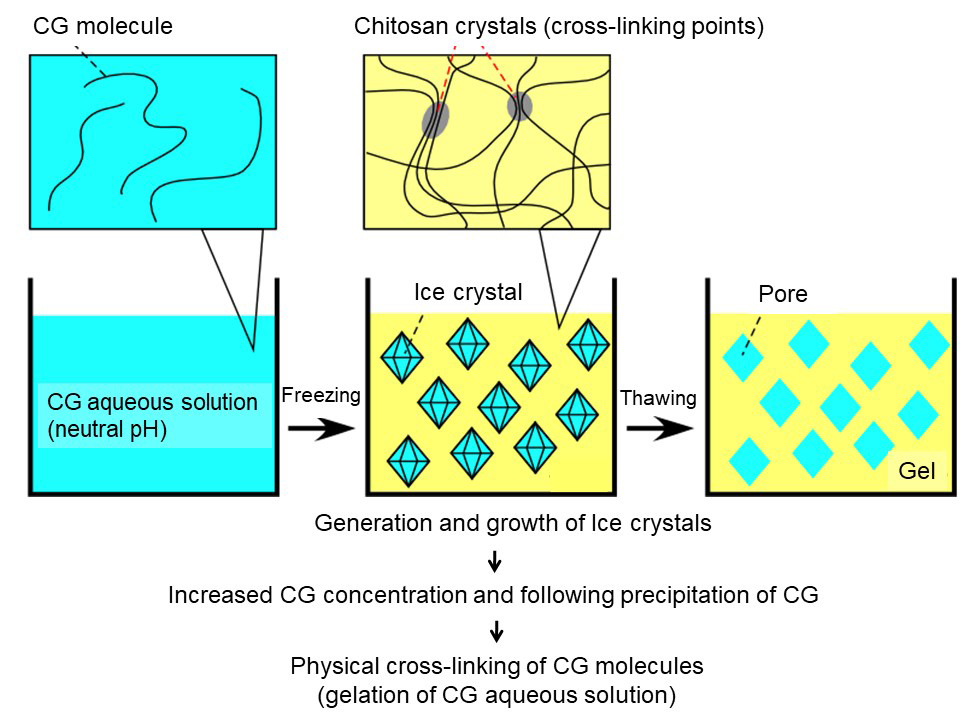
上記で調製した中性のCG水溶液を-30℃で一晩凍結した後、室温で融解させるだけでゲル化することを見出した(図 2)。考えられるゲル化のメカニズムは以下のとおりである(図 3)。中性のCG水溶液の温度が0℃以下になると、氷結晶が生じ、それが成長する。氷結晶には塩や高分子が含まれないため、まだ液体として残っている水の中に溶解しているCGの濃度が相対的に増加し、最終的には飽和溶解度を超えてCGが析出する。この状態では、氷結晶の周囲に固体キトサンが析出し、CGがスポンジ状の骨格を形成していると考えられる。析出したCGは固体であり、高度に結晶化していると考えられる。その凍結物を溶解させると、氷結晶が融解し水に戻る。そのpHは凍結前と同じ中性である。上記で、固体CGは直接中性水には溶解しないことを述べた。CGが形成しているスポンジ状骨格も同様に中性の融解水には溶解したいため、ゲル形状を維持できていると考えている。顕微鏡でゲル内部を観察したところ、実際にスポンジ状骨格を確認できている。

親水性高分子の水への溶解度は、温度が高いほど上昇する場合が多い。つまり温度依存性がある。一方、キトサンは水の温度上昇に伴って溶解度が飛躍的に高まることはなく、上述のとおりその溶解度はほぼ水溶液のpHのみに依存する。このことは、凍結-融解処理により調製したCGヒドロゲルが熱に対して高い安定性を有していることを示唆している。そこで、このCGヒドロゲルをオートクレーブにより高温・高圧滅菌を行ったところ、ゲルはその形状を保っただけでなく、ゲルは収縮し高分子の架橋がより進んでいるようであった。また、上述のように、中性のCG水溶液はCGの溶解状態に関して熱力学的に不安定であると考えられる。これらより、中性のCG水溶液をオートクレーブ処理するだけで水溶液がゲル化するのではないかと考えた。実際にオートクレーブ処理によりCG水溶液はゲル化した(図 4)。恐らく、中性のCG水溶液が高温になると、高分子の熱運動が激しくなり、それにより水和水が剥がれて脱水和を起こし、キトサンの結晶化(高分子の物理架橋点)が進んだものと考えられる。

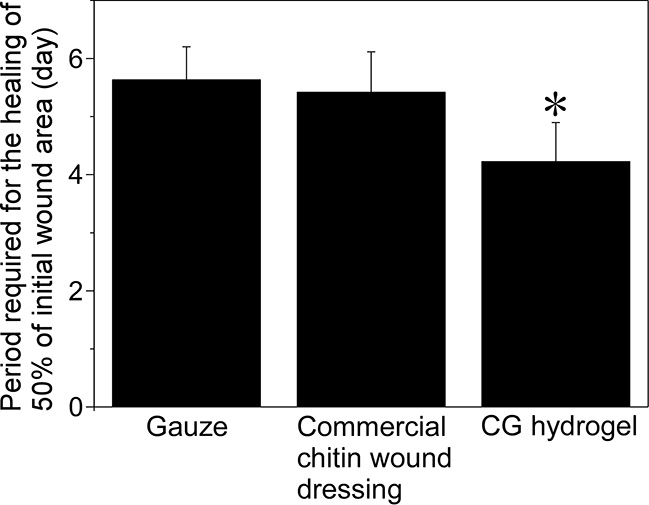
われわれが開発したキトサンゲルは、モイストヒーリングとキトサン自体が有する傷の治癒促進効果との相乗効果により、傷の治癒を促進できるのではないかと考えられたため、その検証を行った。CGゲルは凍結-融解処理後にオートクレーブ滅菌を行ったものをラット背部に作製した円形の皮膚欠損創に貼り付け、その治癒の過程を経時的に評価した(図 5)。比較対象としてはキチンからなる乾燥型の創傷被覆材を用いた。傷の面積が半分になるまでに治癒するのに必要な日数が最も短かかったのはCGゲルであった。CGゲルが接している傷面には、傷の治癒を促す液性因子を分泌する好中球が多数観察されたことから、CGゲルが治癒を促進できた理由はやはり、モイストヒーリングとキトサン自体が有する傷の治癒促進効果との相乗効果であると考えられる。
本稿では、われわれが開発したキトサンヒドロゲルの作製法、ゲル化メカニズムおよびそのゲルの諸特性について紹介した。そのゲルの最大の特徴は、中性かつ化学架橋剤が含まれていないために生体安全性が高いことである。これは本ゲルを医療用製品として実用化する際に大きなアドバンテージとなる。今後、実用化に向けた検討を進めていきたいと考えている。