
氏名:由井 伸彦
東京医科歯科大学 名誉教授
由井伸彦博士は上智大学大学院で工学博士号を取得した後(1985年)、東京女子医科大学医用工学研究施設助手に就任して、櫻井靖久教授のもとバイオマテリアル研究に従事した。オランダ王国トゥエンテ大学Jan Feijen教授のもとでの博士研究員を経て(1988-89年)、1993年に北陸先端科学技術大学院大学へ助教授として異動して自らの研究室の主宰を開始し、1998年の教授昇任を経て、超分子バイオマテリアル研究を指導してきた。2011年に東京医科歯科大学へ異動し、生体材料工学研究所有機生体材料学分野教授として、自身が提唱してきた超分子バイオマテリアル研究を工学・理学・医学・歯学の学際連携によって更に推進した。2023年、東京医科歯科大学名誉教授。2018-2020年には日本バイオマテリアル学会会長に就任し、我が国のバイオマテリアル科学に関する研究教育の先導啓蒙にも貢献した。これまでに発表した原著論文・総説・書籍など400報以上、指導した博士号取得者40名以上。

氏名:田村 篤志
東京医科歯科大学 准教授
田村篤志博士は、筑波大学大学院数理物質科学研究科物性・分子工学専攻で長崎幸夫教授の指導のもとで高分子バイオマテリアル研究に従事し、2010年に博士(工学)を取得した。学位取得後、東京女子医科大学先端生命医科学研究所に博士研究員として所属し、再生医療に関する研究に従事した。その後、2011年に東京医科歯科大学生体材料工学研究所有機生体材料学分野に特任助教として着任し、ポリロタキサンを用いたバイオマテリアル研究に従事している。2013年より同分野の助教、2018年より同分野の准教授としてポリロタキサンの医学、歯学領域への応用について研究を推進している。
ポリロタキサンとは、多数の環状分子の空洞部に線状高分子鎖を貫通させ、その両末端にかさ高い封鎖基を導入して、環状分子が脱離しないようにしてある超分子の総称である。したがって、ポリロタキサンは高分子量体であるが、多数の環状分子と線状高分子鎖とのあいだには共有結合が存在せず、これら分子同士は機械的に連結しているとみなすことが出来る。そして、過去数十年にわたるポリロタキサン設計に用いられてきた環状分子の一つが、シクロデキストリンの名で親しまれてきた環状オリゴ糖である。
筆者らは、1993年にシクロデキストリンを一成分とするポリロタキサン骨格を用いて新たなバイオマテリアル機能を設計すべく研究を開始し、これまでに数多くの機能創発を報告してきた。いずれも機械的連結様式をもったポリロタキサンならではの特徴に裏付けられた機能であり、分子同士が共有結合で連結している従来高分子とは全く異なる新世界の広がりと深みを示すことが出来たものと自負している。本稿では、筆者らのポリロタキサン研究の中でもとりわけ重点的に取り組んできた①分子可動性ポリロタキサン表面による細胞機能調節と②分解応答性ポリロタキサンによる難治性代謝疾患治療応用の可能性について紹介していきたい。
生体と接して用いるバイオマテリアル表面には、生体の異物反応を回避したり細胞機能を調節して組織再生したり、いろんな特性が要求される。詳細は省くが、筆者らは先行研究において、バイオマテリアル表面の分子運動性が接着している細胞機能を決する可能性があることを指摘していた1。そこで著者らは、分子可動性表面によって細胞や組織を自在に制御できるのではないかと仮説をたて、それを検証するために分子可動性を広範囲に制御できるポテンシャルのあるポリロタキサンを被膜した表面(ポリロタキサン表面)を設計し、この分子可動性が細胞に与える効果について検討してきた。先に述べたようにポリロタキサンは、その機械的な分子連結に基づく構造特性として分子可動性を有している。
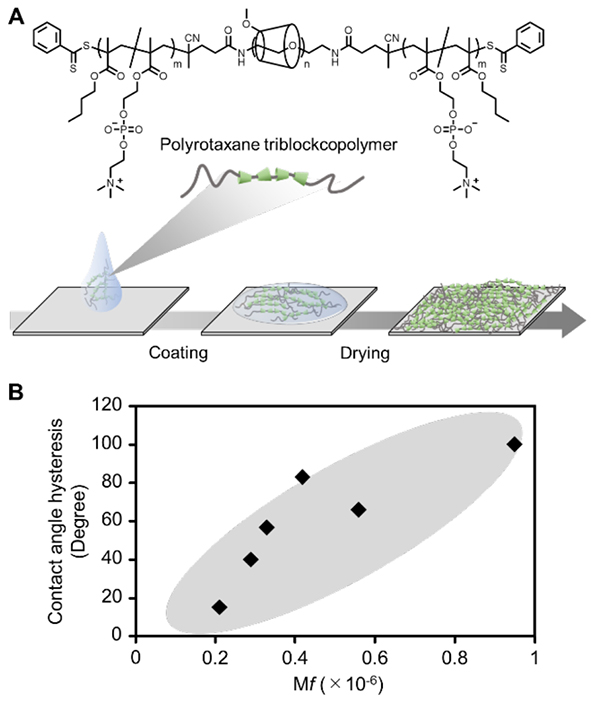
ポリロタキサン表面は、疎水性高分子鎖を両末端に配したポリロタキサントリブロック共重合体をガラスや金属、プラスチック等の器材表面に被膜することによって作製することができる2-5(図 1A)。またα-シクロデキストリンの貫通数やα-シクロデキストリンに修飾する官能基数(例えばメチル基など)によって、分子可動性の度合いを調節することが可能である。水晶発振子マイクロバランス(QCM-D)測定法によって得られるポリマーの吸着量当たりの水中・乾燥中でのエネルギー損失量(ΔD/Δf)を表面分子可動性の指標(Mobility factor, Mf)として算出すると、α-シクロデキストリンの貫通数が少なく、メチル基修飾数が多い表面ほどMf値が高い傾向にあった。使用したポリロタキサントリブロック共重合体と同様な官能基を有したランダム共重合体を被膜した表面(非ポリロタキサン表面)より、ポリロタキサン表面はMf値が高かった。これらの表面を用いて水中および大気中における水の接触角の差(接触角ヒステリシス)を解析したところ、分子可動性の高いポリロタキサン表面では100°以上のヒステリシスがあり、Mf値と接触角ヒステリシスには正の相関性があった3,5(図 1B)。接触角ヒステリシスは材料表面が環境に応じてダイナミックに変化することを示しており、高Mf値のポリロタキサン表面ほど高い分子可動性による環境応答性を有していることを支持する結果であった。
細胞接着性ポリペプチド配列であるアルギニン-グリシン-アスパラギン酸(RGD)をα-シクロデキストリンに修飾したポリロタキサン表面(RGD修飾ポリロタキサン表面)とRGD基を有したランダム共重合体を被膜した非ポリロタキサン表面(RGD修飾非ポリロタキサン表面)を用いてヒト臍帯静脈由来血管内皮細胞の初期接着を観察したところ7、RGD修飾ポリロタキサン表面において短時間での細胞接着が観察された。これはポリロタキサンの分子可動性がRGDとインテグリンの多価相互作用を飛躍的に促進することを示唆している。また興味深いことに、RGD修飾ポリロタキサン表面は細胞の初期接着を亢進するものの、細胞の伸展や細胞骨格系タンパク質であるアクチン線維の形成を抑える傾向があった。一般的に、細胞接着に優れた材料は細胞の伸展性や増殖性を促す傾向がある。しかしながら、ポリロタキサン表面では細胞の接着性と伸展性がそのような相互関係にはないことが示唆された。そこで分子可動性の異なるポリロタキサン表面を用いて細胞の伸展形態について解析したところ、分子可動性の高い表面ほど細胞伸展が抑制され、分子可動性の低い表面ほど細胞の伸展を促進させる傾向があった。すなわちポリロタキサン表面は高い細胞接着性を維持しながら、分子可動性によって細胞伸展性を独立して調節できる可能性を有していることが明らかとなった。
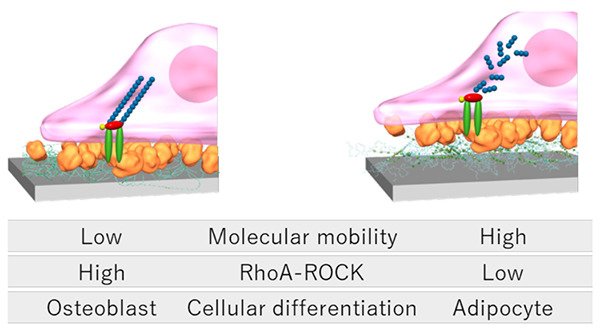
細胞の伸展形態を制御することは、メカノバイオロジーと呼ばれる学問領域を背景とした新たなバイオマテリアル研究としてここ十数年で非常に注目されている。メカノバイオロジーは、細胞の内外で発生した力をどのように細胞や組織が認識し、その活動に影響を及ぼすのかを調べる学問である8。バイオマテリアル研究では接着する器材の弾性率やナノ構造を細胞が認識することによって、その形態や分化を変化させることが多数報告されている9。細胞が材料物性を認識するメカニズムの一つとして、細胞が細胞骨格系シグナル伝達経路を介して周囲環境の物理的な情報を生理活性シグナルに変換していることが明らかになってきている。細胞外マトリックス(ECM)を介して細胞が器材表面に接着すると接着斑キナーゼ(FAK)がリン酸化しRhoファミリーであるRhoAとRhoA結合キナーゼ(ROCK)からなるRhoA-ROCKシグナル伝達経路を活性化する。これによってアクチン線維の架橋が促進するため、細胞は広く伸展した扁平状の形態となる。一方で、RhoA-ROCKシグナル伝達経路の不活性化はアクチン線維の崩壊を誘起し、細長い紡錘状の形態を示す。このRhoA-ROCKシグナル伝達は細胞形態に関与するのみでなく、間葉系幹細胞の分化系統を制御する分子スイッチとしても機能しており、その亢進によって間葉系幹細胞の骨芽分化が促され、ROCK阻害剤存在下では脂肪細胞への分化が誘導される10。
そこで著者らはポリロタキサン表面の分子可動性の活用によって、幹細胞の分化系統が制御できると仮説を立てた。実際に、分子可動性の異なる表面上に接着した間葉系幹細胞の形態を観察したところ、分子可動性の低い表面ではアクチン繊維の発達や円形放射状の接着形態が見られ、分子可動性の高い表面では細長い紡錘状の接着形態が観察された11。この結果は間葉系幹細胞がポリロタキサン表面の分子可動性を認識し、細胞骨格や形態を変化させたことを示唆している。つぎにそれぞれの表面に接着した間葉系幹細胞内のRhoA-ROCKの活性化をリアルタイムPCRおよび酵素結合免疫吸着(ELISA)法によって解析すると、分子可動性の低い表面ほどRhoA遺伝子の発現が高くROCKの酵素活性が高く検出された(図 2)。すなわち、表面の分子可動性は間葉系幹細胞のRhoA-ROCKシグナル伝達に影響を与えることが明らかとなった。さらに骨芽分化誘導培地もしくは脂肪分化誘導培地中で間葉系幹細胞を培養したところ、分子可動性の低い表面上では骨芽分化のマーカータンパク質であるRunx2の遺伝子発現量が増大した一方で、分子可動性の高い表面上では脂肪分化のマーカータンパク質であるPparg遺伝子の発現量が増大した。アルカリホスファターゼ活性およびオイルレッドO染色による骨芽分化および脂肪分化の機能評価を行ったが、それらの結果とも一致した。すなわち分子可動性の低い表面は骨芽分化に有用であり、分子可動性の高い表面は脂肪分化に有用であることを明らかにした。これらの結果は、ポリロタキサンの分子可動性が幹細胞の分化系統を規定する材料パラメータとなり得ることを示唆している。
最近では、こうした分子可動性表面の効果を多様な細胞群に応用展開して更なる研究を推進してきており、それによって肝細胞の機能亢進12、血管内皮細胞の管腔形成13、血管内皮細胞と間葉系幹細胞の共培養における細胞間コミュニケーション亢進14、炎症担当細胞の炎症性-抗炎症性の切替15、上皮細胞における細胞-細胞間接着亢進16、がん細胞の遊走抑制や抗がん剤感受性亢進17、細胞老化における抑制効果18などを明らかにしてきており、分子可動性表面によって多彩な細胞組織機能の調節が可能になった。こうした永年にわたる地道な研究をもとにバイオマテリアル表面設計の指針の一つとして分子可動性が重要であることを明らかにできたのは、バイオマテリアル科学を標榜する研究者として多くの医学歯学領域の共同研究者に恵まれて研究できたことによるところが大きい。
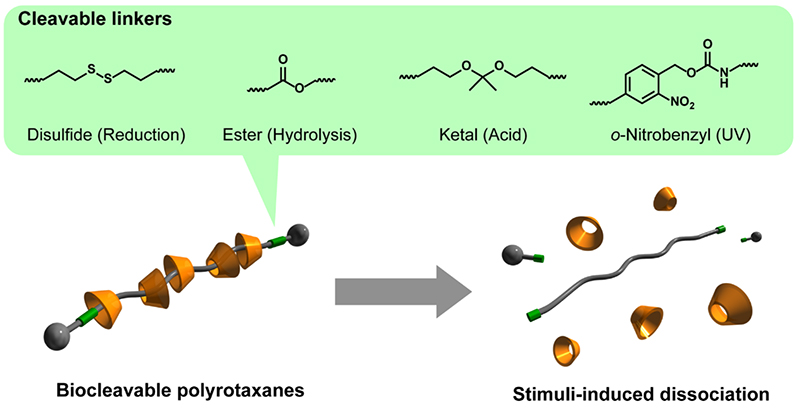
ポリロタキサン中の多数の環状分子は,軸高分子末端に導入したかさ高い封鎖基によって機械的に束縛されている。しかし、化学的な外部環境の変化や物理的な刺激によって封鎖基が脱離すると、速やかにポリロタキサン構造の崩壊に繋がる。このような環境変化や刺激に対する分解応答性を賦与することでポリロタキサンは生分解性高分子と類似の性質を示す。このような分解応答特性は、軸高分子末端と封鎖基の間に還元分解性のジスルフィド結合や加水分解性のエステル結合などの分解性結合を導入することで賦与することができる(図 3)19。ポリロタキサンの分解機構はポリエステルに代表される生分解性高分子とは本質的に異なる。脂肪族ポリエステルのような生分解性高分子は、完全な分解が起こるまでには複数箇所の結合が切断される必要がある。また、分解物に由来する毒性や炎症性なども懸念される。一方、分解性ポリロタキサンは片方の封鎖基が脱離するだけで、貫通しているすべての環状分子が放出されるため、完全な分解に要する時間が圧倒的に短く迅速な分解応答が期待される。さらに、ポリロタキサンの構成成分であるPEGやシクロデキストリンは医薬品等で利用されている分子であるため,分解物に由来した有害事象も軽微であると考えられる。
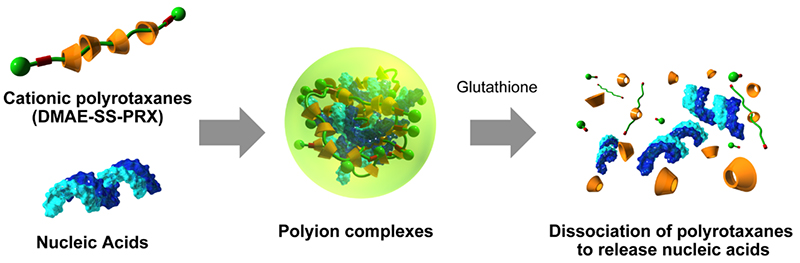
分解性ポリロタキサンの応用として、生体分子のドラッグデリバリーシステム(DDS)に関する研究を推進している。α-CD部位にカチオン性のN,N-ジメチルアミノエチル(DMAE)基を修飾したポリロタキサン(DMAE-PRX)は,アニオン性の生体分子である核酸や酸性タンパク質とポリイオンコンプレックスを形成する20-22。DMAE-PRXとイオンコンプレックスを形成することで表面が正電荷の複合体となるため、負電荷の細胞膜との相互作用が改善され、細胞内へ取り込まれにくい核酸や酸性タンパク質の細胞内導入効率を著しく向上することが可能である。しかし、細胞内の導入という観点では市販の導入試薬と同じ機能である。細胞内に到達後に生理活性を発現するためには、ポリイオンコンプレックスからの積極的なリリースが必須である。
細胞質では還元物質であるグルタチオンの濃度が細胞外環境と比較して三桁程高いことから、還元物質の濃度差に応じて分解応答を示すポリロタキサンは細胞でのポリイオンコンプレックスの崩壊、ならびにリリースを促進すると期待される。そこで、還元環境で特異的に切断されるジスルフィド結合を軸高分子中に導入したカチオン性ポリロタキサン(DMAE-SS-PRX)を合成し、生体分子の細胞内導入を行った(図 4)20。ホタル由来ルシフェラーゼ遺伝子を発現するプラスミドDNA(pDNA)とDMAE-SS-PRXを混合することでポリイオンコンプレックスを調整し、HeLa細胞に導入した。その結果,DMAE-SS-PRX/pDNA複合体は遺伝子導入効率に優れるpoly(etyleneimine)/pDNA複合体と同等の遺伝子発現量を示した。また,ジスルフィド結合を持たない非分解性のカチオン性ポリロタキサン(DMAE-PRX)を用いたpDNA複合体と遺伝子発現量を比較すると、DMAE-SS-PRX/pDNA複合体は三桁程高い遺伝子発現量を示したことから細胞内でのポリロタキサンの分解に伴うpDNAのリリースが遺伝子発現効率の亢進に寄与していると考えられる。また、DMAE-SS-PRXはpDNAの細胞内導入だけではなく、siRNAや酸性タンパク質の細胞内導入と生理活性の発現亢進にも有効であることを見出している21,22。
グルコース7分子からなるβ-シクロデキストリン(β-CD)の誘導体は、医薬品の賦形剤や、コレステロールを空洞部に包接することを利用した研究目的での試薬として用いられている。近年では、β-CD単独でアルツハイマー病や動脈硬化症などの疾患に対して治療効果を示すことが明らかにされ、医薬としての利用が注目を集めている23,24。特に、ライソゾーム病の一種であり細胞内にコレステロールの蓄積を生じるニーマンピック病C型(NPC病)に対しては臨床試験も進められている25-27。本疾患は生後より全身の細胞にコレステロールの蓄積が起こり、神経後退などの重篤な症状を示すが有効な治療法が確立されていない。2009年以降になって、高水溶性のβ-CD誘導体であるヒドロキシプロピルβ-CD(HP-β-CD)を投与したNPC病モデルマウスでは、組織中のコレステロール蓄積が低減され、神経機能の改善や生存期間の延長がもたらされることが明らかになった26,27。しかし,HP-β-CDの利用にはいくつかの問題点も指摘されている。例えば、HP-β-CDは分子量が1500程度であるため投与後速やかに腎排泄されるため十分な治療効果を得るためには非常に高投与量が必要となる。HP-β-CDは低毒性のβ-CD誘導体であるが、NPC病では非常に高濃度のHP-β-CDが投与されており、組織障害性や聴覚障害などの副作用が懸念されている27,28。β-CD誘導体による障害性は細胞膜中コレステロールの包接による膜障害性に起しており、NPC病の治療効果と副作用の機序が同一であることからβ-CD誘導体による障害性を低減することは容易ではない。
ここで,ポリロタキサンの構造はβ-CD空洞部が軸高分子で占有されているためコレステロールの包接は起こらず、傷害性が低減されると考えられる。また、分解性ポリロタキサンによってリソソーム局所で多数のβ-CDをリリースできればより効果的なコレステロールの排泄に繋がると期待される。このような仮説を基に、β-CDを包接した分解性ポリロタキサンの合成を行った。β-CDはpoly(propylene glycol)(PPG)と包接錯体を形成することから、PEG-b-PPG-b-PEGトリブロック共重合体を軸高分子として使用し、N-triphenylmethyl基で封鎖することでβ-CD/PEG-b-PPG-b-PEG型ポリロタキサンを設計した(図 5)29。また、水溶性向上のために、β-CD部位に2-(2-hydroxyethoxy)ethyl(HEE)基を修飾した(HEE-PRX)。本ポリロタキサンの封鎖基であるN-triphenylmethyl基はリソソームなどの酸性pH環境で脱離し、β-CDがリリースされる設計である。
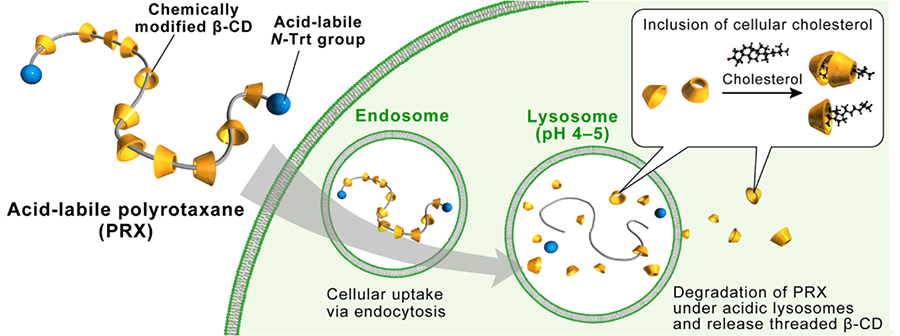
NPC病患者由来皮膚線維芽細胞を用いてHEE-PRXの細胞毒性とコレステロール蓄積への影響を調べた。HP-β-CDは高濃度で細胞膜から培地中へのコレステロールの引き抜きが起こり、細胞生存率が低下した。一方、HEE-PRXはコレステロールの引き抜きや細胞生存率の低下は認められなかったことより、β-CD空洞部が塞がれたポリロタキサン構造により障害性が回避されることが明らかになった。NPC病細胞では正常細胞と比較して2倍程度のコレステロール含量の増加が認められる。HEE-PRXはHP-β-CDと比較して約50分の1の濃度で細胞内コレステロール量を正常レベルまで低下させた。HEE-PRXは酸性pHのリソソーム中で分解し、局所的に多数のβ-CDをリリースすることでコレステロールの排泄を促進したと予想される。
次にNPC病モデルマウスに対するポリロタキサンのコレステロールの低下作用を検討した.8週齢のNPC病モデルマウスの肝臓中のコレステロール量を定量した結果、正常マウスと比較してNPC病モデルマウスは約10倍のコレステロールが蓄積していた。NPC病モデルマウスに対しHEE-PRXを週一回500 mg/kg投与した結果、組織中のコレステロール蓄積を有意に抑制した。同投与量でHP-β-CDを投与した結果、用量が既報(4,000~8,000 mg/kg)と比べて著しく低いため組織中のコレステロール含量に変化はなかった25,26。一方、3週齢よりHEE-PRXを500 mg/kgで週一回投与し続けた結果、NPC病モデルマウスの生存期間を2~3週間延長することが明らかになった。同用量のHP-β-CDでは有意な生存期間の変化は認められなかったことより、HP-β-CDでは治療効果が得られない低用量でもHEE-PRXは治療効果を示すことが明らかになった30。
このように細胞内分解性ポリロタキサンは、β-CD誘導体の問題点であった障害性を回避するとともに、低用量でもNPC病に対しコレステロールの蓄積を抑制し治療効果を示すことから、効果的な医薬として応用が期待される。つまり、ポリロタキサンの分解応答性を活かした新たな医薬設計は上述のβ-CD誘導体単独では決してなし得ない効果を明確に示して新領域を確実に拓いてきており、今後更に難治性代謝疾患治療のために臨床応用へ向けた研究が加速していくことを期待している。HEE-PRXによる細胞内コレステロールの低下作用は、NPC病治療だけではなく動脈硬化症等の生活習慣病治療に対しても有効であることを明らかにしている31。さらに、炎症応答の抑制31や破骨細胞分化の抑制32などの作用を示すことを見出しており、様々な疾患治療への応用が期待される。
分子可動性も分解応答性も、機械的連結様式を有するポリロタキサンならではの特徴を積極的に活用したバイオマテリアル機能設計の核心である。筆者らの研究は1993年に開始して以来30年が経過している。その間には分子可動性や分解応答性を活かして数多くの研究成果を挙げることが出来たが、実学としてのバイオマテリアルの社会実装まではいまだ道半ばなのも事実である。科学上のパラダイムシフトが思想-革命-完遂の3段階を経てもたらされることは歴史上の幾多の業績から明らかであるが、筆者らのポリロタキサン設計は思想-革命段階の最中であって、完遂のためには学術面での更なる共同研究と産業界との連携が不可欠である。科学とは後から来る誰かのためにある、それが科学者としてのノーブレスオブリージュである、そう意識して30年間研究を進めてきた。筆者らが半生を賭して得た研究成果をもとにして、筆者らが越えられなかった更に高い壁を次世代研究者が乗り越え、その結果としてポリロタキサン研究がバイオマテリアルの社会実装として昇華していくことを切に期待している。
ここで紹介したのは1993年から2023年までの30年間にわたって多くの先生方や学生諸君と実施した共同研究の成果であり、東京大学・石原一彦名誉教授、国立循環器病センター・山岡哲二元生体工学部長、北海道大学・原島秀吉名誉教授、東京工業大学・丸山 厚教授、神戸大学・大谷 亨准教授、日本医科大学・大石由美子教授、東京医科歯科大学・岸田晶夫教授、井関祥子教授、依田哲也教授、岩田隆紀教授、小野卓史教授、徐 知勲元助教(現・高麗大学准教授)、有坂慶紀元助教、西田 慶博士(現・東京工業大学助教)、利根川朝人博士、李 大勲博士、関谷瑠璃子博士、姜 泰雄博士、大橋 萌博士(現・PMDA)、張 順堯博士、福本いづみ博士、松井秀人博士、柴口 塊博士、寺内正彦博士、稲田大佳輔博士、兵頭克哉博士、益田洋輝博士、朱 虹霏博士、
Arun K. Rajendan博士、秤屋雅弘博士、三神 亮博士、田中裕香博士には謹んで感謝します。