
氏名:氏原 哲朗
協和発酵バイオ株式会社 生産技術研究所 主任研究員
2006年東京大学大学院総合文化研究科修士課程修了。同年協和発酵工業(株)入社。2015年東京大学大学院総合文化研究科博士課程修了(学術)。2019年 協和発酵バイオ株式会社主任研究員、現在に至る。ヒトミルクオリゴ糖を含めた微生物を用いた有用物質の大量生産に興味を持ち、製造プロセスの開発に取り組んでいる。

氏名:福本 一成
協和発酵バイオ株式会社 生産技術研究所 主任研究員
2006年東京大学大学院総合文化研究科修士課程修了。同年協和発酵工業(株)入社。2018年 協和発酵バイオ株式会社主任研究員、現在に至る。ヒトミルクオリゴ糖を含めた微生物を用いた有用物質の大量生産に興味を持ち、主に精製面での製造プロセスの開発に取り組んでいる。
ヒトミルクオリゴ糖(Human Milk Oiligosaccharide, HMO)はヒト母乳中に存在する250種類以上からなる多様な化合物で、母乳中ではラクトース、脂質についで3番目に多い固形成分である。しかしながら最近になるまでこれらのHMOの機能については、これらのHMOを安価に高純度に入手することができなかったために理解が進んでいなかった1。しかしながら技術革新によりこれまでに2'-フコシルラクトース(2’-FL)、 6’-シアリルラクトース(6’-SL)、 3’-シアリルラクトース(3’-SL)を初め数種類のHMOの工業的な製法が確立し、病原菌やウィルスの感染防止、腸管バリア機能の増強、抗炎症性などの免疫調整作用、腸内細菌の増殖制御、特に有用性腸内細菌ビフィズス菌の増殖促進、脳の発達など様々な生理機能が明らかになりつつある1,2,3。これまでに歴史的には天然からの抽出、酵素法、菌体反応法、直接発酵法が用いられており、現在は直接発酵法が一般的な製法となっている(図 1)。本稿では現在までのHMOの製法を俯瞰し、技術開発の歴史と今後の展望に関して概説する。

HMOは伝統的に母乳中から単離、精製され構造決定がなされてきた。また、牛乳からの抽出法については雪印のグループの報告があり、牛乳から乳糖を製造する際の副産物である乳糖母液中からの精製により製造することができると報告されている4。しかしながら牛乳中に存在するHMOは種類も量も限られているため天然からの抽出は商業的な利用を見据えたときには現実的な工業製法とはいえない。そのためHMOの効率的な製法が求められてきたが、その複雑な物性から達成は容易ではなかった。HMOは250種類以上からなる多様な構造を持つが、基本骨格としてはガラクトースとグルコースがβ1-4結合で結合したラクトースに、N-アセチルグルコサミン(GlcNAc)、フコース、N-アセチルノイラミン酸が付加されたもので、その結合順や結合位置、結合様式によって区別されている1。糖には多くの水酸基が存在するが、これらの糖同士を位置特異的に結合することは難易度が高く工業的な製法上の課題となっている。
工業製法としては化学合成による製法、酵素を用いた生物学的方法などが考案されていたが、両者ともに実験室レベルのグラムスケールまでは生産が可能であっても大規模なkg以上のスケールでの製造としては長い間有効な手法が知られていなかった。
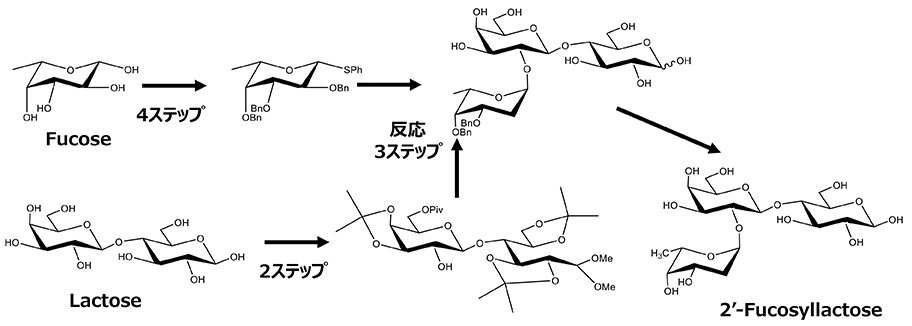
化学合成の方法としては、位置特異的な結合を可能とするために各種糖のもつ水酸基を保護基を用いて保護し、特異的な結合を形成した後に脱保護するという手法となる。これらの保護脱保護と、それに関わる精製のステップが煩雑であることが課題であったが、2005年から2012年の間にGlycom社が2'-FLとラクト-N-ネオテトラオース(LNnT)を化学合成により生産し、前臨床及び臨床試験に供することに成功している5。この時の2'-FLの合成法は1-S-フェニルフコースをドナーに、ラクトースの6'-O-pivaloateエステルをアクセプターにしたもので、この手法では結晶化して精製することなくクルードなアクセプターで反応できるということに特色がある。この手法を用いることで、精製ステップを最小にして合成することが可能になっている(図 2)。
このように化学合成でも一定の進展が見られたが、糖鎖の位置特異的な結合としては酵素的な生成が適していると考えられ、こちらでも技術開発が行われた。ヒトミルクオリゴ糖の合成に使われる酵素としては、大別すると加水分解酵素と糖転移酵素に分けられる。
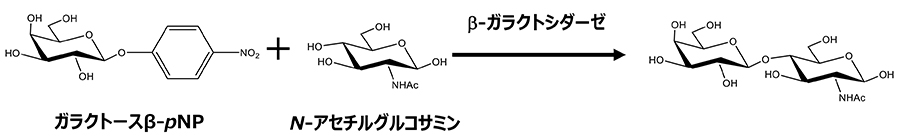
加水分解酵素はその名の通りオリゴ糖を加水分解する酵素の逆反応を活用したもので比較的容易に酵素が入手できるため実験室スケールでは比較的よく利用される手法である。加水分解反応は平衡反応であるため、加水分解されて出てくる単糖を高濃度になるように溶液を調整すると、平衡はその分解反応よりも合成反応に進むという原理を利用したものである。ただしこの手法では平衡反応であるという原則から未反応の基質が多量に残存することとなり効率が悪い。鰺坂らのグループではこの問題を解決するため、ドナーであるガラクトースをp-ニトロフェノールで修飾し、βガラクトシダーゼで加水分解する際に、多量にアクセプターであるGlcNAcを存在させることにより効率よくガラクトースをGlcNAcに転移させることに成功している6(図 3)。一方でこの方法でも収率は50%程度に留まっていたが、西本らのグループの研究では、ホスホリラーゼの逆反応を利用することでラクト-N-ビオースの生成を98%の収率で達成している7。
加水分解酵素を用いる手法に対し、生体内での糖鎖構造の生合成に関与する糖転移酵素を用いた合成法は、高い立体特異性と位置特異性をもって目的とする構造のオリゴ糖を合成することができ、保護基を導入することなく目的物以外の副生物を生じないという大きな長所がある。ただ、糖転移酵素の利用には二つのハードルがあった。一つは加水分解酵素に比べて酵素の入手が容易でないこと。もう一つは基質として、糖ヌクレオチドという高エネルギー化合物を必要とするという課題である(表 1)。オリゴ糖の糖転移酵素については当初哺乳類から多数のクローニング報告があったが、酵素の大量取得のために大腸菌で発現させようとすると大部分の酵素は活性発現が困難であった。2000年代から徐々に細菌にも哺乳類と同様なオリゴ糖構造が存在することが明らかになり、大腸菌での発現に適した細菌由来の糖転移酵素は魅力的な遺伝資源として注目を集めることになった。効率的な活性スクリーニング方法の開発と細菌のゲノム解析の急速な進展が起こったため、主に病原菌から糖転移酵素遺伝子がクローニングされ、米国ロックフェラー大学やカナダの研究機関などから次々と報告がなされた。それらの多くは大腸菌で活性のある可溶性タンパク質としての発現が可能であった。代表的なものは以下の通りである。髄膜炎菌であるNeisseria meningitidisからはガラクトース転移酵素や、N-アセチルグルコサミン転移酵素8、シアル酸転移酵素9が取得された。また代表的な食中毒菌であるCampylobacter jejuniからはシアル酸転移酵素10、フコース転移酵素はHelicobacter pyloriなどから取得された11。現在は各種データベースが充実しており、多数のバクテリア由来の糖転移酵素遺伝子が見出されている12。
表1 糖転移酵素と糖ヌクレオチド
| 糖転移酵素 | 糖ヌクレオチド |
|---|---|
| グルコース転移酵素 | UDP-Glc |
| ガラクトース転移酵素 | UDP-Gal |
| N-アセチルグルコサミン転移酵素 | UDP-GlcNAc |
| N-アセチルガラクトサミン転移酵素 | UDP-GalNAc |
| マンノース転移酵素 | GDP-Man |
| フコース転移酵素 | GDP-Fuc |
| シアル酸転移酵素 | CMP-NeuAc |
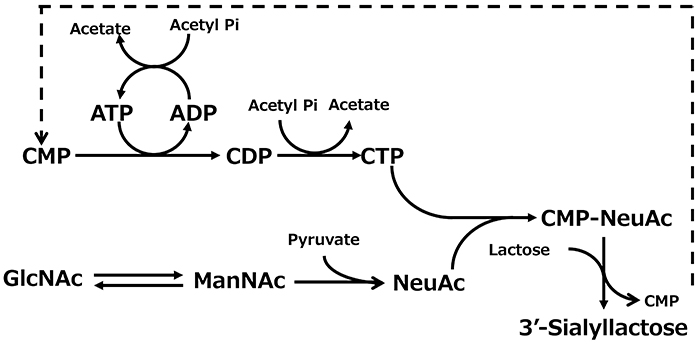
このように大腸菌で発現できる糖転移酵素が得られても二つ目の課題、糖ヌクレオチドを必要とするという課題が残る、糖ヌクレオチドは一般的に非常に高価であり、かつ安定性が低く糖転移酵素を用いたオリゴ糖生産の課題になっていた。韓国のGeneChem社は3'-SLを生産するために必要な糖ヌクレオチドCMP-シアル酸(CMP-NeuAc)を、比較的安価なN-アセチルグルコサミンとシチジンモノリン酸(CMP)などから合成することで、達成している13(図 4)。このGeneChem社の製法では、反応後に生成されるCMPをアセチルリン酸を用いたリサイクル系でCTPに再生することで効率的に反応を進行させている。
また、別のグループでは、CMP-シアル酸の生合成に関与するCMP-シアル酸合成酵素とα2,3-シアル酸転移酵素を融合させたタンパク質を創製し、両活性を有する酵素を利用して、3’-SLを100gスケールで合成できることが示された14。このように糖転移酵素を用いたオリゴ糖の大量合成が可能になってきたが、これらの方法では酵素の調整や糖ヌクレオチドを再生する際に別途特別な処理が必要となることから大量合成には限界があった。
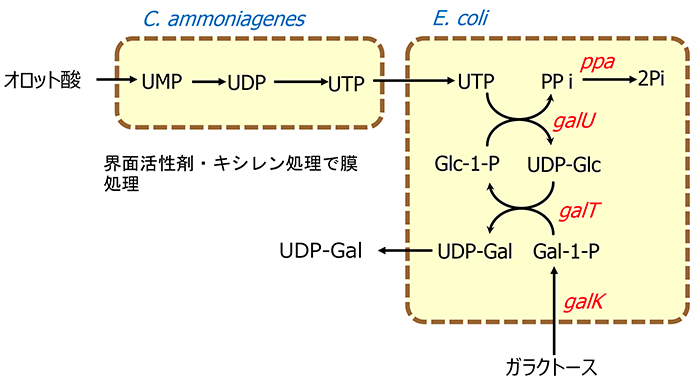
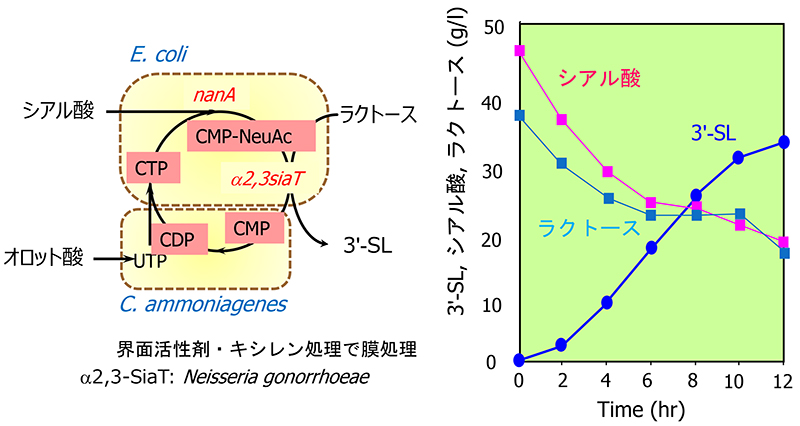
酵素の組み合わせによる糖ヌクレオチドの供給をより簡便に、効率的に行うために考案されたのが菌体反応法によるオリゴ糖の生産法である。菌体反応法とは精製酵素ではなく、細菌の菌体そのものを酵素の袋として利用するもので、酵素の精製の必要がなく簡便である。菌体自体を用いる酵素反応は界面活性剤や有機溶剤を用いて細菌の細胞膜に障害を与えて物質透過性を付与することで行われ、複数の細菌の菌体を組み合わせることで複雑な反応が可能となる。先の酵素反応ではリン酸化ヌクレオチドの再生のためのATPは外部やアセチルリン酸により供給されたが、この菌体反応系ではグルコースなどの安価糖源により供給されることが特徴である。例えば、ガラクトース転移酵素の基質となるUDP-ガラクトース(UDP-Gal)の生合成に関与する酵素を発現する組換え大腸菌とヌクレオシド5'-三リン酸の生産能が高いCorynebacterium ammoniagenesを酵素源として用い、ガラクトースと安価な核酸源であるオロット酸を主原料としたUDP-Gal生産系を構築したところ、21時間で44 g/lのUDP-Galの蓄積が認められた15(図 5)。同様に、CMP-シアル酸合成酵素およびCTP合成酵素を発現する組換え大腸菌とC. ammoniagenesを酵素源として用い、オロット酸とシアル酸を主原料にして、27時間で17g/lのCMP-NeuAcが蓄積した16。
このように構築した糖ヌクレオチド生産系に糖転移酵素を発現する大腸菌を加えることにより、オリゴ糖の生産系に拡張することが期待された。実際、CMP-NeuAc生産系にN. gonorrhoeae由来のα2,3-シアル酸転移酵素遺伝子を発現する大腸菌を組み込むことにより、3’-SLを11時間で33g/l蓄積させることができた16 (図 6)。また、UDP-Gal生産系にN. gonorrhoeae由来のα1,4-ガラクトース転移酵素遺伝子を発現する大腸菌を組み込むことにより、HMOではないが、病原性大腸菌O-157が生産するベロ毒素が認識するオリゴ糖構造であるグロボトリオース(Galα1-4Galβ1-4Glc)を36時間で188g/l蓄積させることができた15。
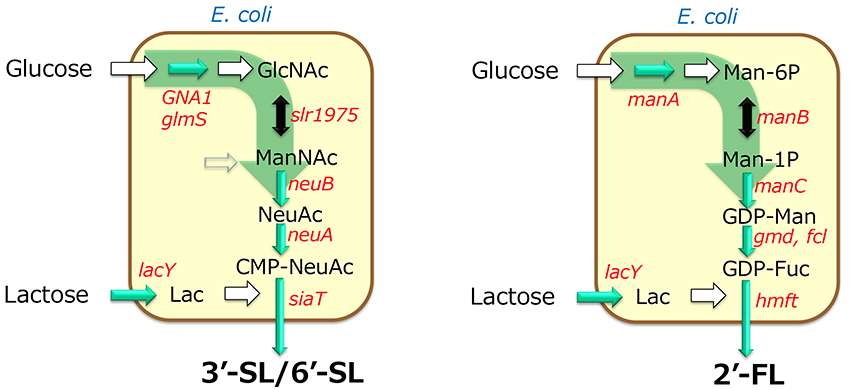
菌体反応によるオリゴ糖生産は、高価で不安定な基質である糖ヌクレオチドを用いる糖転移酵素のデメリットを微生物を用いて合成、再生することで補うものであり、オリゴ糖の工業的な大量生産が可能となる画期的なものであった。一方で複数の生産菌を組み合わせた製法は、製造設備としては複雑であり課題となった。そこで新たなオリゴ糖の生産法として菌体反応法をさらに押し進めて糖ヌクレオチドの合成、再生と糖転移酵素の発現を同一菌体で行うことで全ての反応を一菌体で賄う発酵法が考案された。この方法はアミノ酸などと同様微生物の培養と生産を同時に行い、生産物を培地中に蓄積させるもので設備的には一つの発酵槽で完結するため菌体反応に対して簡便な設備での生産が可能となる。例えば、3’-SLや6’-SLの生産においては、グルコサミン-6-リン酸シンターゼ(glmS)の活性強化と酵母由来のグルコサミン-6-リン酸N-アセチル転移酵素遺伝子(GNA1)の導入によりグルコースからN-アセチルグルコサミンへの生合成経路を構築し、さらにGlcNAc 2-エピメラーゼ、シアル酸合成酵素の遺伝子を導入することにより、グルコースを原料としてシアル酸を生産することが可能となった17 。さらに、このシアル酸生産菌にCMP-シアル酸合成酵素およびシアル酸転移酵素の遺伝子を導入することにより、3‘-SLおよび6’-SLの生産系を構築することに成功している17 (図 4)。また、GDP-フコース生合成系の改良とフコース転移酵素遺伝子を導入することにより、2ʹ-FLを生産する微生物はこれまでに多数報告されている(図 7)。
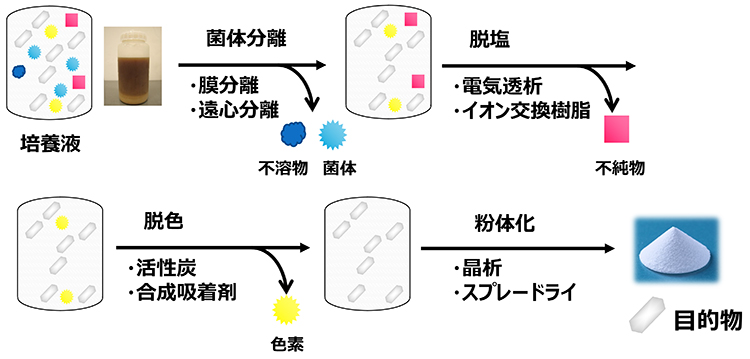
HMO製品は乳児用粉ミルクが主な用途であるため高い純度が要求される。一方でこれまでに述べてきた製法は程度に差はあれど不純物が発生するため精製し、粉体にする技術が必要となる。発酵法で得られた製品は、培養液中に溶解した状態で存在し、培地に由来する成分、菌体などの不純物を含んだ状態にある。ここから一般的には膜やフィルター、遠心分離などで菌体を除去し、その後にイオン交換樹脂や電気透析を用いて脱塩を行う。この工程で電荷をもつ塩や不純物を分離、除去することになる。さらに活性炭や合成吸着剤を用いて脱色し、着色を除いたのちに濃縮する。各社の申請書類を見ると、不純物の除去のためにクロマトグラフィー分離工程を入れる場合も見受けられる18 (図 8)。クロマトグラフィー分離の有効性は製品の性質に依存し、例えば電荷をもった3'-SL, 6'-SLといった酸性HMOの場合はイオン交換樹脂で一定の分離が期待できるが、2'-FL, LNnTなどの中性HMOでは電荷をもった化合物との分離しか期待できず、不純物との分離には疑似移動床クロマトグラフィーやゲルろ過クロマトグラフィーといった手法が必要になり、生産性の観点から課題が大きい19。菌体分離、脱塩、脱色が終わった濃縮液の最終的な粉体化の手法としては結晶化、スプレードライが考えられる。結晶化はクロマトグラフィーによる精製が難しい中性HMOにおいて純度向上の有効な手段で、各社が結晶特許を争って出願するなど一時は着目されたが、現在ではより生産性に優れたスプレードライを利用する企業も多い20。スプレードライは、液体原料を熱風中に噴霧して、瞬時に水分を蒸発させ、乾燥粉末を得る技術で、不純物の除去はできないものの生産性、収率の面で優れている。
化学合成法、酵素法、菌体反応法による時代を経て、現在の商業的に入手できるHMOの大部分が発酵法によるものと考えられる。例えばGlycom社は当初は化学合成で生産していたが、発酵法に切り替えているものと考えられる。発酵法以外の工業的HMOの例は今回も取り上げたGeneChem社など数が少なくなっている。種類に関してはこれまでに商業生産が確認できているHMOとして2’-FL, LNnT, 3’-SL, 6’-SLなどがあるが、今後はより複雑な構造のHMOも発酵法にて生産されるようになるものと考えられる。例えば5糖であるラクト- N-フコペンタオースI (LNFPI)については2’-FLとの混合物ではあるもののFDAへのGRAS申請が確認されている21。この場合、2’-FLなど3糖の生産の場合は大きな問題になっていないが、さらに鎖長が長いオリゴ糖の生産を考えた場合には、副生するオリゴ糖の生成制御は大きな課題となろう。特に電荷を持たない中性糖を生産する場合は副生するオリゴ糖を精製段階で分離することが困難であるため、培養段階での制御が肝心となる。今後さらに多くの種類のHMO種が供給されるようになることで、更に母乳に近い粉ミルクが実現することが期待される。また同時に、HMOが持つ生理学的な可能性の解明も進むことが期待される。