
氏名:平林 淳
東海国立大学機構名古屋大学 糖鎖生命コア研究所 特任教授
1982年東北大学修士取得後、帝京大学薬学部生物化学教室(笠井献一教授)に赴任、動物レクチンの研究に従事。1999年、GlycoXV(東京)にてグライコミクスを提起、2002年産業技術総合研究所(つくば)に異動、NEDO「糖鎖エンジニアリング」プロジェクト等に参画。2006年糖鎖医工学研究センター・副センター長、2012年幹細胞工学センター・首席研究員等を歴任。理学博士。現在、東海国立大学機構名古屋大学・糖鎖生命コア研究所にてプロジェクトマネージャー(Human Glycome)を担当。日本糖質学会理事、日本糖鎖科学コンソーシアム副会長、香川大学および横浜市立大学客員教授。
第1部ではガレクチンが細胞質タンパク質である点に着目し、その起源について述べた1。本章では、「糖が存在しなければレクチンは存在しない」との仮定の下で議論を進める。この前提に従えば、ガレクチンの誕生には、それに先行する糖リガンド、すなわちガラクトースの存在が不可欠となる。では、ガラクトースはいつ、いかにして発生したのか。本論では、著者が提唱した糖の起源仮説における「ガラクトース後生説」をベースに、その概略を述べる(詳細は文献1-4を参照)。
ガラクトースの起源を考える前に、周りを見てみよう。まず、自然界に存在する糖は基本的にᴅ-体だ注1)。では、自然界にすべてのᴅ-糖が存在するかというと、全くそうではない。たとえば、アルドヘキソースでは、ᴅ-Glc, ᴅ-Man, ᴅ-Galの三つのみ主要な糖として使われ他はほとんど見つからない。ケトースに至っては果糖(ᴅ-Fru)以外、お目にかかることは滅多にない。糖には理論的に多くの異性体が存在するが、自然界ではそのほんの一部しか使われていないのである。
注1)ʟ-体の表記をもつ糖として、ʟ-Ara、ʟ-Fuc、ʟ-IdoAなどがある。しかし、これらはいずれもᴅ-体の糖(ᴅ-Glcやᴅ-Man)を原料に生合成されたものである。なぜʟ-体表記になるかというと、最遠位の不斉炭素(4位、または5位)についた水酸基の向きが反転(エピメリ化)した結果、規定上、ʟ-体となるためである。
図 1にᴅ-アルドース系列の構造を示す。安定な椅子型構造とされる4C1コンフォメーションでそれぞれの構造を見比べたとき、自然界に存在するアルドヘキソースには、椅子型構造を不安定化する1,3-ジアキシャル相互作用注2)がほとんどないことに気づく。すなわち、グルコースではゼロ、マンノースとガラクトースでは一つであるが、他の単糖では二つ以上である。この立体障害によるエネルギーの増大(不安定化)は約0.5 kcal/molとされる。単糖の安定性を一概に1,3‐ジアキシャル相互作用の数だけで論じることはできないが、他の評価法で同様の結果が得られているかを検証することはできる。
注2)シクロヘキサンに代表されるように、ひとつ置きの位置(1,3位の関係)にアキシャル性の置換基がある場合、立体的な反発が起こりうる。置換基が大きくなるほどこの反発は強まり構造は不安定化する。ピラノースについても同様で、糖の種類(グルコースやマンノースなどジアステレオマーのレベル)やいずれの椅子型コンフォメーション(4C1か 1C4か)をとるかによって、1,3-ジアキシャル相互作用の程度は変わる。たとえば、グルコースにはC2, C3, C4, C5いずれにもアキシャル性置換基はないので(全エカトリアル配置)、1,3-ジアキシャル相互作用はない。これに対し、マンノースやガラクトースには一つのアキシャル水酸基があるので(マンノースではC2-OH、ガラクトースではC4-OH)、1,3-ジアキシャル相互作用は発生するものの最小レベルである。マンノースやガラクトースと同様、ひとつのアキシャル性水酸基をC3位にもつアロースでは(いずれもグルコースエピマー)、1,3-ジアキシャル相互作用が二つ生じる点に留意。
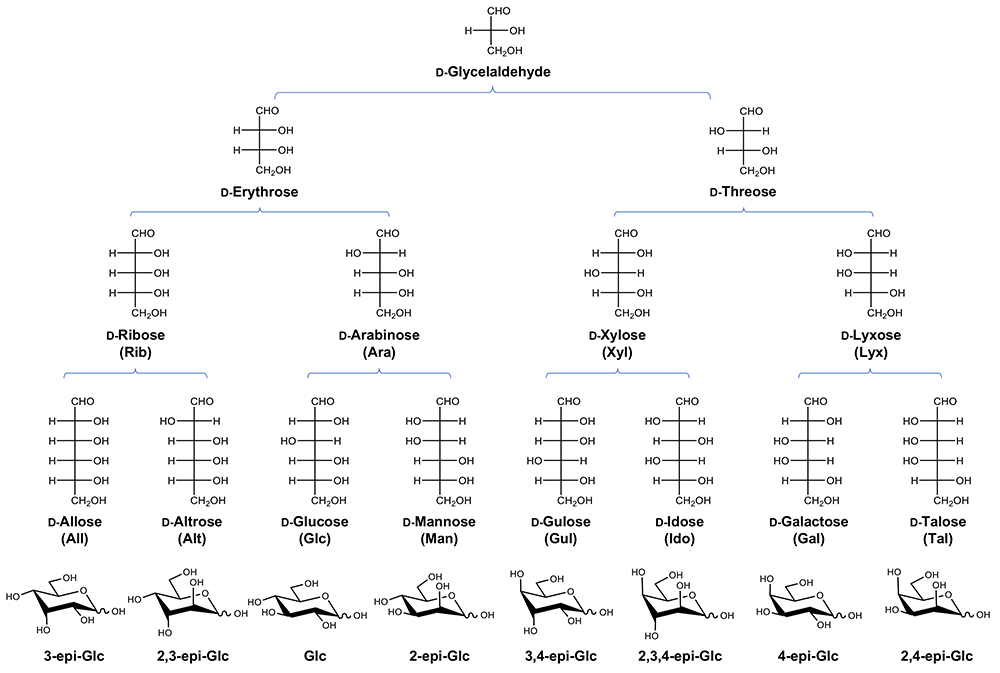
たとえば、アルドースにはピラノース環が閉じた構造(閉環型)と、環が開いてアルデヒド基が露出した構造(開環型)があるが、アルデヒドの存在を検出するポーラログラフィーという計測手法を行うと、様々な単糖で異なる値が得られる(表 1)。すなわち、グルコースでは、0.024%という非常に低い値を示すのに対し、1,3-ジアキシャル相互作用を1 個だけもつマンノースとガラクトースでは、その値は約3 倍に上昇する。興味深いことに、アキシャル水酸基がマンノースやガラクトースと等しく1 個だけのアロースではアルデヒド型の存在比(1.38%)がグルコースと比べ58 倍にも跳ね上がる。そして、アロースはᴅ/ʟ-体いずれも自然界にはほとんど存在しない。
| アルドース | アルデヒド型(%) | グルコースに対する相対比 | 1,3-ジアキシャル相互作用数 |
|---|---|---|---|
| (ヘキソース) | |||
| グルコース | 0.024 | 1 | 0 |
| マンノース | 0.064 | 2.7 | 1 |
| ガラクトース | 0.082 | 3.4 | 1 |
| アロース | 1.38 | 58 | 2 |
| (ペントース) | |||
| キシロース | 0.17 | 7.0 | 0 |
| アラビノース | 0.28 | 11 | 1 |
| リキソース | 0.40 | 17 | 1 |
| リボース | 8.5 | 354 | 2 |
話が前後するが、これは私が大学の研究室に赴任し、レクチンの研究に着手する際に感じた疑問だ。学生の時に習った単糖の名前は覚えきれない程たくさんあったので、当然、レクチンの方も、これらすべての糖に対するものが見つかるものと思っていた。しかし、当時の入門書や総説を調べると、レクチンの特異性を示す糖の種類はむしろ限られていた(表 2)。そして、この観察事実は現時点でもほぼ変わっていない5。実際、マンノースやガラクトースに結合するレクチンはたくさんあるが、イドースやアルトロースに結合するレクチンは文献を探しても見つからない。
| レクチン家系 | 主な生物分布 | 糖特異性 |
|---|---|---|
| ガレクチン | 動物 | Gal |
| マメ科レクチン(L型) | 植物、動物 | Glc, Man, Gal, Fuc, Sia |
| カルシウム依存性レクチン(C型) | 動物 | Man, Gal, Fuc (SLX) |
| シグレック(I型) | 動物 | Sia |
| リシンB鎖様レクチン(R型) | 植物、動物、微生物 | Gal, Sia |
| フコース特異的レクチン(F型) | 植物、動物、微生物 | Fuc |
| へべイン様レクチン | 植物、動物 | GlcNAc, Sia |
| GNA様レクチン | 植物、菌類 | Man |
| ジャカリン様レクチン | 植物、動物 | Man, Gal |
| AAL様レクチン | 微生物 | Fuc |
| インフルエンザウイルス(HA) | ウイルス | Sia |
さらに考察した結果、導かれた結論は以下二つである。
注3) Doyleら(1994)によれば、237種のレクチン(動物61種、植物154種、微生物22種)について単糖に対する親和性によって分類したとき、Gal/GalNAc特異的レクチンが145種(61%)、Glc/Man特異的レクチンが33種(14%)、GlcNAc(キトオリゴ糖)特異的レクチンが28種(12%)、ʟ-フコース特異的レクチンが16種(7%)、シアル酸特異的レクチンが15種(6%)であった6。その後、ゲノムからのレクチン探索や機能解析が進み、上記数値は変動すると思われるが、それでもガラクトース特異的レクチンの占める割合は最上位を保つと推測される。ただ、この理由の一つには、ガラクトース特異的レクチンを探すのに有利な道具(アシアロフェツインやラクトース固定化カラム)が研究者側に十分備わっていることも挙げられる。
1)については、ここでは自明の事項、すなわち大前提とする。
2)が事実だとすると、ガラクトースには他の単糖と異なる何か特別な性質があることになるが、これについては、前稿(第1部)で述べたとおりである。すなわち、ガラクトースには「認識糖」としての利点があり、このため、ガラクトースに対する認識系が多様に発達し、多様なレクチンが自然界で機能していると考えられる。事実、ガラクトースに結合するレクチンのタンパク質家系は多様であり、それぞれのガラクトースに対する特異性の詳細は異なっている1,7。ガレクチン個々の特異性にも有意な差が見つかっている8,9。
理論的にアルドヘキソースの数は16種類だが、実際に生物が使っているのは、主にブドウ糖(ᴅ-Glc)、マンノース(ᴅ-Man)、ガラクトース(ᴅ-Gal)の3種である。これらの糖が生合成上どのような関係をもつかを考えてみよう。
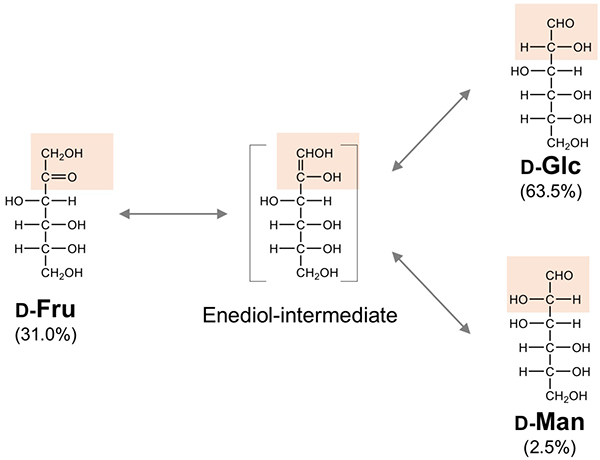
まず、ᴅ-Glcとᴅ-Manだが、これらは2位の炭素(C)についた水酸基の向きが異なる(C2エピマー)。この位置は1位、アルデヒド基の隣なので、化学的には特殊な位置である。昔から、ブドウ糖をアルカリ状態にしておくと一部がᴅ-Fruとᴅ-Manに転化することが知られている(図 2)。これを発見者の名前にちなんでLobry de Bruyn - Alberda van Ekenstein転位反応という10,11。この反応は酵素の介在無しに「化学的」に起こり、ケトースの工業生産にも使われる。本反応は塩基触媒によって進行する平衡反応なので、出発材料が何であっても、最終産物(ᴅ-Glc : ᴅ-Fru : ᴅ-Man)の比率は理論的に同じである(酵素の場合は特異的な異性化が起こる)。一方、ほとんどの生物はこれを触媒する酵素を保持している。
一方、ᴅ-Galもᴅ-Glcからつくられるが、上記Lobry de Bruyn転位とは様相が異なる(図 3)。第一に、反応の起点はアルデヒド基のある1位ではなく、反対側の4位である。ᴅ-Galとᴅ-Glcの違いは、4位に付いた水酸基の向きなので、これを逆にする必要がある(4-エピメリ化)。UDP-グルコース-4-エピメラーゼという酵素がこれを担うが、この酵素は、補酵素NAD+の助けを借りて、一度C4位を酸化、ケト体に変換する(ケト中間体)。次に、NAD+が引き抜いた水素(H-)をピラノース環の下側から添加することで、水酸基の反転(4-エピメリ化)が起こる。
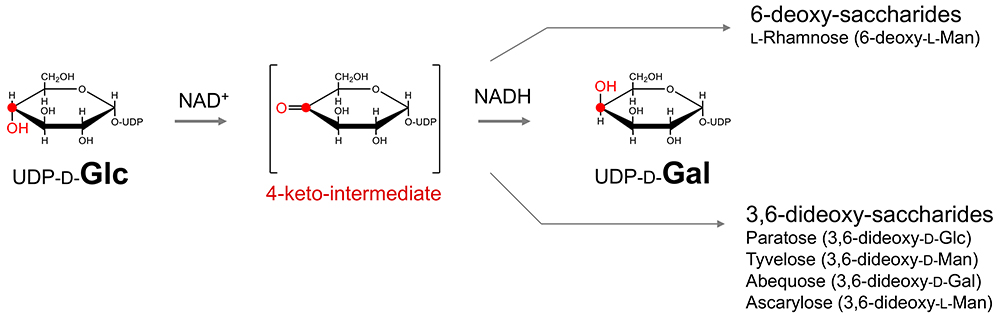
第二に、ピラノース環は開かず、閉じた状態のままで反応が進行する注4)。第三に、酸化還元反応を介したエピメリ化であり、このため補酵素NAD+が必要である。面白いことに、この4位のケト化を介した反応は、ガラクトースだけでなく、他の多くの糖やその誘導体への転換にも多用されている。このように、同じような反応様式を活用し、豊富にある、安価な原料(ブドウ糖など)から多種多様な物質を生み出す仕組みをブリコラージュ注5)と呼ぶ。
注4)上記Lobry de Bruyn転位ではアルデヒド基が異性化してC1-C2間でケトエノール互変異性を介して反応が進行するため、開環が必須であった点に留意。
注5)フランスの文化人類学者、C.レヴィ-ストロース(Claude Lévi-Strauss; 1908-2008)が用いた造語。未開人たちが身の回りの有り合わせの素材を組み合わせて様々な有用な道具を作り上げる様で、「鋳掛屋仕事」や「日曜大工」とも。設計図から製造するエンジニアリングと対比して使われる。
生物進化を考えたとき、4位のケト化は戦略的に重要である。なぜなら、それは4位のエピメリ化にとどまらず、4位周辺の「化学」を支配しうるからだ。たとえば、C4-C5間のケト―エノール互変異性を足掛かりにすれば、5位のエピメリ化や、さらにそれに伴う6位のデオキシ化が可能となる。事実、ʟ-フコースやʟ-ラムノースなどの6-デオキシ糖は4ケト中間体を経て生合成されている。
3位も同様で、パラトース(3,6-ジデオキシ-ᴅ-Glc)、アベコース(3,6-ジデオキシ-ᴅ-Gal)、コリトース(3,6-ジデオキシ-ʟ-Gal)、チベロース(3,6-ジデオキシ-ᴅ-Man)、アスカリロース(3,6-ジデオキシ-ʟ-Man)などの3,6-ジデオキシ糖を生成する際、4-ケト中間体が起点となっている。つまり、ピラノース環において、1位はアルデヒド基を介して2位の異性化(Glc→Man)を賄うが(C1戦略)、2位以外には手を出せない。一方、4位さえケト化できれば、ピラノース環にある他のすべて(3、4,5位)の異性化が可能となるのである(C4戦略)。まさに「オッカムの剃刀」注6)である。
注6)14世紀の哲学者、オッカムが多用した論法で「ある事項の説明には最低限の仮定を用いるべき」との教え。剃刀は不要な理屈をそぎ落とす意味で、「思考節約の原理」とも。
二つの異性化様式を比較すると、表 3のようになる。両者の共通点が異性化に際しカルボニル炭素(sp2状態)を、キラリティーを有するsp3に変換するということに注目したい。
| 1.Lobry de Bruyn転位を基盤とするアルカリ異性化(C1戦略) |
|---|
|
| 2.C4ケト化(酸化)を介した異性化(C4戦略) |
|
N型糖鎖は一番よく目にする糖鎖構造である。生合成が良く調べられていて、また、真核生物の間では共通の前駆体からつくられるなど、普遍性の高い構造だからだろう。ただ、なぜGlc3Man9GlcNAc2などという構造が真核生物共通の前駆体として選ばれたのか、その答えを見出すのは容易ではない。また、糖を勉強するうえで多くの人が混乱するのは、上記前駆体を共通構造としながらも、実際N型糖鎖は、プロセッシングという過程を経て高マンノース型から複合型へと変容を遂げる点だろう。この過程で9つあったマンノース残基の大半は切り落とされ、そこにラクトサミン構造(Galβ1-4GlcNAc)が枝を分ける形で複数配置され、さらにフコース(ʟ-Fuc)やシアル酸(Neu5AcまたはNeu5Gcなど)が付加されるなどして、異質で多種多様な構造体へと衣替えをする12。なぜこんな労力を払うのか。また、上に述べた成熟プロセスはヒトなどの哺乳類に当てはまるもので、他の生物では別の成熟(種独自の進化)を遂げていることが知られている。それでもそこで使われている原料(単糖の種類)はほぼ不変である。
さて、その理解が難しい前駆体構造のなかで、ひとつ注目すべき点は還元末端におけるキトビオース構造(GlcNAcβ1-4GlcNAcβ-Asn)の存在である。ここで大胆な仮説を提唱する。それは、前駆体構造に登場する単糖は進化の段階を反映し、順次登場するということだ。早い段階に誕生した糖ほど根本(還元末端側)に、新しく登場した糖ほど先端(非還元末端側)に配置される。この発想の根底にあるのは、生物学における「終端付加(terminal addition)則」である13-15。進化の新しい段階で付加された形質は、それまでにあった形質に後付けされる、とする経験則である。
糖鎖の合成(組み立て)は小胞体とゴルジ体という細胞内小器官で行われるが、そこに配置される数百種類と言われる糖転移酵素が順次、単糖を転移して糖鎖が出来上がっていく。N型糖鎖の構造は単糖が誕生し、生物に取り込まれていった順序を、おおよそ反映していると言えないか。進化の早い段階から存在し、糖鎖メンバーの古参だったと考えられるᴅ-Glcやᴅ-GlcNAcは根本の位置をどっかりと占め、次にᴅ-Man(これはLobry de Bruyn転位でᴅ-Glcから生成)、そして新参者のᴅ-Galという具合に。これが著者の唱える「ガラクトース後生説」である2-4。
ちなみに、根本がキトビオースというのは意味深である。なぜなら、キチンは最も古い多糖の一つと考えられるからだ。キチンはGlcNAcがβ1-4結合で直線的につながった構造だが、これは全バクテリアが共通して持つペプチドグリカンの主骨格(GlcNAcβ1-4MurNAcβ1-4)と同一である注7)。
注7)MurNAcはGlcNAcの3位が乳酸でペンタペプチドへと架橋するのに必要な修飾糖で、骨格構造的にはキチンと同一。ただ、バクテリアのペプチドグリカン生合成では転移酵素によってGlcNAcとMurNAcがつながっていくため、キチンが前駆体になっているわけではない。GlcNAcの起源は、原始生物(細胞)が代謝活動の結果排出するアンモニアを無毒化するため、安価なブドウ糖が毒消し剤として使われたと考えることもできる。
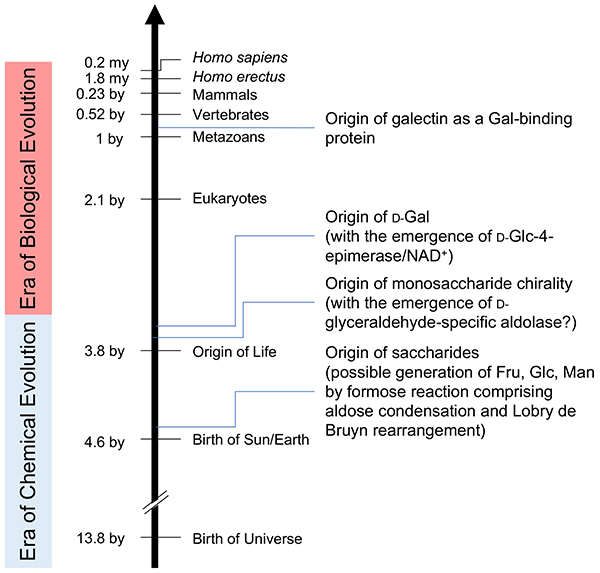
前節で述べたように1、仮に、ガラクトース結合能を備えたガレクチンが、後生動物の誕生した約10億年前に登場したとすると、ガレクチンのパートナーであるガラクトースはそれまでにすでに存在し、少なくとも一部の生物が合成し、利活用していたはずである。「なぜ、βガラクトシドなのか」は、また別の未解決問題(unsolved question)として、上で述べたガラクトースの生合成系が、4ケト中間体を経た、すなわち、NAD+を介した酸化還元反応によって成り立つことを考えると、その誕生は少なくとも、生命誕生後である(38億年前以降)。
一方、ガラクトースの原料であるブドウ糖(ᴅ-Glc)は、上述のLobry de Bruyn転位を基盤とする化学反応によって生成しうる。なぜなら、糖の前生物合成として、現在唯一知られるホルモース反応では、原始大気中での存在が想定されるホルムアルデヒド(HCOH)の重合反応によって、グリセルアルデヒドやジヒドロキシアセトンなどの三炭糖が生成、これらがさらにアルドール縮合によってケトース(フラクトース)が生成することが確認されている(図 4)。フラクトースがLobry de Bruyn転位を起こせばグルコースは容易に生成する。糖は一般に還元性を持ち、アミノ酸やペプチドのアミノ基と化学的に反応するため、原始地球環境で安定に存在しうるのかということが懸念されるが、上述のように、グルコースは糖の中にあってもっとも安定な化合物である。このことを考えると、まだ生命誕生の前、すなわち化学進化の時代に、原始地球のどこかでグルコースが比較的大量に蓄積した可能性は十分考えられる。そして、これが生命誕生に際し、有効に利用されたと考えることができないだろうか。
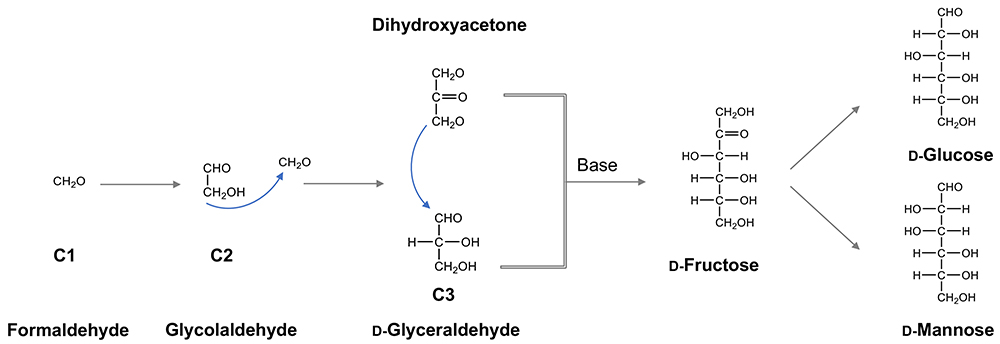
キラリティーの問題についても少しだけ触れておく。原始地球上で誕生したグルコースやフラクトースはいずれもᴅ-体とʟ-体の混在するラセミ体であった可能性が高い。しかし、上述のアルドール縮合(グリセルアルデヒドとジヒドロキシアセトンからフラクトースを含むケトヘキソースを生成)を触媒する原始酵素が、最初の原始生命によって生み出された、としたらどうだろう。その原始生命はᴅ-体かʟ-体のグリセルアルデヒドのいずれかを選択するため、生じるフラクトースはそのキラリティーを保持することになる(スキーム1)。すなわち、現在の生物に共通するᴅ-体の起源は、最初の原始生命が採用した原始アルドラーゼのᴅ-選択性に準拠することになる。
ᴅ-グリセルアルデヒド+ジヒドロキシアセトン → ᴅ-Fru → ᴅ-Glc → ᴅ-Gal
ʟ-グリセルアルデヒド+ジヒドロキシアセトン → ʟ-Fru → ʟ-Glc → ʟ-Gal
スキーム1.ホルモース反応におけるキラリティーの保存ホルモース反応における反応メカニズムでは、ᴅ-系列の糖(ᴅ-グリセルアルデヒド)からはᴅ-体のみが生成し、ʟ-系列の糖(ʟ-グリセルアルデヒド)からはʟ-体のみが生成する。ガラクトース結合能を獲得したガレクチンの起源は後生動物の誕生する10億年前以降と推定される。ᴅ-GlcからNAD+を補酵素として高効率に合成されるようになったᴅ-Galの起源は38億年前以降と推定される。グルコースの起源は生命誕生前の化学進化の時代(38億年前以前)にさかのぼるが、ラセミ体からᴅ-Glcが選択されるのは原始生命が編み出した最初のアルドラーゼによってであろう(38億年前以降)。糖の前生物合成の観点から、その生成原理をアルドール縮合、Lobry de Bruyn転位を包含するホルモース反応に求めるなら、グルコースの生成の一瞬前にフラクトースが生成する。ガラクトースとガレクチンの起源を含む進化の全容を図 5に示す。
本稿作成にあたり図の作成や議論に参加、協力してくれた東京化成工業の岩城隼博士、ならびに秋田県立大学の鈴木龍一郎博士に感謝いたします。また、原稿作成にあたり、議論に加わり有益なアドバイスをいただいた笠井献一博士(帝京大学名誉教授)や共同編集者の佐藤祥子博士(ケベックシティ、Laval University)に感謝します。