氏名:三善 英知
大阪大学大学院医学系研究科 生体情報科学講座
がんの悪性化に伴い糖鎖が変化することは古くから知られて来た。今日、約300種類存在すると言われる糖転移酵素の中でGnT-V(N-アセチルグルコサミン転移酵素V)は、最も癌の転移に深く関与すると言われている。GnT-Vノックアウトマウスの研究から、GnT-Vが癌の転移に必須の分子であることが証明された1。すなわち、GnT-Vノックアウトマウスと乳癌を自然発生する他のトランスジェニックマウスを交配させると、コントロールでは癌転移が見られたのに対して、GnT-Vノックアウトマウスでは腫瘍の増殖と転移が著しく抑制された。また、GnT-Vは癌転移のみならず、肝発癌過程で癌化の初期にも発現が上昇するために、発癌にも深く関与することが推測されていた2。発癌の初期に関与する生命現象と言えば、まず考えられるのが細胞の不死化と血管新生である。1993年、アメリカのPierceと日本の谷口らによってGnT-Vのタンパク精製、遺伝子クローニングがなされて以来、GnT-Vのもつユニークな血管新生作用が発見されたのは、10年後のことであった3。しかも、そのメカニズムは、糖転移酵素としてのGnT-Vの機能とは全く別の可溶型GnT-Vの生物機能であった。一般的に糖転移酵素は細胞内のゴルジ装置に局在し、糖タンパク質/糖脂質の糖鎖修飾に関与する。ところが糖転移酵素はヒトの血清中にも存在し(しかも酵素活性を有する)、種々の疾患や病態のマーカーとしての有用性が報告されてきた。何らかのプロテアーゼの機能によりゴルジ装置から切断された糖転移酵素は、培養細胞のMedium中やヒト血清中に存在する。これを可溶型糖転移酵素とよぶ。GnT-Vの場合、この可溶型糖転移酵素に血管新生という驚くべき生物機能があった。すなわち、GnT-Vのアミノ酸配列の中で264-269番目に存在するKRKRKKとう塩基性richなドメインが、細胞外マトリクスに存在するbFGFの遊離を促進し、血管新生につながるというものである(図 1 参照)。 細胞外マトリクスを形成するヘパラン硫酸などのプロテオグリカンには、種々のサイトカインや増殖因子が結合している。塩基性にチャージしたGnT-Vのドメインが、これらの遊離と活性化に関与するなら、可溶型GnT-Vのもつ生物機能は血管新生に留まらず、実に多様なものとなり得るであろう。さらにGnT-Vの切断に関与するプロテアーゼの同定は、今後の糖鎖生物学とがんの研究に大きな意味をもつと考えられる。
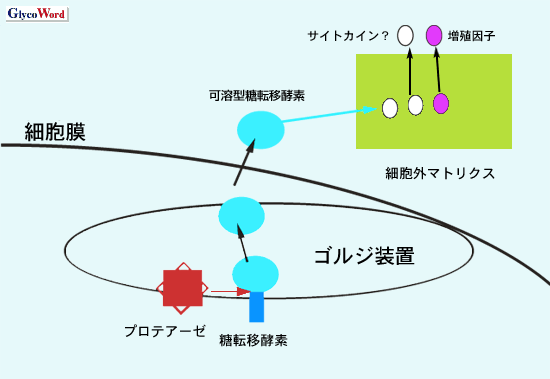
図 1 可溶型糖転移酵素の生物学的機能