
氏名:眞鍋 史乃
星薬科大学・東北大学大学院薬学研究科医薬品開発研究センター
1996年東京大学大学院薬学系研究科博士課程修了、1996年4月東京大学薬学部教務補佐員、1996年10月理化学研究所基礎科学特別研究員、2000年理化学研究所研究員、2019年東北大学薬学系研究科医薬品開発研究センター教授(クロスアポイントメント)、2020年星薬科大学薬学部教授、現在に至る。
立体選択的グリコシル化反応の開発、生物活性糖鎖/複合糖質合成などの有機化学による糖鎖合成を専門とする。
近年、抗体医薬品の市場は拡大しており、抗体の機能を強化する技術として糖鎖改変が注目されている。特に、IgGのFc領域に存在するN-結合型糖鎖の構造を制御することで、抗体依存性細胞傷害活性(ADCC)の向上や体内動態の改善が可能となる。従来の糖鎖構造解析では、結合位置や組み合わせの情報が失われるという課題があったが、近年、エンド型グリコシダーゼを用いたIgGの糖鎖均一化技術が開発され、より厳密な糖鎖改変が実現されつつある。さらに、抗体糖鎖改変技術は、均一な構造を持つ抗体–薬物複合体(antibody-drug conjugate: ADC)の作製にも応用された。本稿では、IgGの糖鎖改変技術に関する最新の研究成果について概説する。
近年、医薬品市場における抗体医薬品のシェアは着実に拡大している。IgGには、Fc領域のAsn297に普遍的に1対のN-結合型糖鎖が付加されており、この糖鎖の構造を自在に制御・変換することで、抗体の機能を強化し、新たな医薬品の開発が期待されている。例えば、コアフコースを欠損させることで抗体依存性細胞傷害活性(antibody-dependent cellular cytotoxicity; ADCC)を50〜100倍向上させる技術は、現在臨床応用されている最も成功した糖鎖改変抗体の基盤である1。また、IgGの糖鎖構造は、体内動態や熱的安定性に影響を与えることが知られており、さらに抗体産生細胞に由来するN-グリコリルノイラミン酸やGalα1,3-Galといった非ヒト型糖鎖構造が免疫原性を有することも報告されている2。
N-結合型糖鎖は、その生合成経路が多段階かつ複雑であるため、不均一な構造の化合物群として存在する。この特性は、治療用抗体においても顕著であり、バッチごとに糖鎖構造の割合が異なることが知られている3。従来の糖鎖を抗体から切り出しての解析では、糖タンパク質から糖鎖を切り出して行う手法に限定されていたため、糖鎖の結合位置情報や組み合わせが失われるという課題があった。これらの情報の欠如は、糖タンパク質構造の正確な決定を妨げ、糖鎖構造と抗体機能との明確な相関を導き出す障壁となっていた。
この課題を克服するために、IgGの糖鎖均一化法が開発された4。IgGの糖鎖均一化は、以下のステップで行われる。まず、元々存在する不均一糖鎖をエンド型グリコシダーゼであるENGase(Endo-β-N-acetylglucosaminidase)を用いてキトビオースの間の結合を切断し、還元末端のN-アセチルグルコサミンのみを残して除去する。このプロセスにより、不均一な非還元末端部分および免疫原性のある部分が除去される。これまでに多くのENGaseが単離されているが、IgG糖鎖改変にはEndoSやEndo S2、およびその改変体が用いられることが多い5。次に、糖鎖を切断したIgGに対して、均一な構造を持つ糖鎖を改変ENGaseを用いて付加する。ここで使用される改変ENGaseは、元来のENGaseの加水分解活性を抑えつつ、糖鎖付加能力を保持したものである。糖鎖供与体として、加水分解中間体アナログのオキサゾリン糖鎖が用いられる。さらに、この抗体改変プロセスは産業化を見据え、フロー合成技術による自動化も報告された6。この糖鎖改変技術は、後述する均一な構造を持つ抗体・薬物複合体の創製にも応用されている。
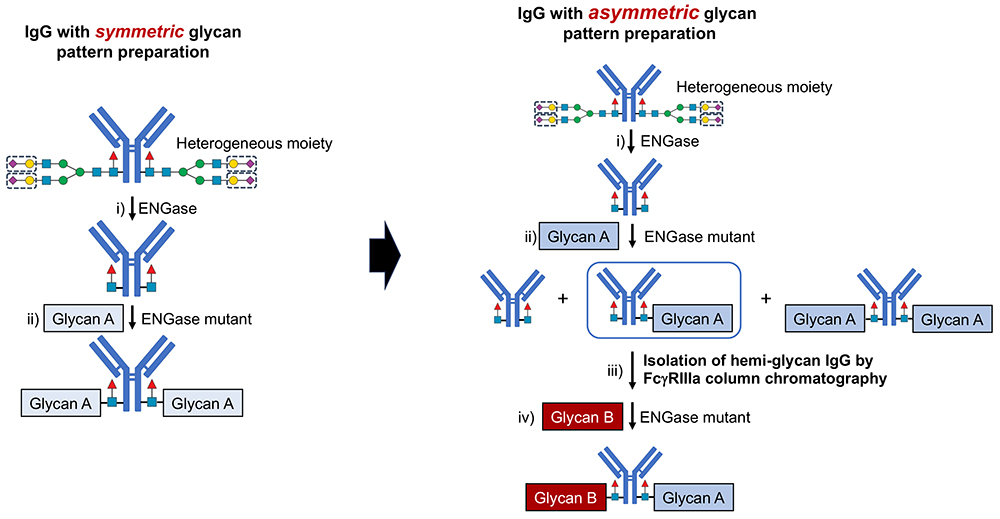
一方、従来の糖鎖均一IgG作製法では、1対の糖鎖が同じもの(対称型)しか作製できないという制約があった。しかし、実際のIgGでは、1対の糖鎖が異なるもの(非対称型)が大部分を占める。非対称型糖鎖均一IgGの作製方法は未開拓の領域であった。
我々は、FcγRIIIaアフィニティークロマトグラフィーを用いた解析においてIgGが持つ糖鎖の本数によって保持時間が大きく変化することを独自に発見した。IgGのADCCは、FcγRIIIaを介した抗体結合によってエフェクター細胞が活性化され、サイトカインやパーフォリン、グランザイムなどの顆粒内容物の放出を通じて標的細胞を破壊する。このADCCと密接に関係するFcγRIIIaアフィニティークロマトグラフィーは、IgGのADCCを測定可能なカラムとして開発されたものである7。
この知見を基に、FcγRIIIaアフィニティークロマトグラフィーを用いて1本鎖糖鎖IgGを単離し、異なる構造の糖鎖を付加することで、非対称糖鎖均一IgGを作製する手法を開発した。この方法を活用し、最も広く使用されている抗体医薬品であるトラスツズマブに対して、66種類の糖鎖均一ライブラリーを作製することに成功した8。
作製した糖鎖均一トラスツズマブに対してADCCを測定した結果、対称型の糖鎖構造を持つものの中に高いADCCを示す1種類、非対称型の中に高いADCCを示す10種類を見出した。さらに、ガラクトースの数が0個 (G0)または1個 (G1a-F, G1b-F) の場合よりも、2個 (G2) の場合のほうがADCCが強くなることが確認された。興味深いことに、ガラクトースの数が同じであっても、Manα1-6鎖を持つG1a-Fのほうが、Manα1-3鎖を持つG1b-Fよりも高いADCCを示した。同様に、シアル酸およびガラクトースの数が同じ場合でも、Manα1-6鎖を持つA1a-Fのほうが、Manα1-3鎖を持つA1b-FよりもADCCが高いことが確認された。また、シアル酸の熱的安定性に関して示差走査熱量測定 (DSC: differential scanning calorimetry) を行った結果、A1b、A1b-Gal、M3シリーズにおいて、Tm(融解温度)とΔH(エンタルピー変化)の間に正比例の関係があることを見出した。さらに、1種類の糖鎖構造を除外すると、A1aおよびA1a-Galにおいても同様の正比例関係が確認された。これは、従来行われてきた、糖鎖をタンパク質から切り出して解析する手法では明らかにできなかった現象であり、糖タンパク質そのものを測定する手法の優位性を示す重要な知見となった。
ADCは、高い殺細胞効果を有する薬物をリンカーを介して抗体に結合させたものであり、がん治療において極めて有望な治療モダリティとして注目されている。作用機序は、enhanced permeability and retention(EPR)効果9によりがん新生血管から漏れ出たADCが、腫瘍組織に浸透し、標的抗原を発現するがん細胞表面に結合することに始まる。その後、細胞内へ取り込まれたADCから主にリソソーム内の特定の酵素により薬物が放出され、標的細胞の破壊を引き起こす。ADCは、ドラッグ・デリバリー・システム(DDS)の概念に基づいた高精度な化学療法の一形態と位置づけられる。
現行のADCの多くは、システイン(Cys)またはリシン(Lys)残基を介したランダムコンジュゲーションにより薬物が結合されている。しかし、この方法では1抗体あたりの薬物の数や結合位置を制御できず、構造の不均一性が生じる。実際、薬物の結合位置の違いがADCの安定性や薬物動態に影響を及ぼすことが報告されており、均一な構造を持つADCの作製はtherapeutic windowの拡大に寄与する重要な戦略と考えられる。また、ランダムコンジュゲーションによる混合物では、製造の再現性が低く、品質管理の観点からも課題がある。このため、特定の部位に選択的に薬物を結合させる部位特異的コンジュゲーション(site-specific conjugation)技術の開発が進められている。この技術により、均一な構造を持つADCを安定的に製造することが可能となる。
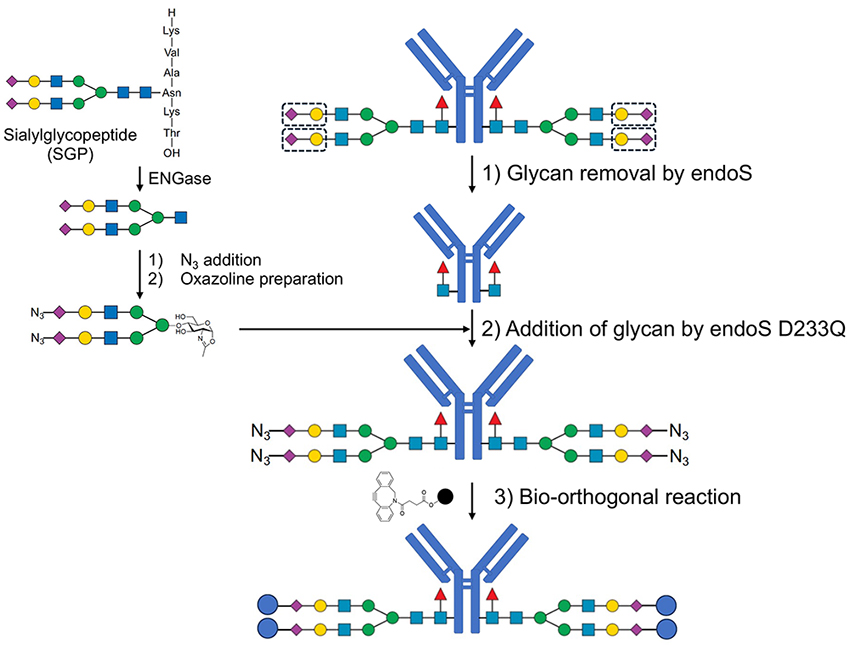
我々は、上記の糖鎖改変技術を活用し、糖鎖部位に特異的にpayloadを結合させることで、均一構造を持つADCの作製を試みた10。まず、卵黄由来のN-結合型糖鎖のシアル酸カルボキシ基にアミド結合を介してアジド基を導入し、その後、還元末端をオキサゾリン化することで、修飾可能な糖鎖を得た11。次に、Fc糖鎖をEndoSで一旦切断したトラスツズマブに対し、変異型EndoS D233Qを用いることで、アジド基を導入した糖鎖を再付加し、均一な糖鎖構造を有する抗体を作製した。この抗体に、歪みを持つアルキン基を有するpayloadを生体直交反応により結合することで、均一構造のADCを構築した。
得られたADCの生物活性を評価したところ、HER2高発現細胞株(SK-BR3、OE-19、N-87)に対して高い殺細胞効果を示し、一方でHER2低発現細胞株(MKN-45、MCF-7)に対してはほぼ活性を示さなかった。さらに、FcγRIIIaカラムクロマトグラフィーを用いた解析において、糖鎖部位でpaylaod を連結したADCアナログは糖鎖構造が均一であることによりADCCの制御が可能であることを確認した12。現在、in vivoにおける抗腫瘍効果についても検討を進めている。
抗体の糖鎖改変技術を活用し、均一な糖鎖構造を持つIgGの作製と、その医薬品開発への応用可能性を検討した。特に、糖鎖の制御によるADCCの向上や体内動態の最適化が可能であることを示し、糖鎖均一化技術の有用性を明らかにした。さらに、この技術を応用し、均一な構造を持つ抗体–薬物複合体(ADC)の作製にも成功し、標的細胞に対する選択的な殺細胞効果を確認した。今後、糖鎖改変技術をさらに発展させ、より高機能なバイオ医薬品の開発を推進することで、がん治療をはじめとする様々な疾患に対する新たな治療戦略の確立が期待される。