
氏名:小川 雅廣
香川大学農学部 教授
1993年 上智大学大学院理工学研究科修士課程修了、1996年 博士(理学)、1996年から2年間JSPS海外特別研究員(University of British Columbia派遣)、その後、Louisiana State University、University of Guelphで博士研究員を経て、2004年から香川大学農学部に勤務、2009年より現職。専門分野は食品科学。食品のおいしさと健康機能に興味がある。

氏名:佐藤 正資
香川大学農学部 教授
1994年筑波大学大学院農学研究科博士課程単位取得退学、同年から香川大学農学部助手として勤務、1997年博士(農学)。2010年より現職。専門分野は生物活性天然物化学。C. elegansなどを用いて希少糖の新たな生物活性の探索に取り組んでいる。

氏名:秋光 和也
香川大学 理事・副学長 国際希少糖研究教育機構 機構長
1992年ミシガン州立大学大学院博士課程修了(Ph.D.)。MSU-DOE Plant Research Laboratoryで2年間ポスドク研究員後、1994年より香川大学農学部で教鞭をとり、希少糖学や植物病理学が専門。2021年農学部長を経て、2023年より現職。
本誌の希少糖シリーズ「Rare Sugars」では、まず「希少糖とは」というトピックで定義・分類や自然界における希少糖の役割を説明し、原始地球における希少糖の位置付けから現代にいたるまでの希少糖の歴史を紹介した。次には、体系化された希少糖の生産戦略図「イズモリング」の考案とその進化の変遷を紹介し、希少糖自体の結晶構造に関する物理化学的特性や、生産に用いる微生物由来の酵素の特徴を概説してきた。さらに、前々回からは希少糖の用途開発に関する解説を進め、医療分野での用途開発の最前線として抗がん作用や糖尿病および肥満症への医療応用を紹介した。今回は、食品分野の用途における希少糖D-アルロースの特徴、希少糖のアンチエイジング効果、農業分野で利用する際の用途の可能性等についてそれぞれ概説する。
近年、D-アルロースを使用した加工食品が市場に出回り始めている。D-アルロースは異性化糖の主成分であるD-フルクトースとD-グルコースの異性体であるが、血糖値の上昇を抑える作用や脂肪の燃焼を促進する効果を持つことから、機能性表示食品として消費者庁に届出されている。これらの機能特性により、D-アルロースを砂糖(以下、ショ糖とする)や異性化糖の代わりに使用した食品が開発され、健康意識の高い消費者をターゲットに販売されている。食品に糖を加える理由は、エネルギー供給、甘味の付与、食品の保存性向上、テクスチャー改善、発酵の促進などである。このように多様な食品特性を持つ糖であるが、D-アルロースを食品に使用するとショ糖とは異なる性質を示す。
まず、エネルギーについてであるが、D-アルロースのエネルギー換算係数はショ糖の10分の1と極めて低く、食品成分表示ではゼロキロカロリーと表示できる1。そのため、糖であるのに食品に添加してもカロリーが増えないのが特徴の一つである。甘味度についてはショ糖の7割程度で、清涼感とキレのある甘味を呈する。
テクスチャーについては、和菓子やパンなどデンプンを多く含む食品においてD-アルロースはショ糖とは異なる性質を示す。一例として餅への効果を紹介する。求肥や白玉団子に使用する糖をショ糖からD-アルロースに代えると柔らかくなる2,3。これは餅の中のデンプンに対する糖の作用の強さがD-アルロースとショ糖で異なることによる。餅の原料であるもち米のデンプンを水と加熱することで、デンプン分子は規則性を失い糊状になるが、糊化を開始する温度はショ糖からD-アルロースに代えることで低くなる。これにより、より多くの水分子をデンプン鎖に取り込むことができるため柔らかくなると考えられている3-5。もう一つの特徴は、餅が保存中に硬くなるのを遅らせる効果が強いことである。糖にはもともと餅の硬化を遅延させる効果があるが、D-アルロースはショ糖よりもその効果が強く、既存の糖の中でも特に強いとされるトレハロースと同等かそれ以上の効果を持つ2,3。これはD-アルロースがもち米デンプンの老化抑制に優れていることによる4。興味深いことに、D-アルロースの異性体であるD-フルクトースやD-グルコースの老化抑制効果は小さい3,4。もち米以外のデンプンについても同様に調べてみると、うるち米などアミロペクチン含有比率の高いデンプンに対してD-アルロースは他の糖よりも優れた老化抑制効果を示すが、アミロペクチン含有比率の比較的低いジャガイモ、小麦、タピオカ、トウモロコシ由来のデンプンに対しては、ショ糖と同程度の老化抑制効果しかない4。D-アルロースはデンプンの中でもアミロペクチンに対しての老化抑制効果が他の糖よりも優れているためと考えられる6。
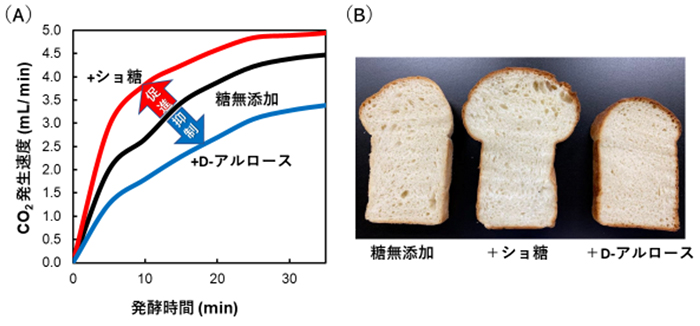
発酵については、パン生地の発酵を例として挙げると、D-アルロースはショ糖とは真逆の性質を示す。パン生地の発酵過程では、酵母が小麦粉のデンプン由来の糖質(D-グルコースなど)を基質としてアルコール発酵を行い、エタノール(C2H5OH)と二酸化炭素(CO2)を発生させる。酵母から排出されたCO2によって、パン生地が膨らむ。パン生地にショ糖を添加して発酵を行うと、CO2の発生量が増えるのに対し、D-アルロースの添加ではCO2の発生量は糖を加えていないときよりも減少する7(図 1A)。そのため、D-アルロースを使用するとパン生地は膨らまず硬いパンになってしまう7(図 1B)。生地が膨らまないのはD-アルロースがパン酵母のアルコール発酵の基質と競合阻害をするためと示唆されている。競合阻害であるため、D-アルロースと同時にショ糖を生地に加えることで、発酵阻害は解消され、柔らかいパンをつくることができる8。
D-アルロースを使用した食品は、その低カロリー性と健康効果だけでなく、テクスチャーの改善効果もあり、ショ糖や異性化糖の代替糖として今後ますます食品への利用が増えていくと予想される。しかしながら、発酵阻害のようなことが起こることから、必要に応じて工夫する必要がある。
カロリー制限(calorie restriction, CR)は、実験動物において寿命を延ばし、加齢に伴う変化や加齢性疾患の進行を遅らせることが知られており9、老化に対抗する最も有効な方法の一つとされている。しかし、実生活で長期間のCRを続けることは非常に難しいため、 摂取することでCRと同様のアンチエイジング効果が得られるカロリー制限模倣物質(calorie restriction mimetic, CRM)の開発が注目されている10,11。CRMは代謝調節や遺伝子の発現をコントロールし、抗メタボリックシンドローム効果や抗腫瘍効果を発揮し、結果的に老化を遅延させる物質である.著者らはゼロカロリー糖質あるD-アルロースがCRMの候補になると考え、老化研究に用いられる線虫Caenorhabditis elegansを用いて抗老化効果の検証を行った。
線虫C. elegansを、D-アルロースを含んだ液体培地で大腸菌を餌に培養し、寿命を計測した。餌のみの対照線虫と比較したところ、10mMと25mMのD-アルロースを処理した場合、線虫の平均寿命はそれぞれ12%と7%延長した12。また、D-アルロースがCR効果によって線虫寿命を延長したかを確認するため、摂食量が制限された遺伝的CRモデル線虫(eat-2変異株)を用いたが、D-アルロースは、この変異株の寿命をさらに延ばさなかった。この結果から、D-アルロースによる寿命延長はCR効果によるものと考えられた12。寿命延長が認められる濃度のD-アルロースは、処理線虫のAMP/ATP比を上昇させ、細胞内のエネルギーレベルを低下させた(佐藤、 未発表)。
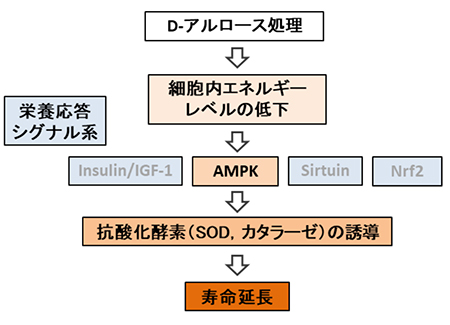
D-アルロースのCR効果が、どのようなシグナル伝達系を介して発現しているか解析するために、以下の4種の栄養応答シグナル関連遺伝子欠損株、daf-16(インスリン/IGF-1シグナル下流の転写因子、forkhead box O(FOXO)ホモログ)、aak-2(AMPKホモログ)、sir-2.1(サーチュイン、silent information regulator-1(SIRT1)ホモログ)、skn-1(nuclear factor erythroid 2-related factor 2(Nrf2)ホモログ)を用いて寿命試験を行った。その結果、aak-2変異株のみに、寿命延長効果が認められず、D-アルロースの効果はAMPKシグナル経路に依存していることが示された12。また、D-アルロースは、線虫の抗酸化酵素(superoxide dismutase(SOD)、カタラーゼ)のmRNA発現量と酵素活性を高めることも確認された12。以上から、D-アルロースによる線虫の寿命延長効果は、①細胞内エネルギーレベルの低下、②AMPKシグナルの活性化、 ③抗酸化酵素の発現増強によるストレス耐性向上によって発現すると考えられた(図 2)。
一方、D-グルコースのC-3エピマーである希少糖D-アロースは、28mMの濃度において、線虫の平均寿命を24%延長した13。D-アルロースと比較すると、D-アロースの寿命延長効果はより強い可能性がある。D-アルロースと同様の変異株を用いた寿命試験では、daf-16とsir-2.1の変異株の寿命を延長しなかった。このことから、D-アロースの寿命延長メカニズムは、D-アルロースとは異なり、インスリン/IGF-1シグナルとサーチュインに依存することが明らかになった13。
CR効果を模倣するアンチエイジング物質CRMの開発は、老化研究の重要な目標の一つであり、現在、 多くのCRM候補物質が研究されている。しかし、CRMが動物の寿命を延ばすメカニズムやシグナル伝達経路は複雑で、物質ごとに異なることがわかっている9-11。また、希少糖についても、細胞内への取り込みやその後の代謝、代謝物による酵素阻害などについては、ほとんど解明されていない。これらの作用機序の全貌を明らかにすることが今後の課題である。他のCRM候補に比べて、希少糖の大きな利点はその毒性が極めて低く14,15、食品カテゴリーでの産業化が可能な点である。今後は、CRMとしての寿命延長効果に焦点を当てた哺乳動物での効果確認が望まれる。希少糖の中から十分なCR効果をもつ物質を見出すことができれば、ヒトの健康寿命延長に大きく貢献できると期待される。
地球上に存在する「単糖」の大部分を占めるD-グルコースは、植物において光合成で生産される。そのため、植物と糖質との関りは深い。光合成とは、植物の葉にあるクロロフィルという色素が、太陽光の光のエネルギーを化学エネルギーに変換し、水と二酸化炭素からD-グルコースを作り出す過程である。光合成は2つの主な段階に分けられるが、最初の段階は光化学反応(または光反応)で、クロロフィルが光エネルギーを吸収して、葉の細胞内の水分(H2O)を分解する。これにより、酸素(O2)が放出され、ATP(アデノシン三リン酸)やNADPH(還元型ニコチンアミドアデニンジヌクレオチド)が生成される。次の段階はカルビン回路(暗反応または光非依存反応)で、光のエネルギーにより生産されたATPとNADPHが使われ、本回路では空気中の二酸化炭素(CO2)が植物に取り込まれ、これがATPとNADPHのエネルギーを使ってD-グルコース(C6H12O6)に変換される。D-グルコースは、植物を含むすべての生物がエネルギー源として使用し、生長や発達に利用されるが、植物自身は生産後すぐにエネルギー源として使うだけでなく、デンプンやセルロースなどに変換して植物中で貯蔵する。貯蔵されたこれらの糖類は、植物が光合成を行わない時期や暗い場所でエネルギー源として利用され、さらにデンプンやセルロースの形で貯蔵された糖質は、他の生物に資化されエネルギー源になったり、紙・パルプのような産業資源になったりして有効に利用される。
地球上には40万種類以上の植物が存在すると言われているが、すべての植物は上記の光合成で、D-グルコースを生産するが、Itea属のズイナは希少糖のD-アルロースやアリトールを生産することが知られている16。ズイナは、落葉性の低木または小高木として知られ、主に東アジアや北アメリカに分布し、日本でも自生している種類があり、湿った場所や川辺などで見られる。ズイナがどのようにD-アルロースやアリトールを生産しているのかは、非常に興味深い研究課題で、香川大学を中心に精力的な研究が進んでいる。これまでに、暗下ではD-アルロース量はさほど変化しないが、アリトール量は著しく減少することや、明下でアリトールが急激に合成されるなど、光合成との関りを示唆する報告があり17、さらに微生物であるEnterobacter agglomerans株221eは、D-アルロースをアリトールに変換出来ることが示され18、ズイナにおいても両希少糖間には同様の反応系が存在する可能性もある(秋光ら、未発表)。
D-アルロースとアリトールが含まれるズイナ葉の乾燥パウダーを5%飼料に混ぜて、高脂肪食を与えたラットの体脂肪蓄積に対する効果が調べられ、興味深い結果が報告された19。飼料中に5%の乾燥ズイナ葉パウダー(0.4%のD-アルロースと0.6%のアリトールを含むことになる)を添加したものと、添加しないものを、それぞれラットに自由に8週間摂取させて比較した結果、乾燥ズイナ葉パウダーを含む飼料を摂取したラット群の腹腔内脂肪組織および総体脂肪の割合は、含まなかった飼料を摂取したラット群よりも有意に低かったことから、D-アルロースとアリトールが含まれるズイナ葉の乾燥パウダーには抗肥満効果があることが示唆された19。そこで、ズイナ葉に含まれるD-アルロースとアリトールの同時摂取効果がさらに検討され、ラットに3%アリトール、3%D-アルロース、または3%アリトール+3%D-アルロース含有餌を8週間自由摂取させて、これらの糖を含まないコントロール群と比較された20。その結果、D-アルロースは、最終体重、体重増加、腎周囲脂肪組織、腸間膜脂肪組織、総腹部脂肪組織の量を有意に低下させ、アリトールは腸間膜脂肪組織重量を有意に減少させた20。しかし、D-アルロースとアリトールの腹部脂肪全体に対する複合効果は認められず、またアリトールの腸内発酵性が高いことが示唆され、D-アルロースとアリトールは異なるメカニズムで抗肥満作用を示し、非相乗的であることが示唆されている20。動物への作用性とは別に、ズイナ葉成分の鱗翅目昆虫幼虫の成長に対する作用も調べられ、葉抽出エキス由来のアリトールおよびD-アルロースは、Ephestia kuehniella Zeller(鱗翅目:Pyralidae)の幼虫に対する成長阻害作用があると報告された21。アリトールとD-アルロースのEC50値はそれぞれ15.7 mg/g dietと30.3 mg/g dietと報告され、D-アルロースは既に食品として使われており、安全性が高く、アリトールも一定の安全性が既に報告22されていることから、双方とも新しいコンセプトの殺虫試薬に利用できる可能性が示された21。

上記のD-アルロースの昆虫幼虫の成長抑制に関する報告21より前から、約50種類ある希少糖の中でも、D-アルロース、D-アロース、D-タガトースは、植物に対する耐病性・生長抑制の誘導作用や、植物病原菌に対する直接的な抗菌作用で、農業での利用の可能性が長く考えられてきている23-29。D-アルロースやD-アロースを植物の根から吸わせたり、葉面に散布したりすると、一過的な生長抑制が誘導され、また植物の持つ防御に関連する遺伝子群の発現を誘導し、植物病原菌に対する植物の防御機能の活性化により、病害耐性を誘起することも明らかにされてきている23-28。また、D-タガトースは、D-アルロース、D-アロースのように植物に影響を及ぼすことは無いが、菌に直接作用することで病害防除剤としての利用が可能であると考えられ、農業に多大な被害を与えている「べと病」を引き起こす病原菌を用いて、その作用機構の解析が進められた29。べと病菌を含む卵菌類の糸状菌の菌壁成分には、マンナンおよびD-マンノース代謝経路で生産される関連物質が多く含まれ、これらの成分の欠損や減少は菌生育の阻害に直結する29。D-タガトースは、このマンノース代謝経路の第一段階であるD-フルクトースからD-フルクトース6-リン酸(F6P)へのフルクトキナーゼによるリン酸化反応を阻害し、さらにD-タガトース自体もフラクトキナーゼによりD-タガトース6-リン酸(T6P)に変換されることが明らかにされた29。生成されたT6Pは、さらに同代謝経路のホスホマンノースイソメラーゼを阻害することにより、解糖系の基質であるD-グルコース6-リン酸とF6P、およびマンナンおよび関連産物の合成に必要なD-マンノース6-リン酸の減少も連続的に引き起こし、代謝経路の各段階で連続的な阻害が引き起こされることにより、べと病菌の初期感染や、分生子・分生胞子形成などに必須な菌壁形成を阻害することが明らかにされている29。
D-アルロース、D-アロースの作用で紹介した植物防御反応の誘導および抑草活性や、D-タガトースで紹介した菌に直接作用する殺菌・制菌活性は、農業資材としての利用に非常に有効な可能性を秘めている。これら3種の希少糖は、安全性が高く、D-アルロース、D-タガトースに関しては、既に食品としてグローバルに販売されている事から、希少糖はこれまでの化学農薬とは全く概念の異なる農業資材となる。
希少糖シリーズで様々な方向から希少糖の特性や機能が紹介される中、本稿では用途開発に向けて、食品、アンチエイジング、農業利用の分野でそれぞれ明らかにされてきたいくつかの希少糖特性を紹介した。希少糖の用途開発は、当初食品分野に限られると考えられてきたが、元々糖質は広い産業分野で用いられてきたこともあり、香川大学では国際希少糖研究教育機構を軸に、現在使われている糖質を希少糖に置き換えるコンセプトで、広い産業分野での用途開発研究が進んでいる。食品分野では、すでに16カ国でD-アルロースの販売が可能になり、グローバル展開が始まっているが、食品分野以外でも、医療分野、農業分野、工業分野等で、興味深い研究成果が異なるスピード感で出てきており、本稿ではその一部を紹介させて頂いた。今後もそれらの特性を生かした商品開発がさらに進み、希少糖の社会実装が進むことを期待している。そのためには、大学研究のみならず、産官学がタイトに連携し、それぞれの持ち味を生かした進め方が、社会実装の実現には極めて重要である。希少糖の実用化に向けて、幸いこの連携関係は極めて有効に機能している。次回は、本誌における希少糖シリーズ連載の最終回*として、希少糖開発に関係してきた産学連携の流れについてご紹介したい。
(*編者注:本シリーズは一旦最終回となり、以降は不定期連載に切り替わります。)
本稿作成にあたり関係者に感謝する。