
氏名:平井 剛
九州大学大学院薬学研究院 教授
1997年に東北大学理学部化学系を卒業後、2002年に同大学大学院理学系研究科化学専攻博士後期課程を修了し、博士(理学)を取得(指導教員は平間正博教授)。2002年東北大学多元物質科学研究所の助手(袖岡幹子教授)を経て、2004年から理化学研究所袖岡有機合成化学研究室の研究員、2010年に同研究室で専任研究員として従事。2016年から現職。
2013年有機合成化学協会奨励賞、2014年GlycoTOKYO奨励賞。
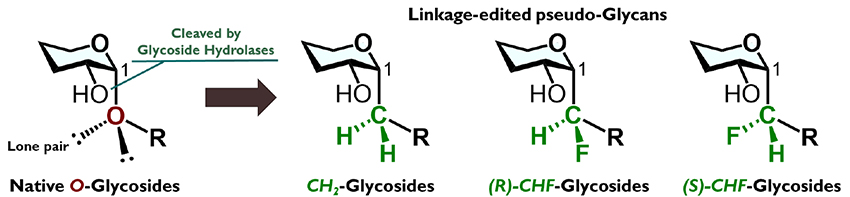
糖鎖を構成するO-グリコシド結合をC-グリコシド結合に置き換えると、本来の構造をあまり変えることなく、糖加水分解酵素に対して耐性を獲得したアナログを創出することができると考えられる。さらにC-グリコシド結合には置換基を導入できるため、糖鎖構造を多様な連結様式で組み立てることができる。本稿では、シンプルなCH2基で連結された糖鎖だけでなく、立体的には似通っているものの電子的に異なる性質をもつCHF基で連結された糖鎖アナログについて紹介する。「連結部編集」を実現するための合成方法論と、それによって糖鎖の生物機能はどのように変わるのか、について現時点までの知見をまとめたい。
糖鎖や複合糖質は、構成単位である単糖やアグリコン構造がO-グリコシド結合で連結された構造を持つ。生体内に存在する糖加水分解酵素は、それぞれの基質選択性に応じてO-グリコシド結合を切断する1。これにより糖鎖は分解されるため、その機能が消失・変化することになる。細胞内での恒常性維持を担う現象の1つであるが、糖鎖を創薬応用する上ではこの分解は活性消失を意味するため、糖加水分解酵素に耐性をもつ糖鎖アナログが考案された。当初は、O-グリコシド結合をS-グリコシド結合に変えたアナログが提案された2。この元素置換戦略は合成化学的観点からは効率的であるが、結合長や結合角が大きく異なる糖鎖構造となるため、たとえ生物活性が発揮されたとしても、アナログとして果たして適切なのか、という疑問が残る。構造類似性を考慮すると、C-グリコシド結合の採用が最も合理的と考えられる。なお私達は、このタイプのアナログをC-グリコシド型(炭素連結型)擬糖鎖としている。
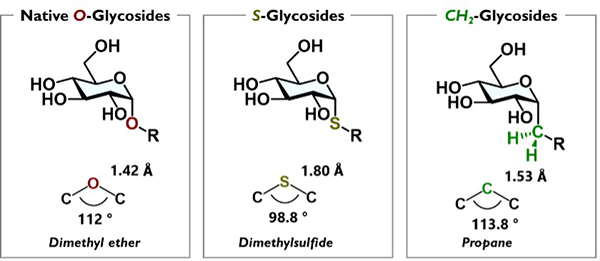
2004年にFranckらは、CH2連結型α-ガラクトシルセラミドアナログ(擬α-GalCer、CH2-α-GalCer)の合成を報告した。興味深いことに、擬α-GalCerはα-GalCerの100倍程度高い抗腫瘍活性、1000倍程度高い抗マラリア活性をin vivoで示した3,4。C-グリコシド型擬糖鎖が創薬リードとなりうるポテンシャルを持つことを示す重要な結果である。しかし、一般的にC-グリコシド型擬糖鎖の合成は煩雑であり、工程数を要する場合が多い。比較的簡便に合成できる単糖構造のC-グリコシドアナログや、エキソ型糖加水分解酵素が切断しない還元末端にC-グリコシド結合をもつ糖鎖アナログの報告は多いが、私達が考える糖加水分解酵素で切断される連結部をC-グリコシドに置換した“分解耐性”をもつ擬糖鎖の開発は、依然として発展途上である5–7。またその機能に関しても、レクチンなどとの相互作用の解析にとどまっており、生物活性・機能を解析した例は擬α-GalCerを除くとごく限定的である8,9。
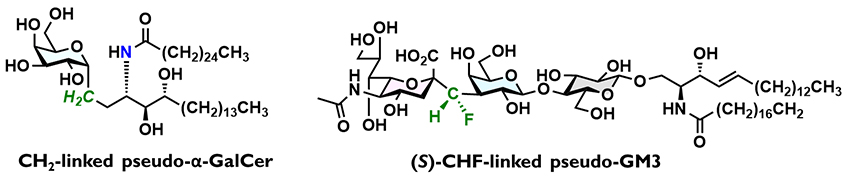
私達は、最初にガングリオシドGM3のC-グリコシド型擬糖鎖の創製に取り組んだ10–12。GM3は、シアル酸のグリコシド結合が最初にシアリダーゼに切断されるため、この位置をC-グリコシド結合とすることとした。この際、シアル酸部の酸性度の調整とグリコシド結合の回転(コンフォメーション)制御を考慮し、従来のCH2基だけでなく、F原子を導入したCF2基やCHF基も候補とした。実際に4種の擬GM3を合成しその生物活性を評価したところ、CHF連結型が天然型よりも高い活性を示した。また、(S)-CHF連結型(図 2)のほうが(R)-CHF連結型をわずかに上回る活性を持つことが判明した。CF2連結型はシアル酸に近い酸性度となり、CHF連結型、CH2連結型の順に酸性度は下がる。一方で、CH2連結型はグリコシド結合の回転が柔軟になり、F原子を導入するとゴーシュ効果13や双極子反発によって配座が制限される。これらを総合すると、(S)-CHF連結型は酸性度的に妥当であり、また(S)-CHF基が“活性配座を安定化する”ため、高い生物活性を示したと解釈した。創薬化学的発想に基づき、「糖鎖は他の生体分子とある“特定配座”で相互作用し、生物活性を発揮している」と捉えていたので、この考察に至ったとも言える。
糖鎖連結部を種々変えた擬糖鎖の分子設計概念を、私達は連結部編集戦略と呼んでいる(図 3)。様々な糖鎖に対して連結部編集戦略を適用すれば、生体内で分解されず、かつ“配座制御効果”によってより高い生物活性を示す擬糖鎖を創製できると、当初は考えていた。
天然型糖鎖の生物活性にはある特定配座が関与する、という前提は正しいだろうか。
O-グリコシド結合は単結合なので回転可能であり、分子全体はよく動いている14。一方で、立体的・電子的な反発とO-グリコシド結合の立体電子効果(エキソアノマー効果)によって、安定化を受ける配座がいくつか存在する15。糖鎖は柔軟であるが、ある“安定な配座”が他の生体分子との相互作用に関与することで、生物活性を発揮していると考えると合理的に思える。しかし、その配座自由度のため“特定配座”での相互作用はエントロピー的に不利となり、生体はそのコストは払って生物現象を発揮していることになる。自然が配座柔軟性の高い糖鎖を、第三の生命鎖として選択したことに何か意味があるのではないだろうか。
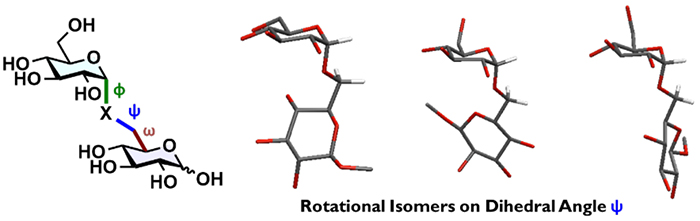
安定配座ではなく、配座柔軟性・配座分布が生物活性に重要と仮定すると、連結部編集の意味が大きく変わる。CH2連結型擬糖鎖は、連結部に立体電子効果がないので、天然型よりも配座分布が広い。CHF連絡型擬糖鎖はF原子によって配座制御を受け、その立体化学によって配座分布に偏りが生じるはずである。天然型とC-グリコシド型擬糖鎖は構造的には似通っているが、配座分布は全く異なる分子となる。配座分布の違いが分子の動きの変化に繋がり、最終的には生物活性の変化につながるはずである。擬GM3のように活性増強につながる場合もあれば、活性が消失する可能性や、異なるフェノタイプを与えることも考えられる。言い換えると、C-グリコシド型擬糖鎖創製は分解耐性を獲得した糖鎖模倣分子の設計戦略だけではなく、糖鎖を基盤とした新規生物活性分子の創製戦略となる可能性を秘めていると考えるようになった。
そこで、様々な糖鎖で連結部編集型擬糖鎖を合成し、上記仮説を検証することを考えた。実現のためには、効率的合成法の開発が必須となる。糖鎖や複合糖質を構成する官能基を維持したまま、分子間カップリング反応でC-グリコシド結合を構築する、直接C-グリコシル化(direct C-glycosylation)法の開発に取り組んできた。私達は2016年からアノマー位ラジカルを活用した直接C-グリコシル化による立体選択的な擬糖鎖合成を目指して検討してきた16–18。
ここではブロモ糖をドナー糖として、ブロモフルオロオレフィン部を組み込んだアクセプターとの還元的カップリング反応を説明する。MacMillanらが報告していたIr光触媒とNi触媒、さらにハロゲン原子移動(XAT)試薬としてスーパーシラノール(TMS)3SiOHを用いる還元的カップリング反応を参考に、反応条件を最適化した19,20。この際、グルコースの2,3位水酸基を環状カーボネートで保護したドナー1を用いると、アクセプター(ここではモデル化合物2)とのカップリング反応がα選択的に進行し、フルオロビニルC-グリコシド構造3を好収率で得ることができる(図 5)。カーボネート保護によって、生じるアノマー位ラジカル種の配座はいす型に制御される。この際、アノマー効果によってα配向性の(sp3性)ラジカル4が優位に生じ、立体選択性が発現すると考えられる21–23。対照的に、ドナー5とアクセプター2を同条件で光照射すると、目的物6の収率と立体選択性は大幅に低下した。5の場合、生じるラジカル種8は舟型配座となるため、スピンはα、β両方向に配向する(sp2性)ラジカルとなる(Quasi-Homo-アノマー効果)。また、2位水酸基がアシル基で保護されているため、アシロキシ転位によって熱力学的に安定な2級ラジカル9となることも知られている。実際、ラジカル9由来の生成物7も生じていることから、環状カーボネート保護は反応性と立体選択性に重要な役割を担っていることがわかる。
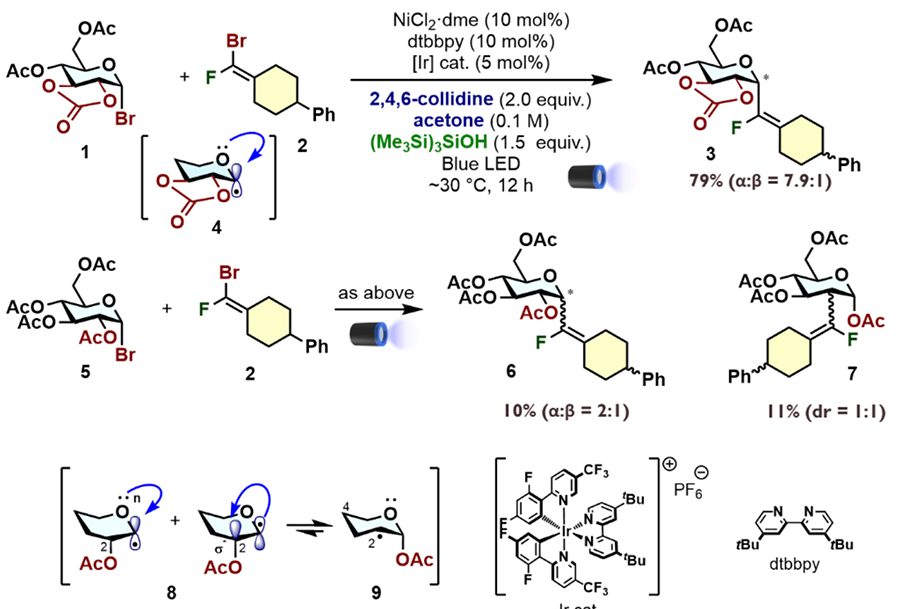
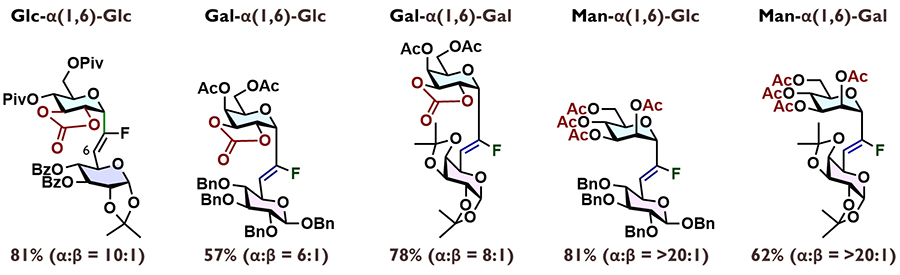
本手法は、様々なα-フルオロビニルC-グリコシド型擬糖鎖を合成可能であった。図 6には、1,6-連結型の二糖アナログ合成例のみを示すが、他の様々な様式にも適用可能である。ガラクトースドナーを用いる場合でも環状保護基が重要な役割を担うが、マンノースドナーの場合は、環状保護がなくとも高いα選択性で目的物を与えた。
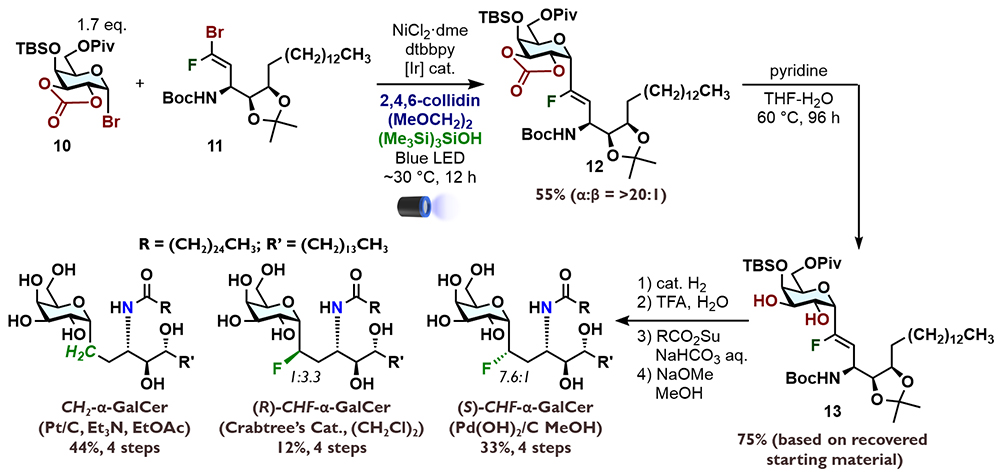
α-フルオロビニルC-グリコシドの二重結合を水素化し、保護基を除去することでC-グリコシド型擬糖鎖合成が実現できる。ここでは、C-グリコシド型擬α-ガラクトシルセラミド(α-GalCer)の合成について詳細を述べる。ガラクトースドナー10とスフィンゴシンから合成したアクセプター11とをカップリングさせると、完全なα選択性で12を得た。環状カーボネートを除去し、ジオール13を合成した。トリエチルアミン存在下、Pt/C触媒を用いて水素化すると、二重結合とC-F結合の還元が進行し、CH2連結部を構築できた。Boc基の除去、生じるアミンへの極長鎖アシル基の導入、保護基の除去によってCH2連結型擬α-GalCer(CH2-α-GalCer)を得ることに成功した。最初の水素化の際に、触媒をPearlman触媒(Pd(OH)2/C)に変更すると、(S)-CHF連結部を立体選択的に構築できた(7.6:1)。これを三段階で、(S)-CHF-α-GalCerに導いた。一方で、(R)-CHF連結部の立体選択的な構築は困難であった。現時点ではCrabtree触媒による13の水素化がベストであり、それでも(S)-CHF連結型アナログを優先して与えている(3.3:1)。生じたマイナー生成物から同様の三段階で、(R)-CHF-α-GalCerの合成を達成した。理想的ではないが、各連結部を合成終盤で分岐構築でき、3種の擬α-GalCerの合成を完了した。
α-GalCerは、様々な抗原提示細胞の表面に発現するCD1d受容体に提示される。この複合体がNKT細胞上のT細胞受容体(TCR)に認識されると、NKT細胞は活性化され、様々なサイトカインを産生する。産生するサイトカインのバランスに応じて、その効果は変化する。例えば、IFN-γなどのTh1サイトカインが産生されると、細胞性免疫が誘導され抗腫瘍効果などを示す24。このことから、様々な疾患の治療薬候補のリード化合物として、誘導体展開が世界中で実施された25。その中でもCH2-α-GalCerは、高い抗腫瘍効果をin vivoで示したことから、分解耐性の獲得はin vivoにおける大幅な活性向上につながると期待された。一方で、O-グリコシド結合からCH2-グリコシド結合への改変によって、CD1dおよびTCRとの三者複合体の安定性が低下することや26、NKT細胞活性化とは異なるメカニズムの存在がある27ことなども報告された。またMootooらは(R)-CHF-α-GalCerを合成し、その機能をMaらと共に報告している28。その報告によると(R)-CHF-α-GalCerは、α-GalCer同様にCD1dに提示されるものの、CH2-α-GalCerと共にマウスに投与すると、CH2-α-GalCer単独では誘導されるIFN-γやIL-4の産生が全く見られなくなること、さらに単独ではIL-17を選択的に産生誘導することが示されている。私達は今回、3種のC-グリコシド型擬α-GalCerの合成を達成できたことで、連結部編集による効果を同一評価系で議論することが可能になった。そこで、免疫賦活作用とNKT細胞の活性化に絞って、化合物の効果を調べることとした。
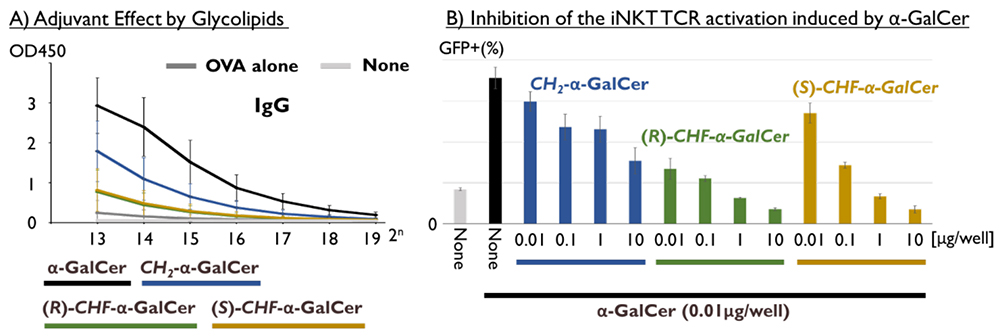
α-GalCerは免疫賦活作用を示すことから、ワクチンの効果を増大させるアジュバントとしての効果も検証されている。今回、医薬基盤・健康・栄養研究所の國澤純先生のご協力を得て、擬α-GalCerのアジュバント活性を評価した。抗原としてOVAと2 μgのα-GalCerもしくは擬α-GalCerを同時にマウスに投与し、2週間後の血清中の抗OVA抗体(IgGおよびIgM)をELISA法で分析した。α-GalCerを投与したマウスでは十分な抗体産生が見られたが、CH2-α-GalCerで天然型の半分程度、CHF-α-GalCerではいずれの異性体でも僅かな抗体産生にとどまった(図 8A)。当初私達は配座制御できるCHF-α-GalCerでは、立体異性体のいずれかで“活性配座”に制御されうると考えていたので、この低活性の結果に落胆した。次に、マウス脾臓細胞にC-グリコシド型擬α-GalCerを処理した際に生じるサイトカインをcytometric bead arrayキットで定量した。CH2-α-GalCerではIFN-γやIL-4、IL-17Aを産生したが、α-GalCerに比べ微量であった。また、CHF-α-GalCerではほとんど産生しなかった。分子構造は似通っているが、連結部の改変によって、大きく免疫賦活作用が“低下“したと解釈していた。
報告されているCH2-α-GalCerとCD1d-TCRとの三者複合体26から考察する限り、連結部をCHF基に変換しても三者複合体の形成が不可能には思えなかった。Maらは、(R)-CHF-α-GalCerがCD1dに提示されることを示しているが、NKT細胞の活性化に関する明確な知見はなかった。そこで、大阪大学の山﨑晶先生のご協力を得て、C-グリコシド型擬α-GalCerがNKT細胞を活性化するのかを確認した。その結果、C-グリコシド型擬α-GalCerはいずれもNKT細胞を活性化しなかった。この結果は、CH2-α-GalCerがin vivoでは十分なサイトカイン産生を誘導するが、in vitroではあまり誘導しないことと関係があるかもしれない。また、CH2-α-GalCerの顕著な抗腫瘍活性や、(R)-CHF-α-GalCerのIL-17産生誘導などは、in vivo系での特徴的な機能であり、NKT細胞の活性化による寄与はそれほど高くないことが示唆された。
それならば、C-グリコシド型擬α-GalCerは、逆にNKT細胞の活性化を阻害する可能性があると考え、α-GalCerとC-グリコシド型擬α-GalCerを同時に処理した。その結果、α-GalCerで誘導されるNKT細胞の活性化を、C-グリコシド型擬α-GalCerは抑制することがわかった(図 8B)。(R)-CHF体は特に顕著であり、連結部編集によってα-GalCerの生物活性をアゴニストからアンタゴニストに変化させていたことになる。CHF連結型アナログが、CD1dとTCRとの三者複合体を形成できるかは不明であるが、α-GalCerやCH2-α-GalCerと同様に結合したとしても、疎水性や配座分布の違いによって三者複合体の動き方は変化することが予想される。このことから、NKT細胞の活性化にはα-GalCerがもつ配座分布が重要な役割を担っていると考えている29。
他のC-グリコシド型擬糖鎖の生物活性も、実にユニークである。擬イソマルトースでは、CH2体で活性が増強し、CHF体ではいずれの異性体でも活性が消失した29。擬メリビオサミンでは、CH2体でやや活性低下、(S)-CHF体でほぼ活性消失、(R)-CHF体で5倍程度の活性増強が認められた30。これ以外にも、すでに別の2種の擬複合糖質の合成を完了しており、その生物活性も連結部に応じて変化することがわかっている。その変化を私達は糖鎖配座分布の変化、糖鎖の動きの違いで説明しているが、その確証はまだ十分ではない。しかし、この構造類似性はケミカルバイオロジー研究の分子ツールとしては、分解耐性も相まって大きなメリットがある。今後、これら分子を起点に役立つ分子へと発展させていきたい。