
氏名:藤田 聡
国立大学法人福井大学学術研究院工学系部門 教授
1997年京都大学工学部卒業,京都大学工学研究科高分子化学専攻修了。2009年博士(工学)。技術士(生物工学部門)。酒造会社,バイオ企業,臨床検査会社で研究開発に従事。京都大学再生医科学研究所に出向兼務し,微小環境による細胞挙動の制御をテーマに材料研究に取り組んできた。2011年より福井大学に着任,2022年より現職。エレクトロスピニング法で紡糸したナノファイバーや,生体高分子を利用したハイドロゲルが専門。日本技術士会生物工学部会幹事,繊維学会医用材料研究委員会委員長,日本バイオマテリアル学会評議員。
エレクトロスピニング法で作製したナノファイバー不織布はサブミクロンからナノメートルサイズの直径を特徴とする繊維材料であり,高い比表面積,多孔性,軽量などの特徴から,培養基材や再生医療材料としての応用が期待されている。さまざまな高分子からナノファイバーを作製でき,従来の材料では実現できなかった性能を発揮する。本稿では,エレクトロスピニング法を用いた多糖およびその誘導体からのナノファイバー化技術について述べる。
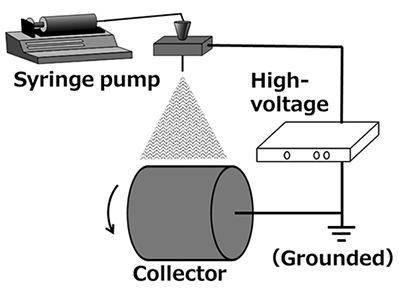
ナノファイバーを得る手法として、メルトブロー法、押出成形法、相分離法、エレクトロスピニング(electrospinning、静電紡糸)法などが知られている。特に、エレクトロスピニング法は、高電圧を利用してポリマー溶液または溶融ポリマーからナノファイバー不織布を生成する技術であり、簡便で安価な製法として有用である。この技術では、ポリマーの種類、溶液濃度、溶媒組成、印加電圧、射出速度、環境湿度などの条件を調整することで、繊維径や形態(ビーズ、メッシュ、マット、モノフィラメントなど)を精密に制御でき、多様な用途に応じた材料設計が可能である。
エレクトロスピニング法は、溶融型と溶液型の2種類に大別される。溶融型は高温で溶融させたポリマーを使用し、溶液型はポリマーを溶媒に溶解させた溶液を使用する。いずれの方法でも、高電圧を印加したノズルからアースをとったコレクタに向けてポリマーを射出し、電界中で牽引して微細な繊維を形成する(図 1)。溶融型は溶媒に溶けにくいエンジニアリングプラスチックなど特殊なポリマーを使用できるが、高温で溶融状態にする必要があるため、熱で分解しやすいポリマーや天然高分子には適用が難しい。一方、溶液型はさまざまなポリマーに対応可能である。ノズルから射出されたポリマー溶液の液滴から溶媒が揮発する過程で電荷が濃縮し、電荷間の反発によって微細な繊維が形成される。本稿で紹介する事例はいずれも、多糖を溶液型エレクトロスピニング法でナノファイバー化したものであり、以降のエレクトロスピニング法に関する記述は溶液型を指す。
エレクトロスピニング法は、適切な溶媒があればほぼすべてのポリマーに適用可能であるが、ナノファイバー化しやすいポリマーとそうでないポリマーが存在する。一般に、高極性や結晶性のポリマーは繊維化しやすく、非晶性ポリマーは繊維化が難しい傾向がある。例えば、生分解性材料として知られているポリ乳酸(PLA)やポリ-ε-カプロラクトン(PCL)は、ナノファイバー化しやすいポリマーの代表例でもある。また、ポリウレタン(PU)も高い紡糸性を持ち、伸縮性のあるナノファイバーシートが得られる。さらに、ポリエチレンオキシド(PEO)、ポリビニルアルコール(PVA)、ポリビニルピロリドン(PVP)などの水溶性ポリマーもナノファイバー化しやすい材料である。これに対し、コラーゲン、アルギン酸、ヒアルロン酸などの生体高分子は高濃度の水溶液中でゲル化しやすく、紡糸が困難である。本稿では、このような紡糸が困難な生体高分子のなかでも、特に多糖のエレクトロスピニング法に焦点を当て、ナノファイバー化を実現したプロセスを紹介する。
アルギン酸は海藻由来の多糖類であり、α-ʟ-グルロン酸とβ-ᴅ-マンヌロン酸からなるランダム共重合体である。カルシウムなどの金属イオン存在下で「エッグボックス構造」と呼ばれる架橋構造を形成し、高い吸水性と生体適合性を示すハイドロゲルとなる。この特性を活かし、食品添加物や、タンパク質やペプチド薬物のドラッグデリバリーシステム、組織工学など医療分野での応用が期待されている。また、アルギン酸側鎖のカルボキシル基を化学修飾することで、光や温度、超音波などの刺激に応答するインテリジェント材料や、細胞接着分子を導入した細胞接着性材料の開発も報告されている。
従来、アルギン酸ハイドロゲルは等方性のバルク材料として利用されてきたが、エレクトロスピニング法を用いることで、繊維の配向性に基づく異方性材料の作製が可能となる。しかし、アルギン酸は剛直な鎖構造を持ち、鎖の絡み合いが不十分であるため、エレクトロスピニングによる紡糸は困難である1。そこで、PEOやPVA、グリセロールなどの水溶性ポリマーや水素結合性の化合物とブレンドすることで、エレクトロスピニングによるナノファイバーの作製が可能となる2-4。
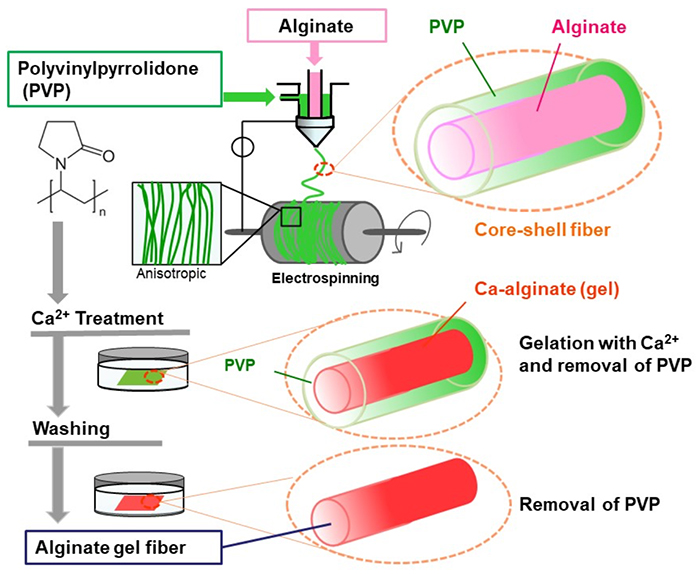
筆者らは、添加物を使用せず、アルギン酸のみから成るナノファイバーを作製するため、芯鞘型エレクトロスピニングに着目した。この手法では、芯部にアルギン酸、鞘部に紡糸性を補助するポリビニルピロリドン(PVP)を用い、アルギン酸水溶液を内包した二層構造のファイバーを作製した5。PVPは繊維化しやすいポリマーであり、繊維形成のガイドとして機能する。つづいて、カルシウムイオンを含む水溶液に浸漬すると、内包されたアルギン酸が架橋されゲル化するとともに、外側のPVPが水に溶解して除去される。これにより水に不溶なアルギン酸ハイドロゲルファイバーが形成される(図 2)。この結果、配向性や繊維間の多孔性が保持された材料、さらにはチューブ状といった多様な立体構造の作製が可能となる。特に、細胞外マトリクス(ECM)を模倣したナノファイバー構造を簡便に作製できる点が注目される。また、EDTAなどのキレート剤を使用すれば、ゲルが容易に溶解し、繊維上に接着した細胞を増殖後に容易に回収できる。
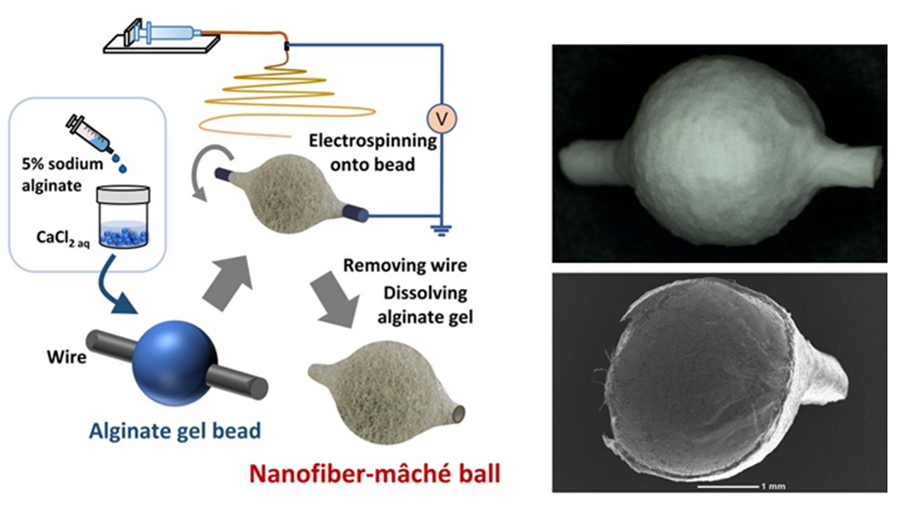
アルギン酸のゲル化と溶解の特性は、3次元構造体の作製に活用できる。筆者らは、アルギン酸ハイドロゲルを鋳型とする利用したエレクトロスピニング法を考案した(図 3)6。ここでは、アルギン酸ハイドロゲルビーズを直接コレクタとして使用する。カルシウムイオン存在下でゲル化したアルギン酸ゲルは導電性を持つため、ゲルビーズにアースを取った金属ワイヤを通し、回転させながらナノファイバーを吹き付けることで、ビーズ表面にナノファイバーが付着した3次元構造体を形成する。その後、キレート剤を用いてゲルを溶解することで、ナノファイバーのみの3次元構造体が得られる。この技術により、張り子人形(maché doll)のように内部が中空の構造体を作製することが可能となった。さらに、コレクタの回転数を調整することで、内外表面の繊維配向や表面微細構造の制御も精密に行える。この技術の大きな利点は、鋳型であるアルギン酸ハイドロゲルを自在に作製できる点にあり、3Dプリンタを用いて任意の大きさや形状のハイドロゲルを形成できる7。再生医療や創薬分野において、臓器や組織の構造を模倣した3次元足場材料としての応用が期待される。
ヒアルロン酸(HA)は、N-アセチル-ᴅ-グルコサミンとᴅ-グルクロン酸からなる天然の多糖であり、動物組織に広く存在する。HAはがん治療から化粧品に至るまで幅広い分野で利用されており、特にECMの重要な構成要素であることから、創傷被覆材や培養基質としてのハイドロゲルやフィルムでの応用が注目されている。たとえば、チオール修飾されたHA誘導体の酸化反応による分子間架橋を利用したHAハイドロゲル8や、キトサンやコラーゲンと複合化したHAフィルム9などが報告されている。
HAをナノファイバー化することで、従来のゲルやフィルムに比べ表面積が大きくなり、異方性や多孔性が付与されるため、生理活性分子や成長因子、治療薬の送達、組織工学、創傷治療、ドラッグデリバリーなどへの応用が期待される。HAのナノファイバー化に関する初期の報告として、Jiらによるチオール修飾されたHA誘導体のエレクトロスピニングが挙げられる10。この研究では、補助ポリマーとしてPEOとポリエチレングリコールジアクリレート(PEGDA)を添加した溶液をエレクトロスピニングし、得られたナノファイバーに対して、チオール基の酸化によるジスルフィド結合形成とアクリル基との共役付加反応による架橋が行われ、細胞培養の足場として機能する材料が得られた。
しかし、化学修飾されたHAの安全性については、特に医療や化粧品分野で懸念が残る。このため、未修飾のHAのエレクトロスピニングについても検討が重ねられた。その結果、ジメチルホルムアミド(DMF)などの高極性有機溶媒がHAのエレクトロスピニングに利用できることが発見された11。これを契機にHAナノファイバーに関する研究が進展したが、有機溶媒の安全性に対する懸念が依然として残っており、未修飾のHAの水系溶媒でのエレクトロスピニング技術の開発が求められていた。
筆者らは、水系エレクトロスピニングによって未修飾のHAからナノファイバーを得るため、HA水溶液にPEOを混合し紡糸性の向上を試みた12(図 4)。PEOは、先に述べたように種々のエレクトロスピニングが困難な材料に添加することで紡糸性の改善に利用されてきたが、未修飾のHAへの適用は知る限りなかった。ここでは、pHを調整して分子内の電荷反発を抑制し、紡糸性の向上を図った。紡糸後、PEOを除去するために熱処理と急冷法を組み合わせた処理を行うことで、水中でも溶解せず長期間にわたり安定なHAハイドロゲルファイバーの回収に成功した。加えて、ハンドヘルドエレクトロスピニング技術を応用し、HA/PEOファイバーを人体に直接紡糸する試みも行われ、化粧品や創傷被覆材としての応用可能性が示された(図 4C)。

キチンはN-アセチルグルコサミンがβ-1,4結合で連なった多糖類で、主にエビやカニの殻、昆虫の外骨格、キノコの細胞壁に存在し、硬さや強度を提供する。キチンは水に不溶で化学的に安定しているため、その利用は難しい。一方、キチンを脱アセチル化して得られるキトサンは水溶性が高く扱いやすいため、医療、食品加工、化粧品、農業分野等で広く利用されている。
キトサンナノファイバーに関する研究は進んでおり、生体適合性、抗菌性、多孔質構造といった特性から、さまざまな用途が期待されている。特に、キトサンは抗菌性、止血作用、創傷治癒促進などの効果があるため、創傷被覆材としての応用が注目されている。
キトサンは酢酸などの酸性溶液に溶解させることで、エレクトロスピニングに適した溶液を作製できる13。この紡糸性は、他の多糖同様、PEO14やPVA15の添加により改善できる。また、トリフルオロ酢酸(TFA)など他の溶媒を用いる方法も報告されている16。しかし、得られたキトサンナノファイバーは水に可溶で強度も弱いため、安定性や機械的特性を向上させるためのさまざまな架橋方法が検討されている。例えば、グルタルアルデヒド16やゲニピン13を用いた化学架橋法や、正に帯電したキトサンと負に帯電したアルギン酸ナトリウムの静電相互作用を利用してポリイオンコンプレックスを形成する方法17などが報告されている。
一方、キチンは水に溶解しないため、エレクトロスピニングは困難であるが、キトサン溶液にキチンを分散させることで、キチン・キトサン複合ナノファイバーの紡糸が可能となることが示されている18,19。
セルロースを溶解させる溶媒は少ないため、セルロースはエレクトロスピニングと相性が悪いといえる。数少ないセルロースの溶媒のひとつとしてイオン液体が知られており、エレクトロスピニングに利用されている。Xuらは、1-アリル-3-メチルイミダゾリウムクロライド(AMIMCl)というイオン液体を用いて、天然セルロースを溶解し、エレクトロスピニング法で極細繊維を製造することに成功した20。AMIMClは室温でセルロースを溶解できるが、粘度が高いため、共溶媒としてジメチルスルホキシド(DMSO)を混合し、粘度や表面張力を低下させ、連続的な紡糸を実現した。セルロース濃度やAMIMCl/DMSOの混合比、環境湿度の最適化により、滑らかで均一な繊維が得られたと報告されている。その後、種々のイミダゾリウム塩のイオン液体を用いたセルロースのエレクトロスピニングも報告された21。これらの手法で得られた繊維にはイオン液体が残留するため、湿式紡糸と同様に、凝固浴で繊維化を促進し、残留するイオン液体を除去する必要がある。この目的で、エタノール浴が利用されている。
扱いにくいセルロースに対する別のアプローチとして、側鎖を修飾したセルロースを溶解させてエレクトロスピニングを行う方法がある。酢酸セルロースはその代表例であり、溶媒選択が重要である。Maらは、アセトン、ジメチルホルムアミド(DMF)、トリフルオロエタノール(TFE)の混合溶媒に酢酸セルロース溶液を溶解した溶液でエレクトロスピニングが可能であることを報告した22。DMFは沸点が高いため、TFEやアセトンを加えることで揮発性を高め、紡糸性と繊維形成の安定性を向上させた。Chengらは、アセトンとジメチルアセトアミド(DMAc)の混合溶媒を用い、高湿度環境下でエレクトロスピニングを行い、三次元構造のナノファイバースタックを形成させた23。ここでも、溶媒の揮発性が繊維形態に影響を与えることが示されている。
Zhangらは、セルロースを過ヨウ素酸で酸化し、水溶性を持たせることで、有害な有機溶媒の使用を回避し、水のみを溶媒としてエレクトロスピニングを行う手法を提案した。この手法では、繊維化後に化学架橋を行い、水に不溶化した繊維を得ることができる24。
セルロース自体は溶媒にほとんど溶けないが、それに代わる手法としてセルロースナノファイバー(CNF)懸濁液の利用も検討されている。CNFは木材やパルプを解繊した材料であり、高強度・軽量という優れた特性を持つ再生可能なバイオマス材料である。特にCNFは引張方向での靭性が高く、配向させて複合化することにより、従来材料よりも強い材料が得られると期待される。
CNFは水に分散するが、懸濁液のエレクトロスピニングは困難である。低濃度では粘度が低く、エレクトロスピニングにおいてノズル先端部でテイラーコーンと呼ばれる溶液の液滴を形成できず、逆に高濃度ではゲル状になりノズルから射出できないためである。このため、水溶性ポリマーを補助ポリマーとして混合し、エレクトロスピニングする方法が検討された。
EnayatiらはPVAにCNFを添加してエレクトロスピニングで繊維を作成した25。ここで、CNFはPVA繊維を補強するためのフィラーとして添加された。CNFは溶解していなくとも、懸濁液状態のままエレクトロスピニングできるというこの知見は大変興味深い。しかしながら、作製されたファイバーは、期待に反して弾性率や破断伸びは十分ではなかった。これは、セルロースとPVAの間で水素結合が形成され、セルロースの結晶構造が乱れた可能性が指摘されている。
筆者らは、PEOをCNF分散液に混合し、エレクトロスピニングを行うことで、CNFがPEOのマトリクス中で伸長・バンドル化されたナノファイバーを得ることに成功した26(図 5)。この手法により、高い機械的強度を持つ繊維が実現した。

CNFは水懸濁液でうまく分散するが、疎水性の溶媒やポリマー中での分散は困難である。このため、疎水性ポリマーにCNFを複合化することは難しかった。筆者らは、固体粒子によって安定化された系であるPickeringエマルションに着目した27。疎水性の生分解性ポリマーであるポリ-3-ヒドロキシ酪酸-3-ヒドロキシヘキサン酸共重合体(PHBH)をクロロホルムに溶解し、CNF水懸濁液と混和することで、CNFで安定化されたPickeringエマルションが得られる。これを直接エレクトロスピニングすることで、PHBH繊維内部にCNFが伸長・バンドル化した状態で埋入された繊維を得ることに成功した(図 6)。

デキストランは、グルコースのα-1,6結合を主鎖とし、分岐を有する水溶性の多糖である。医薬品では代用血漿として、また食品や化粧品では増粘剤や安定化剤として広く利用されている。Jiangらは、エレクトロスピニング法を用いてデキストラン膜を作製し、その特性を評価した28。デキストランは溶媒や添加物の選択により、その特性を調整できる。水を溶媒とした場合、リゾチームなどのタンパク質を直接添加でき、DMSO/DMF溶液ではPLGAとの複合膜の作製が可能である。また、メタクリレート基を導入したデキストランを光架橋法で反応させ、耐久性のある膜を形成できることが報告されている。この方法により、薬物送達や組織工学などの生物医学分野での応用が期待されている。
Bortehらは、アセタール化デキストラン(Ac-DEX)を用いてエレクトロスピニング足場を作製し、治療薬の徐放性を評価した29。Ac-DEXはグルコース骨格の水酸基がアセタール基に置き換わった構造を有し、加水分解速度を環状アセタールと非環状アセタールの比率で調整できる。非環状アセタールは速やかに分解するが、環状アセタールは分解が遅いため、合成条件により足場の分解速度を制御できる。彼らは免疫調節薬レジキモドを足場に導入し、放出速度が足場の分解速度に依存することを示した。高速分解性の足場では早期に薬物が放出され、低速分解性の足場では緩やかな放出が観察された。
デキストリンは、デンプンの加水分解で得られる多糖であり、グルコースのα-1,4結合を基本単位とし、α-1,6結合による分岐を有する。環状にグルコースが連結したものはシクロデキストリンと呼ばれ、食品や医薬品で広く利用されている。Celebiogluらは、ヒドロキシプロピル-β-シクロデキストリン(HPβCD)を用いて、低分子の糖からエレクトロスピニング法により直接ナノファイバーを作製することを報告した30。HPβCDは自己凝集により高い粘度を示すため、補助ポリマーを使用せずとも安定したナノファイバーが形成された。また、尿素を添加すると自己凝集が抑制され、繊維径が減少し、ビーズ状の構造変化が確認された。さらに、HPβCDと抗菌剤トリクロサンの包接錯体(HPβCD/トリクロサン-IC)を用いても、ビーズフリーのナノファイバーが得られ、包接の保持が各種分析手法により確認された。
本稿では、エレクトロスピニングにおける多糖およびその誘導体の利用について紹介した。エレクトロスピニング法で作製された多糖ナノファイバーは、異方性を有するハイドロゲル繊維として、創傷治療、組織工学、ドラッグデリバリーなど、幅広い分野での応用が期待されている。今後は、さらなる機能化や新しい複合材料の開発が進展し、より高度な応用が展開されると予想される。また安全性の懸念から、使用する溶媒や架橋方法の改良も強く求められている。こうした技術を基盤とした3次元足場材料は、人工臓器や薬剤評価のための生体組織モデル、再生医療や創薬分野において、大きな貢献を果たすと期待される。
本論文は、福井大学・末信一朗教授ならびに多くの先生方や学生諸氏との共同研究の成果を含み、深く感謝いたします。