氏名:石井 知彦
香川大学創造工学部教授 香川大学国際希少糖研究教育機構教授
1996年 東京工業大学大学院理工学研究科化学専攻博士後期課程修了、博士(理学)、1996年 いわき明星大学理工学部助手、1997年 東京都立大学大学院理学研究科助手、2002年 香川大学工学部助教授、同准教授、同教授、2018年 香川大学創造工学部教授
専門は固体物性物理学と量子材料科学。希少糖の詳細な電子構造を調べるためには、自ら希少糖の詳細な結晶構造を調べなければならず、毎日悪戦苦闘を繰り返しながらも、希少糖の奥深さに魅了されている。
本稿は、単糖類および希少糖の結晶構造に焦点を当て、分子同士がどのように相互作用(これを分子間相互作用という)し、その相互作用が結晶の形や性質にどう影響を与えるのかを探る。これによって、物質の特徴がわかる。特に、D-glucoseとD-allose、またはD-fructoseとD-alluloseのように、互いに極めて似通った分子構造を持ちながらも、結晶構造が大きく異なる様子を示し、その背景にある水素結合や分子間相互作用のメカニズムを解明しようと試みている。さらに、希少糖結晶の新規応用の可能性についても検討しており、特定の物性を引き出すための結晶構造の制御方法についてのアプローチを紹介する。また、単糖類の結晶構造は制御できるのかという長年の謎に対する新しい視点も提供している。本稿を通じて読者は、希少糖結晶の応用に向けた具体的な研究進展を理解し、結晶構造が材料科学や医療、農業などの分野にどのように貢献できるのかを学ぶきっかけとなっていただければ幸いである。
有機物の結晶は、分子が規則正しく並んで固体状態を形成したものである(Fig. 1)。有機分子が結晶を形成する際には、分子間に働く相互作用、例えば水素結合やファンデルワールス力、疎水性相互作用などが大きく影響する。これにより、結晶は特有の形状や物理的性質(巨大な旋光性や自発分極、磁性、融点の違いなど)を持つようになる。D-glucoseに代表される単糖類は、多くのヒドロキシ基(-OH)を持っており、特に水素結合による分子間相互作用の影響が強くなる。水素結合は、分子間の弱い引力であるが、これが単糖分子をしっかりと結びつけ、結晶の安定性を保つ役割を果たしている。単糖類は一般に水に非常に溶けやすい物質であり、その結晶は水溶液から容易に析出することが可能である。得られた結晶は一般的に透明で無色であり、その形状は針状または板状の結晶として現れる。結晶は柔らかく水分を吸収しやすい性質があり、特にglucoseやfructose、alloseなどの単糖では、水分子が結晶溶媒として取り込まれた結晶が得られることもある。なお、単糖類の結晶としての特徴は、多型を取りにくいという点が挙げられる。alloseなどの一部の例外はあるが、通常の単糖類は、ただ一通りの結晶構造のみを有する。
希少糖の研究は、単糖類の中でも、何森健が発表した大量合成戦略『Izumoring』以来、飛躍的に研究が進展した(次のURLのホームページ https://www.eng.kagawa-u.ac.jp/~tishii/pov/Images/Izumoring.mp4 では、Izumoringについて動画で紹介している)。特に医学や薬学、農学の各分野においては、例えば血糖値の上昇抑制機構や脂肪の燃焼促進機構、がん細胞の増殖抑制機構や食べられる農薬としての利用、低カロリー甘味料としての利用、腸内環境の改善、抗酸化作用や抗炎症作用、カルシウム吸収促進機能などがすでに報告されている。
希少糖研究のさらなる発展と用途開拓のためには、これまで研究が殆どなされていなかった学問分野、例えば工業材料としての応用の可能性などを検討する必要がある。例えば希少糖結晶を新しい機能を発現させる新規材料として利用するためには、目的とする物性(例えば電気伝導性や磁性、光応答性など)を発現させる必要があり、そのためには結晶中における分子の向きを適切に揃えなければならない。具体的には、糖分子の中には、電荷の偏りがある部分がある(これは「双極子モーメント」と呼ばれている)。これは、磁石のN極とS極のように、電気的にプラスとマイナスの極がある状態のことである。この向きをすべて揃えることができれば、巨大円偏光発光素子を構築することができ、また、糖分子のスピンモーメントを同じ方向に揃えることができれば、強磁性体磁石を作成することも可能となってくる。
もともと糖分子は一つの分子内に多数の不斉炭素を有し、分子全体として固有の旋光性を有している。水溶液中では分子の向きはランダムに動き回るが、その状態であっても旋光性を示すことから、日本酒度や糖度の測定などに利用されている。仮に、結晶中で糖分子が有する旋光性を一方向に揃えることができれば、巨大な旋光性を有する光学フィルタとしての応用の可能性が生じる。
しかし現実には、残念ながら、有機物の結晶において、分子の向きを思い通りに並べることは極めて困難である。これは単糖類に限らず、一般的な有機分子であれ無機化合物であれ、単結晶において自由に分子の向きを揃える方法は、現在ではまだ確立されていないためである。本稿の目的は、これまで我々のグループで行われてきた、様々な種類の天然型単糖や希少糖、およびそれらの誘導体の結晶構造を紹介するとともに、構造が互いに極めて似通っている糖分子同士であっても、それらの結晶構造が全く異なるという事実を紹介することである。さらに、それでも我々は、どのようにすれば糖分子を自由自在に分子の向きを揃えることができるのか、その方法を明らかにすべく研究を継続している様子を紹介することも目的である。第2章ではhexoseにおける結晶構造の違いを紹介する。第3章では含水化合物における結晶構造について説明し、第4章ではラセミ結晶について紹介する。第5章では抗菌性を有するalkyl sorboside結晶について紹介し、第6章では、結晶構造の予測と制御に向けた今後のアプローチの方法について紹介する。
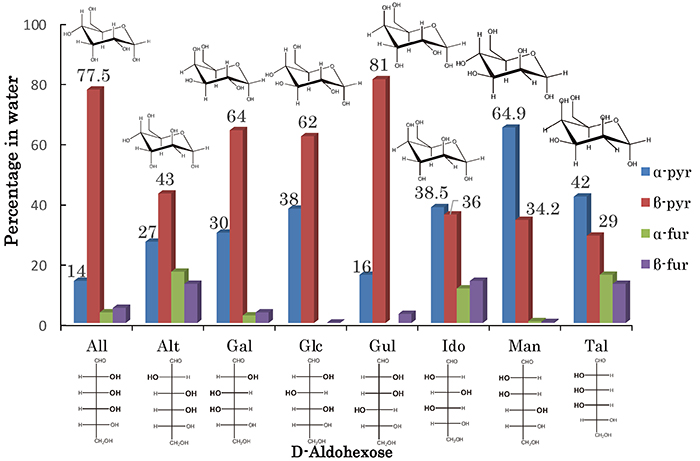
この章では、六炭糖の結晶構造がどのように異なるかを紹介する。六炭糖はエネルギー代謝に関わる重要な分子であり、その結晶構造の違いが物性にどのように影響するかを見ていく。単糖類の中でも六炭糖は、一般的な化学式C6H12O6を持つ糖であり、自然界に広く存在している。六炭糖はエネルギー代謝の中心的な分子であるglucoseなど、解糖系やクエン酸回路のほか、多糖類の構成単位として細胞壁やエネルギー貯蔵物質の形成や、細胞間の認識やシグナル伝達に関与するなど、その多様性と生物学的重要性から、研究が非常に活発に行われており、医療やバイオテクノロジー、食品科学などさまざまな分野で応用されている。特にアルデヒド基(-CHO)が存在するD-aldoseでは、Fig. 2に示す通り8種類の立体異性体(エピマー)が存在する。これら8種類の立体異性体はそれぞれ、水溶液中ではα-pyranose型、β-pyranose型、α-furanose型、β-furanose型の4つの環状互変異性体(アノマー)どうしの混合物となっており、鎖状構造は殆ど取らない(1 %未満)。
本稿では、主に六炭糖結晶の結晶構造の違いについて紹介するが、多くの読者に糖の結晶構造を理解していただくために、まず結晶学の基本的な概念を押さえておく。なお、結晶構造について既に十分な知識を有する読者は、これから2つの段落で結晶構造の基礎について説明するため、この部分を読み飛ばしていただければ幸いである。
まず結晶とは、分子や原子が一定の規則に従って並んだ固体である。多くの糖はこの結晶状態を取りやすく、例えば食塩や氷と同じように、目に見える形で結晶を作る。結晶を構成する分子や原子の並び方にはさまざまな種類があり、この規則性は結晶系(crystal system)と呼ばれる分類で表される。例えば、直方晶系(orthorhombic)や三斜晶系(triclinic)などは、結晶系の一例であり、それぞれ、分子や原子が規則正しく並ぶ際の繰り返し周期構造の最小構成単位である単位格子(unit cell)の形が、直方体のものが直方晶系であり、平行六面体のものが三斜晶系である。さらに、結晶の対称性を理解するためには空間群(space group)の概念が重要である。結晶では原子が規則正しく並んでいるために、点対称や面対称、回転対称などを有する場合が多く、この空間群は、結晶内の分子や原子がどのような対称性を持っているかを数学的な記述で表されたものである。
例えば、本稿ではP212121という空間群が後に出てくるが、これは直方晶系に属し、結晶の中には、3つの方向に沿ってらせんのように分子が並んでいる部分がある(これを「21軸」と呼ぶ)。このらせんのような並び方は、分子を少し動かしてから180度回転させるような動きを繰り返すことでできている。このことを文章のみで説明することは難しいため、説明のための動画を準備した。次のURLのホームページ https://www.eng.kagawa-u.ac.jp/~tishii/pov/Images/P212121All.mp4 では、D-alloseを例として、空間群P212121構造の、特に21らせん軸の対称操作について紹介しているので、ご覧いただけたら幸いである。このような対称操作の種類は他にもあり、その結果、結晶内の分子は非常に規則正しく配置され、結晶の全体的な安定性が保たれる。
結晶構造の違いは、物質の物理的特性や化学的特性に大きな影響を与える。たとえば、同じ化学式を持つ物質であっても、結晶構造が異なれば溶解度や融点、光学特性などの性質が変わることがある。このため、結晶構造を正確に理解し、制御することは、材料科学や薬学、さらには農学においても非常に重要である。
本稿では、単糖類の結晶構造に焦点を当てているが、特に六炭糖の結晶構造における多様性に注目している。六炭糖の構造異性体には多くの種類がある。これらの異性体は、わずかな分子構造の違いにも拘らず、結晶構造が大きく異なることを紹介する。
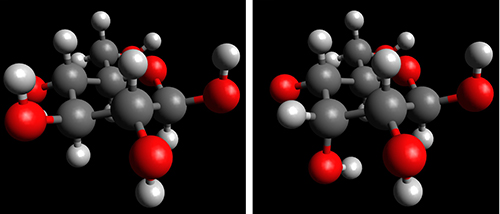
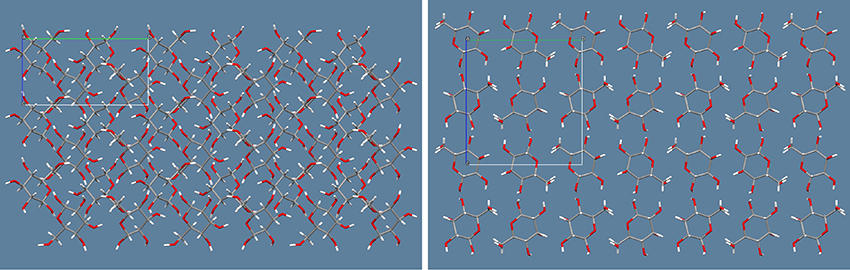
ここで、分子構造が極めて似通っている2つのaldohexoseであるD-glucoseとD-alloseを例に挙げて説明する。Fig. 3の左側がD-glucoseであり、右側がD-alloseの代表的な分子構造である。それぞれβ-D-pyranose型構造を取っており、水溶液中における存在確率は、それぞれ62 %および77.5 %である。この2つの分子は、C-3位のOH基の向きが異なるだけで、それ以外の大部分の分子構造は同じである。しかし、この2つの糖分子の結晶構造は大きく異なる。Fig. 4の左側がD-glucoseであり、右側がD-alloseの結晶構造(分子のパッキング図)である。ともにa軸方向からの眺めであるが、D-alloseでは六員環がきれいに整列しているのに対して、D-glucoseでは六員環が斜めに傾いている様子が確認された。
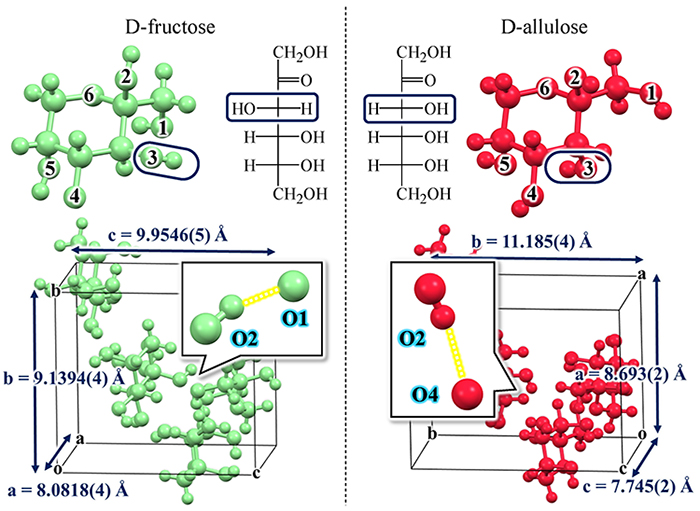
このように、分子構造が極めて似通っていても結晶構造が大きく異なる例は、D-aldoseに限った話ではない。次にケトン基(-C=O)が存在する代表的なD-ketoseであるD-fructoseとD-alluloseの例を示す。Fig. 5に示す通り、D-fructoseとD-alluloseの分子構造の違いは、C-3位のOH基の向きが異なるだけである。にも拘らず、これら2つの結晶構造は大きく異なっている。例えばD-fructoseでは、C-2位のOH基(以後、O2のように示す)がO1に向かって水素結合が形成されているのに対して、D-alluloseでは、O2からO4に向かって水素結合が形成されていることがわかる。特筆すべき点は、D-fructoseとD-alluloseの分子構造の違いはC-3位のOH基の向きが異なるのであるが、結晶における水素結合の違いは、O3とは無関係の別のOH基(O2やO1やO4)で違いが見られているという点である。
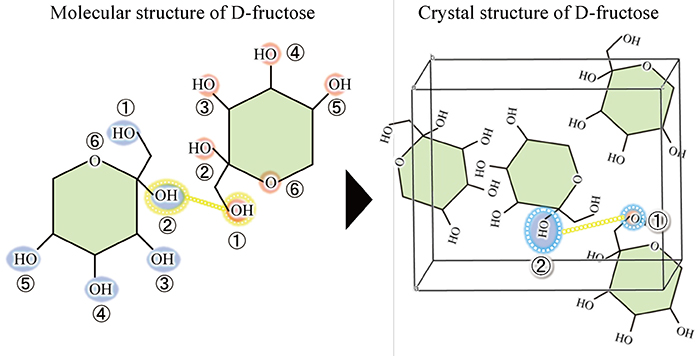
もう一つ特筆すべき点がある。それは、水素結合が決してランダムに選択されているわけではないという点である。具体的には、例えばD-fructoseの場合、Fig. 6に示す通り、水素ドナーであるOH基は5箇所あり(水色)、水素アクセプターである酸素原子は6箇所存在する(赤色)。すなわち、取りうる水素結合ペアの数は5 × 6 = 30通り存在する。しかし、主たる水素結合としてはこの30通りの中からランダムには選択されず、例えばD-fructoseではO2 → O1のみが選択され、またD-alluloseではO2 → O4のみが選択されている。例えばD-fructoseの場合には、このO2 → O1の主たる水素結合が複数の分子間で繰り返されることにより、より大きな結晶へと成長している。
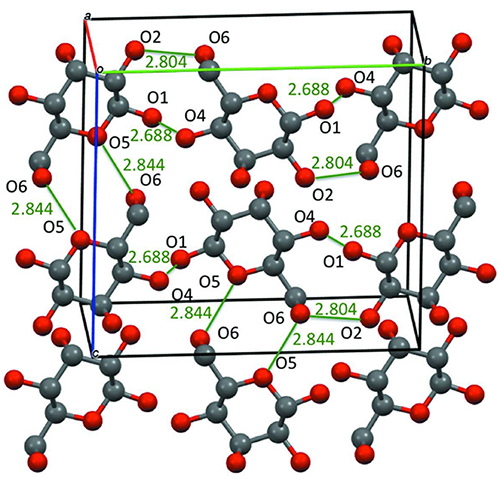
ところで、D-hexoseのようにキラルな構造を有している有機化合物では、直方晶系(かつては斜方晶系と呼ばれていた)の空間群P212121の対称性を有する結晶形を持つことが多い(Fig. 7)。直方体の単位格子をとり、x, y, z軸それぞれに対して二回らせん軸(21軸)を有する。らせん軸は単なる回転操作であるために、例えばD-体(仮に右手と考える)はD-体(右手)のまま裏返しとなる。単位格子中における独立原子の相対座標(x, y, z)は、P212121の対称操作により、(1/2 + x, 1/2 – y, –z)と(–x, 1/2 + y, 1/2 – z)と(1/2 – x, –y, 1/2 + z)に複製され、その結果、単位格子中に4原子が存在することになる。なお、結晶学では、単位格子中に含まれる分子の数をパラメータZを用いて示すこととなっている(Z = 4)。

Fig. 7に示す通り、D-体・L-体の区別に拘らず、またaldoseやketose、六炭糖や五炭糖、無水物や含水物の区別に拘らず、多くの単糖類及びその誘導体において、このP212121空間群を有していることが報告されている。hexoseに限って言えば、Table 1に、これまで結晶構造が報告された結果をまとめて示す。ここでCSD IDとは、ケンブリッジ構造データベース(Cambridge Structural Database: CSD)の識別IDである。CSDとは、1965年からデータを蓄積している有機分子や有機金属分子の結晶構造データベースのことであり、英国CambridgeにあるThe Cambridge Crystallographic Data Centre (CCDC)がデータ登録および処理を単独で行っている。
Table 1より、多くの単糖類でも同様にP212121空間群を有していることがわかる。この中で例外なのはD-altroseである。D-altroseについては、直方晶系ではなく三方晶系(trigonal)P32空間群を有している。これは我々のグループを含め世界中で追試実験が行われているが、現在のところ直方晶系のaltrose単結晶は得られていない。またD-mannoseについても、単結晶が生成されにくいという特異な性質を有する。mannoseは自然界に大量に存在し、コンニャクやトウモロコシ、アロエ、海藻などに含まれている。希少糖ではないため試薬としても安価で手軽に手に入りやすい。そのため、世界中の構造有機化学者がD-mannoseの単結晶構造解析に挑戦しているが、D-mannoseの良質な単結晶は現在のところ得られていない。以上二点、D-altroseとD-mannoseの結晶構造の特異点については、現在も理由がわかっておらず、今後の課題である。D-idoseについては我々のグループを含め、世界中でまだ誰も単結晶構造解析に成功していない。六炭糖の結晶構造の体系的な議論のためにも、一日も早く測定に成功したいと願っている。
| Sugar | Space Group | Cell Parameters (Å,º) |
Cell Volume (Å3) |
Z | CSD ID | Ref. |
| β-D-Allose | P212121 | a 4.918(1) b 11.925(2) c 12.805(2) | 750.977 | 4 | COKBIN | [1] |
| β-D-Allulose (Psicose) |
P212121 | a 8.693(2) b 11.185(4) c 7.745(2) | 753.056 | 4 | OGETAW01 | [2] |
| β-D-Altrose | P32 | a 7.1749(13) b 7.1749(13) c 12.7415(15) γ 120 |
568.045 | 3 | EFUWEI | [3] |
| β-D-Fructose | P212121 | a 8.088(2) b 9.204(4) c 10.034(15) | 746.951 | 4 | FRUCTO11 | [4] |
| α-D-Galactose | P212121 | a 5.8999(8) b 7.8433(12) c 15.685(4) | 725.818 | 4 | ADGALA03 | [5] |
| β-D-Galactose | P212121 | a 12.655(2) b 7.771(1) c 7.701(1) | 757.332 | 4 | BDGLOS01 | [6] |
| α-D-Glucose | P212121 | a 10.360 b 14.840 c 4.970 | 764.100 | 4 | GLUCSA | [7] |
| β-D-Glucose | P212121 | a 9.205(4) b 12.640(5) c 6.654(3) | 774.201 | 4 | GLUCSE01 | [8] |
| β-D-Gulose | P212121 | a 7.0800(3) b 9.8644(3) c 10.6156(4) | 741.393 | 4 | CIVVAG | [9] |
| D-Idose | N.D. | N.D. | N.D. | |||
| α-D-Mannose (*) | P212121 | a 23.447(8) b 9.460(2) c 6.891(1) | 1528.480 | 8 | ADMANN | [10] |
| β-D-Mannose (*) | P212121 | a 5.62999(16) b 7.5401(2) c 18.0919(5) | 768.014 | 4 | OKEZAH10 | [11] |
| α-L-Sorbose | P212121 | a 6.535(4) b 18.069(7) c 6.305(4) | 744.500 | 4 | SORBOL | [12] |
| α-D-Tagatose | P212121 | a 6.237 b 6.529 c 17.757 | 723.089 | 4 | TAGTOS | [13] |
| α-D-Talose | P212121 | a 8.101(2) b 12.126(2) c 7.655(1) | 751.972 | 4 | ADTALO01 | [14] |
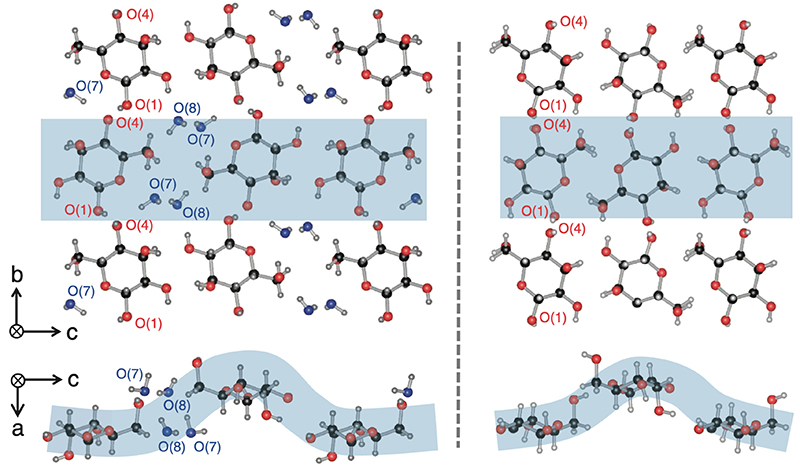
単糖類の結晶は柔らかく、水分を吸収しやすい性質があり、特にglucoseやfructose、alloseなどの単糖では、水分子が結晶溶媒として取り込まれた結晶が得られることもある。Table 2に、水分子が結晶溶媒として、結晶中に取り込まれた2つの例を示す。D-glucose monohydrateでは、D-glucose一分子あたり、一つの水分子が結晶内に取り込まれ、その結果、もともとP212121という高い対称性を有していた空間群は、単斜晶系P21に対称性を低下させている。一方、D-allose dihydrateでは、D-allose一分子あたり水分子が2個取り込まれている。それにも拘らず結晶の空間群は、P212121と高い対称性を保ったまま存在している。D-alloseについて無水物と含水物のセルパラメータを比較してみると、a = 4.918(1) Å, b = 11.925(2) Å, c = 12.805(2) Å(無水物)と、a = 4.81148(10) Å, b = 12.6487(3) Å, c = 15.6012(4) Å(含水物)のように、c軸方向のみがおよそ3 Å程度広がっていることがわかる。Fig. 8にD-allose dihydrateの結晶構造を示す。左側には含水物を、また右側には無水物の結晶構造を示している。この両者を比較すると分かる通り、D-alloseの六員環はきれいに揃ったまま、c軸方向に2つの水分子(O7およびO8)が挿入されたために、結晶構造は高い対称性を保ったまま、c軸方向のみに広がった構造を有していることがわかった。このことは、D-alloseが容易に水を吸脱着する可能性を秘めていることから、D-alloseが保湿剤としての応用に用いることができる可能性が示された。
| Sugar | Space Group | Cell Parameters (Å,º) |
Cell Volume (Å3) |
Z | CSD ID | Ref. |
| α-D-Glucose monohydrate | P21 | a 8.840 b 5.100 c 9.690 β 98.25 | 432.343 | 2 | GLUCMH | [15] |
| β-D-Allose dihydrate | P212121 | a 4.81148(10) b 12.6487(3) c 15.6012(4) | 949.473 | 4 | IHOTUW | [16] |
通常の単糖は、D-体とL-体で示される通り、2つの鏡像異性体を有する。ここで仮に、D-体を右手用のグローブ、L-体を左手用のグローブになぞらえて説明する(Fig. 9)。もし仮に、左手用のグローブのみが大量に存在した場合、空間をできるだけ密に埋める配置の仕方は、P212121空間群のように、90°回転させながら並べる方法であろう。この結晶をキラル結晶と呼ぶ。それに対し、右手用と左手用のグローブが同じ数ずつ大量に存在すると、キラル結晶のときに発生した無駄なスペースを、右手用と左手用が互いに上手に相補しながら、空間をより密に埋めることになる。この時の様子をラセミ結晶と呼ぶ。有機化合物では一般に、キラル結晶よりもラセミ結晶のほうが空間を密に埋めることができることから、ラセミ結晶のほうが単位体積が小さく、密度が大きくなるという傾向がある。これはヴァラッハ則(Wallach's rule)と呼ばれている17。
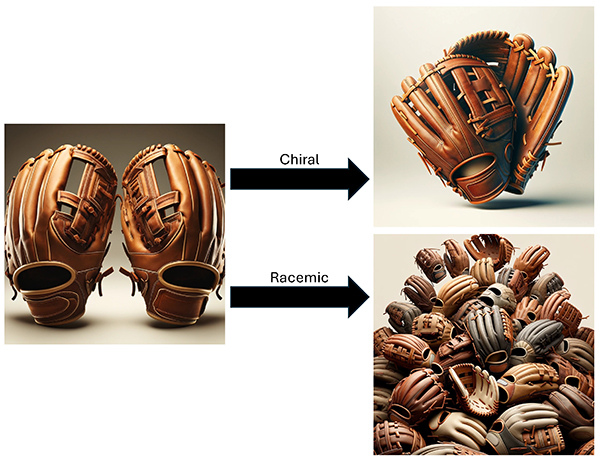
Fig. 10に、D-alloseとL-alloseが1 : 1の比率で結晶を作成したD,L-alloseの結晶構造を示す。これはラセミ結晶であるが、しばしばラセミ結晶という用語は、D-体とL-体の単なる混合物を含め、様々な形態に用いられる文言である。そのためここでは、単なる混合物ではなく、またD-体とL-体の部分交互積層でもなく、純粋に超格子構造を有した超分子であるということから、このような結晶を超分子希少糖と呼んでいる。なお、この超分子希少糖という用語の命名者は何森健であり、国際希少糖学会(ISRS)では、2011年に開催された希少糖国際会議において、超分子希少糖も正式な希少糖の分類のうちの一つであると判断し、従前の希少糖の定義を改定することにつながった。(以下のURLのホームページ
https://www.eng.kagawa-u.ac.jp/~tishii/pov/Images/DLAllose.mp4
https://www.eng.kagawa-u.ac.jp/~tishii/pov/Images/DLAllose2.mp4
では、D,L-alloseの超分子希少糖の構造について、動画を用いて紹介している)。
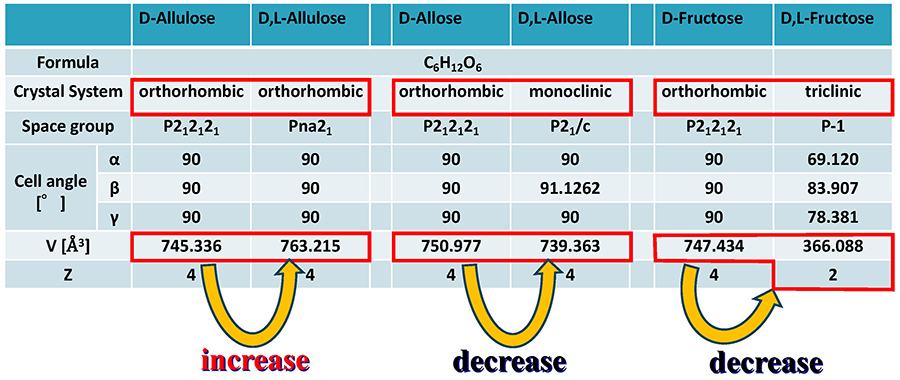
ところで、このヴァラッハ則を満たさない超分子希少糖が得られた。Fig. 11に、alluloseとalloseとfructoseについて、それぞれのD-キラル体およびD,L-ラセミ超分子体の結晶構造をまとめた。alloseとfructoseではヴァラッハ則を満たし、つまり、D,L-体ではD-体よりも体積が減少している(= 密度が増加している)(fructoseでは、D,L-体のZ値が2であるために、体積を二倍にして比較を行う必要がある)。それに対しalluloseでは、D-体の体積よりもD,L-体の体積のほうが大きくなっており(= 密度が減少している)、ヴァラッハ則を満たさないことがわかった。この理由は次のように考える。allulose分子では、C-3位とC-5位のOH基がともにアキシャル位となっており、この間に分子内水素結合を有することから、双極子モーメントが発生している。Fig. 12に示す通り、D-キラル体では、P212121の二回らせん軸により、この双極子モーメントがキャンセルされている。それに対してD,L-ラセミ超分子体では、直方晶系は保たれているものの、空間群がPna21に変化しており、これにより、すべての双極子モーメントが一方向に揃った状態が形成されていることがわかった。これにより、双極子モーメント間に働く相互作用によって、D,L-ラセミ超分子体では、単位格子の体積が広がったものと考えられる。
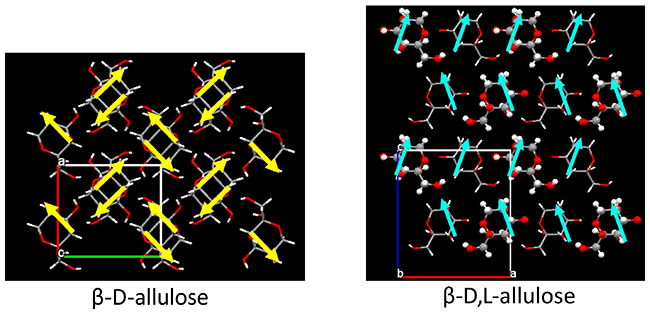
なお、この結果は、我々が目的としていること、すなわち希少糖分子を一方向に揃えることに成功した例である、と考えることもできる。前述の通り、双極子モーメントやスピンモーメントを同じ方向に揃えることができれば、巨大円偏光発光素子や強磁性体磁石の構築が可能となる。よって、従来、単糖類のキラル結晶のみでは実現しなかった分子の配向性の制御が、超分子希少糖結晶を構築することで、実現される可能性を見出すことに成功した。その他、これまでに報告されている超分子希少糖の結晶構造についてTable 3に結果をまとめる。
| Sugar | Space Group | Cell Parameters (Å,º) |
Cell Volume (Å3) |
Z | CSD ID | Ref. |
| β-D,L-Allose | P21/c | a 4.98211(10) b 12.5624(3) c 11.8156(3) β 91.1262(14) |
739.363 | 4 | QORHUC | [18] |
| β-D,L-Allulose | Pna21 | a 11.2629(5) b 5.3552(3) c 12.6538(6) | 763.215 | 4 | XULKIA | [19] |
| α-D,L-Sorbose | P21/a | a 12.8152(3) b 6.29489(13) c 18.9482(4) β 108.3472(12) |
1450.85 | 8 | HELYOP | [20] |
| β-D,L-Fructose | P-1 | a 5.43124(19) b 7.2727(3) c 10.1342(4) α 69.120(2) β 83.907(2) γ 78.381(2) |
366.09 | 2 | NUPSUO | [21] |
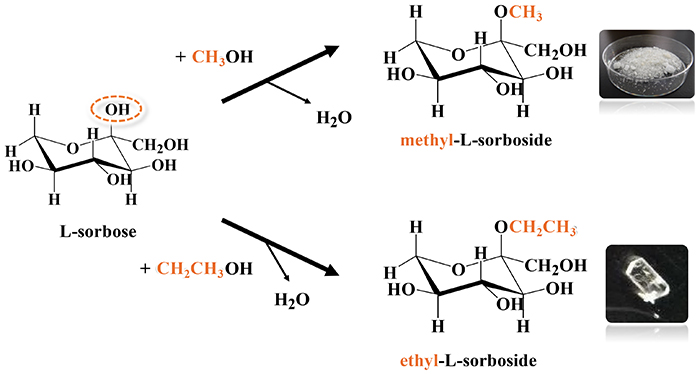
我々は、(株)伏見製薬所との共同研究で、sorboseの誘導体であるsorboside化合物の単結晶構造解析を行った。Fig. 13にて合成スキームを示す。sorboseにメタノールまたはエタノールを反応させることで、C-2位のOH基をメトキシ基もしくはエトキシ基に置換することができる。このようにして得られた化合物のうち、特にL-体であるalkyl-L-sorbosideは、選択的抗菌性を有する。選択的抗菌性とは、すべての微生物を無差別に殺すのではなく、有益な微生物を保護しながら、特定の有害な微生物のみの増殖を抑制する作用を指す。この概念は、特に人体のフローラ(微生物叢、腸内フローラの保護など)や、土壌や水中の微生物環境を維持するために重要である。Table 4に、メチル体およびエチル体のalkyl-L-sorbosideの結晶構造を示す。(次のURLのホームページ https://www.eng.kagawa-u.ac.jp/~tishii/pov/Images/ELS.mp4 では、ethyl-L-sorbosideの構造について、動画を用いて紹介している)。
| Sugar | Space Group | Cell Parameters (Å,º) |
Cell Volume (Å3) |
Z | CSD ID | Ref. |
| Methyl-α-L-sorboside | P1 | a 6.7320(5) b 7.7574(5) c 10.6128(8), α 82.458(6) β 72.596(5) γ 65.476(5) |
481.13 | 2 | LAMPAU | [22] |
| Ethyl-α-L-sorboside | P212121 | a 6.8203(8) b 8.6934(10) c 15.865(2) | 940.63 | 4 | EJAKAE | [23] |
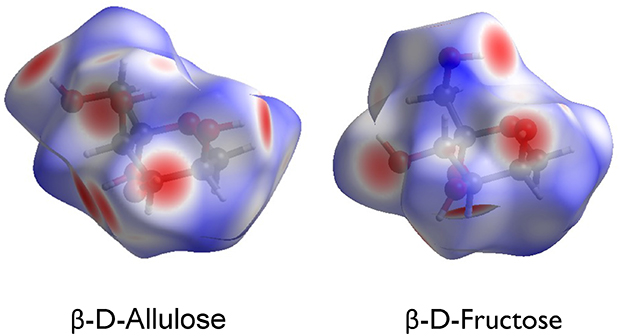
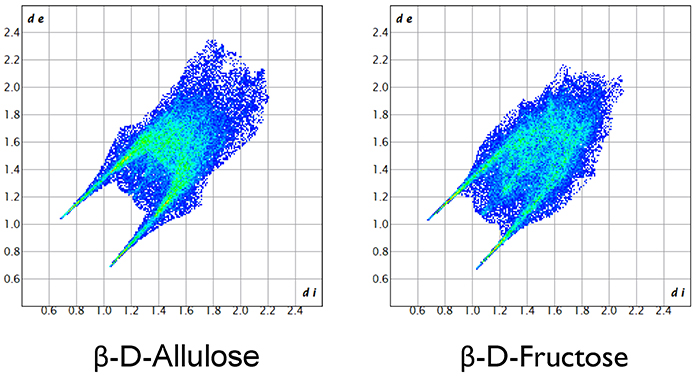
本稿では、単糖類、特にhexose類の結晶構造について紹介した。化学式 C6H12O6 を持つhexoseはaldoseであれketoseであれ、単なる構造異性体であり、分子構造は互いに極めて似通っている。それにも拘らず結晶構造は大きく変化する。現時点では、単糖類に限らず、有機化合物や無機化合物のあらゆる化合物において、結晶構造を自由自在に制御することは難しい。しかし我々は、様々な方法を用いて、引き続き、単糖類の結晶構造の自在制御の方法の探求を続けている。具体的には、Fig. 14に示すHirshfeld表面解析や、Fig. 15に示す2D FingerPrintプロット解析などを用いる方法である。それぞれ結晶学の専門知識が必要となるため、ここでは詳細は割愛するが、これらを用いることにより、2つの糖分子間に働く分子間相互作用を定性的かつ定量的に議論することが可能となる。さらに我々は独自に、DV-Xα分子軌道計算を用いて、糖分子間に働く水素結合の定量的な議論を行っている。今後は更に、電子状態計算の他に、機械学習やAI計算なども含め、マテリアルインフォマティクスの手法を駆使しながら、単糖類の結晶構造における長年の謎の解明に取り組んでいきたい。