
氏名:深田 和宏
香川大学農学部 教授
1983年 名古屋大学理学部化学科卒業、1989年 名古屋大学大学院理学研究科博士後期課程満了(理学博士)、1989年 東京都立大学理学部化学科助手、2001年 香川大学農学部助教授、2005年 香川大学農学部教授
専門分野はコロイド界面化学・生物物理化学。生体関連物質(脂質)や界面活性剤などの物理化学的な性質を研究。香川大学赴任後、希少糖に関する研究に参画して分子構造や熱力学的性質を調べてきて、気がつけば20余年が経ち現在に至る。身の回りの複雑な現象が物理化学の法則によりどこまで説明出来るかに興味がある。

氏名:何森 健
香川大学国際希少糖研究教育機構 研究顧問、香川大学名誉教授
1965年 香川大学農学部農芸化学科卒業、1968年 香川大学農学部助手、同助教授、同教授、2003年香川大学希少糖研究センター教授、2008年 香川大学客員教授、香川大学名誉教授、香川大学農学部特任教授、2016年香川大学国際希少糖研究教育機構 研究顧問
専門は微生物利用学。異なる研究分野の人達との共同研究の重要性を実感している。
希少糖を解説する本シリーズの第一話では、希少糖とは何か(希少糖の定義と自然界での位置づけ)と、希少糖の歴史(地球上での希少糖の生成シナリオ及び希少糖の研究史)について記した。希少糖は「自然界に少量しか存在しない単糖及びその誘導体」である。一般的に知られている単糖には、炭素数3のトリオースから炭素数7のヘプトースまでのものがあるが、本シリーズではこのうち主に炭素数6のヘキソースを扱う。興味深い生理活性を有する希少糖には炭素数6のものが多い。その理由は一概には言えないが、生物ではD-glucoseをはじめとするヘキソースの代謝がメインであることに関係していると思われる。
シリーズ第二話の本稿では、全てのヘキソースを計画的に生産するための戦略図(イズモリング)の開発経緯と、完成した生産戦略図の意義、実際にイズモリングに従って希少糖生産を進める中で明らかになってきた問題点、そして、その問題点を解決すべく進化させた新しい希少糖戦略図(イズモリング Ⅱ)について記す。新しい希少糖戦略図で用いられた単糖のフィッシャー投影式の簡易な表示法(Izumofleet formula)についても概説する。
まず、六炭糖(ヘキソース)とヘキソースの還元で生成するポリオール(ヘキシトール)にはどれだけの種類があるかを示す。以下ではそれらの分子構造をフィシャー投影式で表し、必要に応じてアルドース、ケトース、及びポリオールをそれぞれ赤色の丸、紺色の丸、黄色の丸で代表させる(図 1)。ここで、アルドースの例としてD-glucose、ケトースにはD-fructose、ポリオールにはD-sorbitol(= D-glucitol)のフィシャー投影式を示し、それぞれの分子中の不斉炭素に*印を付した。
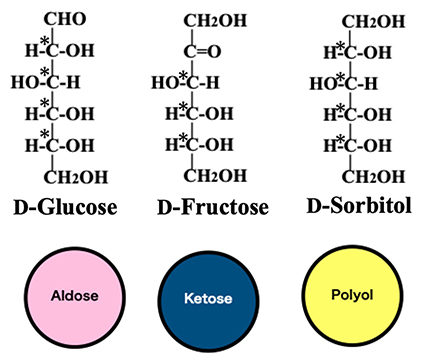
図 1を見てわかるように、アルドヘキソースの不斉炭素数は4なので24 =16種類、ケトヘキソースの不斉炭素数は3なので23 =8種類が存在する(図 2 参照)。ヘキシトールの不斉炭素数は4なので24 = 16種類ありそうだが、実際はメソ化合物であるallitolとgalactitolや、D-glucitolとL-gulitolのように同一物質となるものが6種あり、16 - 6 = 10種類になる(図 2中の黄色の丸hexitol の上段と下段間に≡が記されているものが対応する)。これらを足し合わせると計34種類となり、このうちD-glucose、D-mannose、D-galactose、D-fructose 以外は希少糖に分類され、ヘキソース・ヘキシトールの多くは希少糖であることがわかる。
次に、これら全てのヘキソースとヘキシトールを網羅的に生産する戦略図の構築にあたって定めた基本方針と、戦略図が完成するまでの経過を記す。

希少糖(ヘキソースとヘキシトール)の網羅的な生産法の基本方針は、安価で多量に入手できるD-glucoseを出発原料とし、酵素反応によってD-glucoseから他のヘキソースへと順次変換していき、最終的に全ヘキソースを酵素反応によって結びつけることに設定した。これらの反応経路をまとめて示せば、希少糖を計画的に生産するための戦略図になると考えた。ここで重要なのは、実際にどのような反応で種々のヘキソースへの変換を実現するかである。以下に、希少糖生産に利用される酵素反応について解説する。
ここで、甘味料として大量生産されている異性化糖の製造法を説明しておきたい。D-glucoseはデンプンの加水分解で安価に生産できる。しかし、D-glucoseの甘味度は砂糖の0.6~0.7と低いのでD-glucoseのみでは甘味料としての価値は限定される。一方、D-glucoseを異性化したD-fructose は砂糖の約1.2~1.5倍の甘味度を持っている。そこでD-glucoseを異性化し、D-glucoseとD-fructoseが約1対1の比率で混合した異性化糖が、砂糖より安価な甘味料として大量に生産されている。ところが生体内では遊離のD-glucoseそのままで代謝されず、まずリン酸化されてからD-fructoseに異性化されている。通常生体内には遊離のD-glucoseを異性化する酵素は存在しないのである。上記の異性化糖の生産では微生物が産生するD-xylose isomerase が使われる。この酵素の本来の基質はD-xyloseだが、D-xylose とD-glucoseの分子構造の類似性によってD-xylose isomerase は遊離のD-glucoseに対する活性も有することを利用しているのである(図 3)。
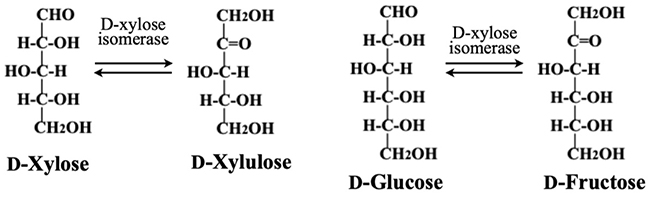
このようなヘキソース間の異性化反応は、D-galactoseとD-tagatoseの間でも考えられる。生体内でのD-galactose の代謝は主にUDP-D-galactose を経ており、人を含め生物は遊離のD-galactoseをD-tagatoseへ異性化する酵素を持っていない。しかし、微生物が産生するL-arabinose isomeraseは遊離のD-galactoseにも作用してD-tagatoseへの変換を可能にする。
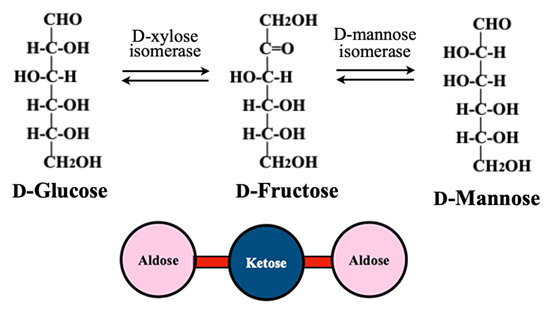
アルドヘキソースとケトヘキソース間の異性化は平衡反応であり、適したisomeraseを選択すればケトヘキソースを基質として2種のアルドヘキソースへの変換が可能である。例えばD-fructose はD-xylose isomeraseでD-glucoseに変換される一方、D-mannose isomeraseを用いた場合にはD-mannoseへの異性化が起こる(図 4)。こうしたisomeraseを用いることで、8種類のケトース全てについて2個のアルドースと結びついたブロックが8個できあがる。
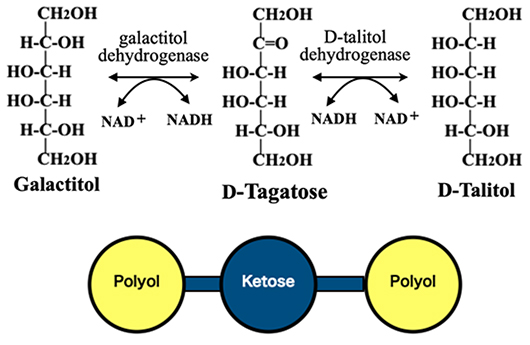
本シリーズ第一話で紹介したように、ベルトランはD-sorbitol(= D-glucitol)に酢酸菌が作用しL-sorboseに変換することを明らかにした。これはD-sorbitol dehydrogenase (acceptor) によってポリオールをケトヘキソースに変換する酸化反応である。この反応を真似てgalactitolから希少糖D-tagatose が出来たことも述べた。dehydrogenaseによる反応はisomeraseによる異性化反応と同様に可逆的反応であり、ケトースをポリオールに還元することも可能である。更に、適切なdehydrogenaseを使い分けて用いることで、一つのケトヘキソースから2種類のポリオールを生産することも出来る。そうした例として図 5には、D-tagatoseからgalactitol とD-talitolを生産する反応を示した。こうして、8種類のケトース全ては2種のポリオールと結びつけられる。
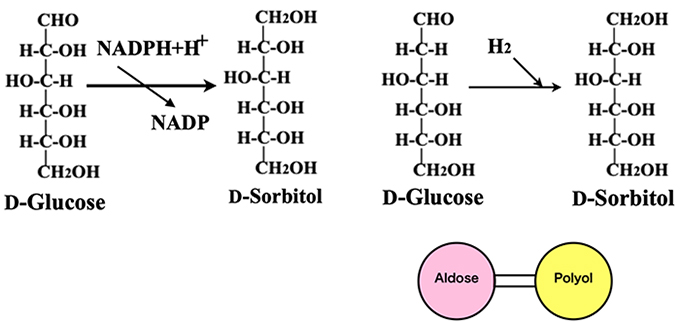
アルドヘキソースのアルデヒド基を還元してポリオールにする反応の触媒としてaldose reductase が知られている。図6にはD-glucoseからD-sorbitol(= D-glucitol)への還元反応を示した。この酵素反応には補酵素NADPが必要であり、工場スケールの生産には適さない。大量のD-glucoseを処理するには酵素の代わりにラネーニッケル触媒を用い、水素ガスでの還元(水素添加)を行う(図 6の右図)。これによってアルドースとポリオールが結びつけられる。この反応は、基質のD-glucoseを100%の収率でポリオールに還元でき、アルドースのみならずケトースの還元にも利用出来る。
ここまで説明してきた殆どの反応は以前より知られた単糖の酵素反応である。そして、酵素本来の基質と構造的に類似したヘキソースへの活性によって全てのケトースは2種のアルドース及び2種のポリオールと酵素反応で繋がれること、またアルドースは還元によりポリオールと繋がれることを述べてきた。では更に進めてヘキソースとヘキシトール計34種全てをこれらの反応で繋ぎあわすことは出来るだろうか。残念ながら、それはできなかった。まだ何かが不足していた。
希少糖生産戦略の基本方針とした「全ヘキソース間を酵素反応で結びつけること」は、ここまでの酵素反応では実現できない。そこに新しいタイプの酵素D-tagatose 3-epimerase が見出された。この酵素はD-tagatoseの3位をエピ化して対応するエピマーへ変換する(図 7)。しかも8種全てのケトースに対して活性を有していた。この新酵素の出現により、全ヘキソースを酵素反応で結びつける可能性が見えてきた。
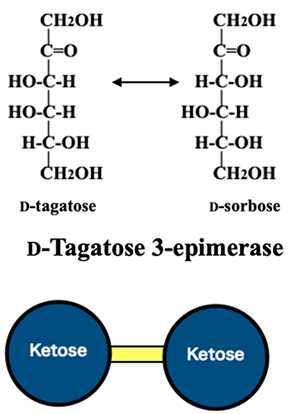
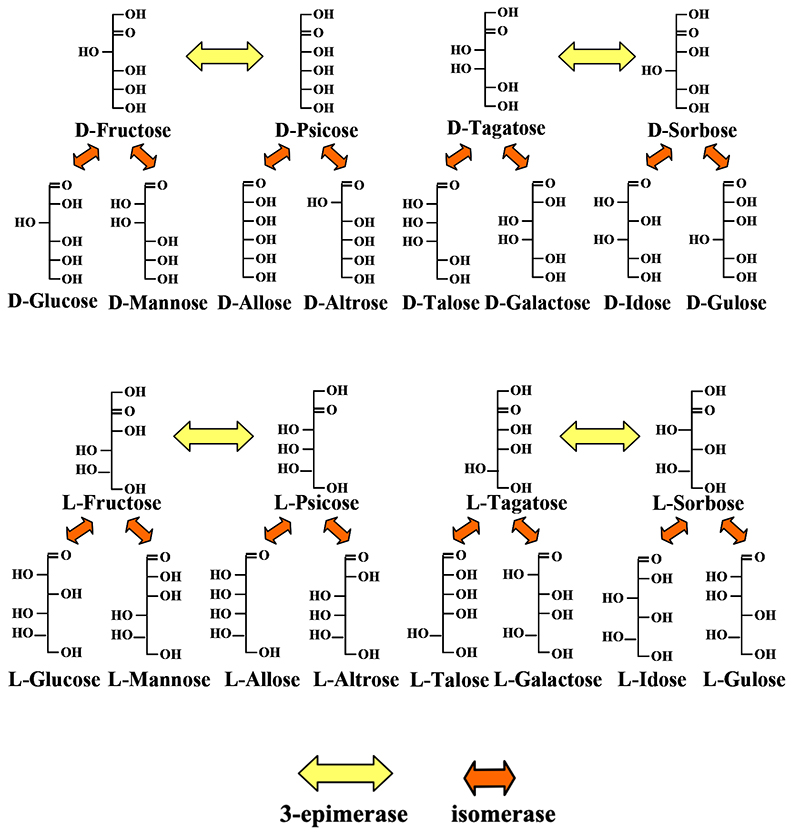
図 8にisomerase及びepimeraseによるD-型とL-型の全アルドヘキースと全ケトヘキソース間の変換を列挙した。全体は2個のケトースと4個のアルドースをユニットとする4ブロックにまとめられるが、ブロック間を結びつけることは出来ない。このギャップを埋め合わせるアイデアが必要であった。
ヘキソースとヘキシトールは全てを合わせても34種類しかない。それでプロの棋士が将棋盤なしで頭の中で将棋をするように、ヘキソースとヘキシトール分子を頭の中でイメージしてD-fructoseから出発する酵素反応をぼんやり考えていた。すると、グルリと回って元のD-fructoseに帰ってくる反応経路が浮かんだ。直ぐに紙に書き、8つのケトースがポリオールを介して連結したリングが出来上がった(図 9)。ここで重要なのは、ポリオールには図 2に示したように異なるケトースからの還元で同一物になるものが4種(L-gulitolとD-glucitol、D-altritolとD-talitol、D-gulitolとL-glucitol、L-altritolとL-talitol)存在することであった。
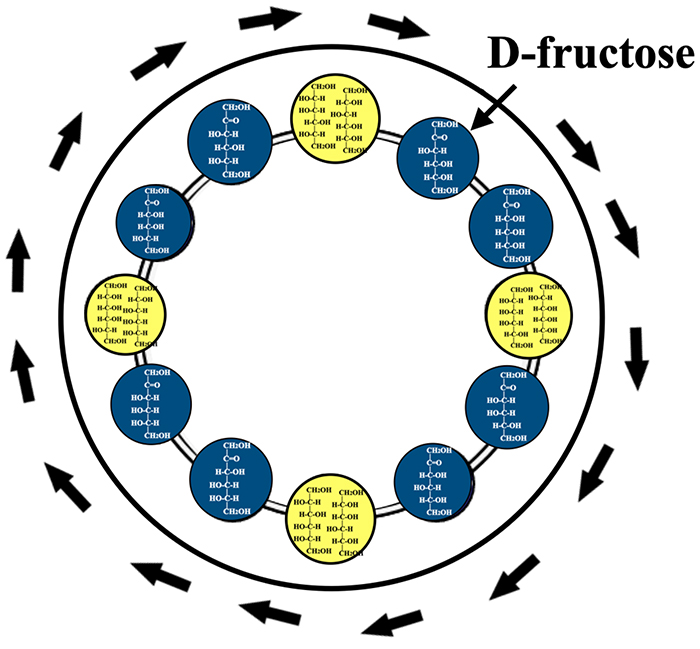
図 9を見ると、D-fructoseから出発してepimeraseによるケトース間の変換とdehydrogenaseによる酸化還元でケトースとポリオール間を順次結びつけていくと、元のD-fructoseに戻ってくることがわかる1。ヘキソースといえば真っ先に D-glucoseやD-fructose を考えてしまう。しかも出発原料をD-glucoseに想定したのでアルドースとケトース間の変換に目が行き、このようなケトースとポリオールの変換経路を考えることはなかったのである。図 9には8つ全てのケトースが含まれるので、このリングを基本とすれば全ヘキソースが繋ぎあわされた経路が見えてきそうである。
図 9のリングを基本にして他のアルドースとポリオール間の連結と配置を検討した。ケトース ⇄ ポリオール ⇄ ケトース ⇄ ケトース ⇄ ・・・のリングの周辺にアルドースを繋げ、内部にポリオールを配置した。そうすることで、全てのヘキソースとヘキシトールを酵素反応で連結することができた。図 10に完成した配置図を示す2,3。
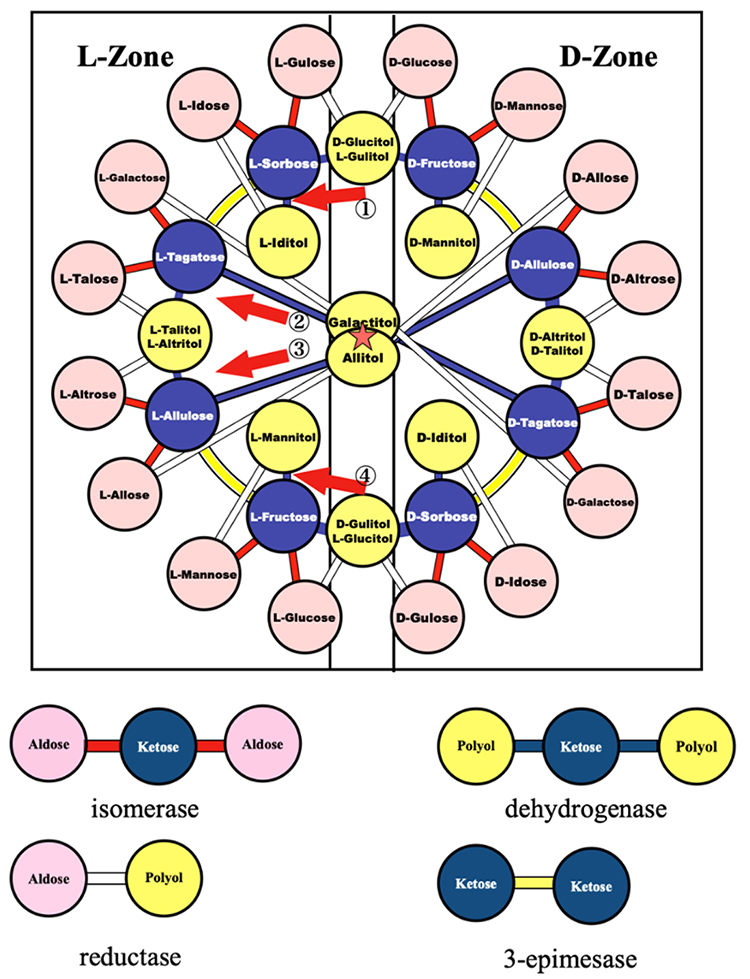
この図を最初に見た時には(科学的ではないが)「美しい」と感じた。この図の特徴を整理する。
こうして完成した戦略図をイズモリング(Izumoring)と研究室の学生が名付けた。論文投稿の際もこの名称をそのまま記載したが、より適切な名称に変更するよう査読者から指摘されるだろうと思っていた。個人名(イズモリ)を連想させるような名称は不適切とされるに違いない。ところが英文校閲の指示はあったが、Izumoringに関する指摘は無いまま受理となった1。この後、海外でIzumoringの命名の由来を聞かれる際には「日本には国中の神様が年に一回集まる出雲というところがある。そのIzumoの輪(ring)にちなんだ名称」として説明している。
なお図 10のイズモリングは炭素数6の全ヘキソースを酵素反応で繋いでリング状に配置した図だが、テトロースやペントースにおいてもこれと同等のリングを描くことが可能であり、それぞれ炭素数4と5の希少糖を生産する際の設計図となる2。
イズモリングの完成に至った経緯を振り返ってみると「一番の幸運」として書いておかねばならないことがある。それは単糖の構造をフィッシャー投影式で認識し続けたことである。糖の研究者で単糖をフィッシャー投影式で描く人はほとんどいない。その理由は、実際の単糖の構造はフィッシャー投影式で描かれるような鎖状ではなく、pyranose型やfuranose型といった環状が大半だからである。フィッシャー投影式が用いられるのは、単糖内の水酸基の立体配置を比較するなどの極めて限られた場合のみに過ぎない。しかしイズモリングの作成では、もっぱら「糖分子の影」を表すだけのフィッシャー投影式によって単糖の構造変換をイメージした。イズモリングを完成できた最大の理由は単糖をフィッシャー投影式で考えたからで、もし頭の中で環状構造をイメージしたとすると、構造が複雑過ぎてリング状の反応経路には思い至らなかっただろう。
単糖の異性化やエピ化を促進する酵素のX線結晶構造解析によると、溶液中の単糖は環状構造であるが、これらの酵素と結合した際には開環し鎖状体として反応中間体を形成することが示されている4,5。この反応機構から考えると、単糖をフィッシャー投影式でイメージして一連の構造変換を繋ぎあわせたことには合理性があったといえよう。
イズモリングが出来上がった後、大変興味深い論文を見つけた。それは希少糖L-glucitolを分解する微生物に関する研究である。その微生物にはL-glucitol→D-sorbose→D-tagatose→D-galactoseの代謝経路が存在していた。これは正しくイズモリング中に見られる経路である。この経路によってL-glucitolをD-galactoseに変換し、更にDe Ley-Doudoroff pathway でD-galactoseを代謝することがこの微生物の生存戦略なのである。イズモリングは希少糖の生産戦略として考案したものだが、自然界の微生物もイズモリングの経路を使っていたのである6。
大規模に希少糖を生産した場合に、誤って環境中に大量の希少糖を流出してしまう事故を想定し、曝気法での希少糖の分解性を検討した。学内汚水処理施設の曝気槽からの採取液に希少糖を添加してエアーポンプで空気を送り込み、希少糖濃度の時間変化を測定した。その結果、曝気条件によっては遅い場合もあるが希少糖の濃度は確実に減少し、希少糖は微生物によって分解されることが示された。今のところ分解されない希少糖はない。分解経路の詳細は明らかでないが、曝気槽内の微生物もイズモリングの経路を用いて希少糖を代謝している可能性がある。
こうした事実を目にすると、未だ知られていない生物の代謝経路や、自然界での希少糖の存在意義について、あらためて考えさせられるのである。
イズモリングに示されている単糖間の相互変換は、ポリオールが関与する酸化還元反応を除くと、変換前後で組成式(C6H12O6)が変わらない平衡反応である。したがって、平衡状態に至るまで反応進行させて糖組成を調べ、平衡定数(K)を決定すれば、反応物と生成物との熱力学的安定性の違いの指標である反応ギブズエネルギー(ΔrG)が以下の式から求められる。
Δr G=-RT ln K ⋯⋯⋯ (1)
ここでRは気体定数、Tは絶対温度である。例えばD-glucose(Glc)を原料にしてD-fructose(Fru)に異性化させた場合の25℃での平衡状態の濃度比は約1対0.85(即ちK = 0.85)で、これよりGlc → Fruの反応ギブズエネルギーは約0.4 kJ mol-1となって両者間の熱力学的安定性の差が定量的に評価できる。これと同様の手続きをイズモリングに示された他の単糖間の相互変換に対して順次行うことで、全てのヘキソースの熱力学的安定性が比較可能となる。こうして現在までに測定されたヘキソース間の変換反応の平衡組成を、Glcを基準にしてまとめたのが図 11で、それぞれの球の体積が平衡状態での相対的な存在量を表している。ここでは「鏡像体の熱力学的な性質は同じ」という原則によりD体とL体の平衡組成は変わらないものとし、イズモリングと同じ位置にD体とL体のヘキソースを配置した。なお、イズモリングではallulose(Alu)とtagatose(Tag)間はアリトール/タリトールを介した酸化還元反応で結ばれるが、それらの反応の平衡関係は不明なので、図 11の上部と下部のブロックを結びつける反応経路は描かれていない。ただし、Gal(Sor)とGlc間のΔrGの値は文献データから算出可能で7、Glcを基準にしたGal(Sor)の平衡濃度は(1)式から算出できるので、全ての球の体積は平衡状態での相対的存在量を反映したサイズとして表されている。
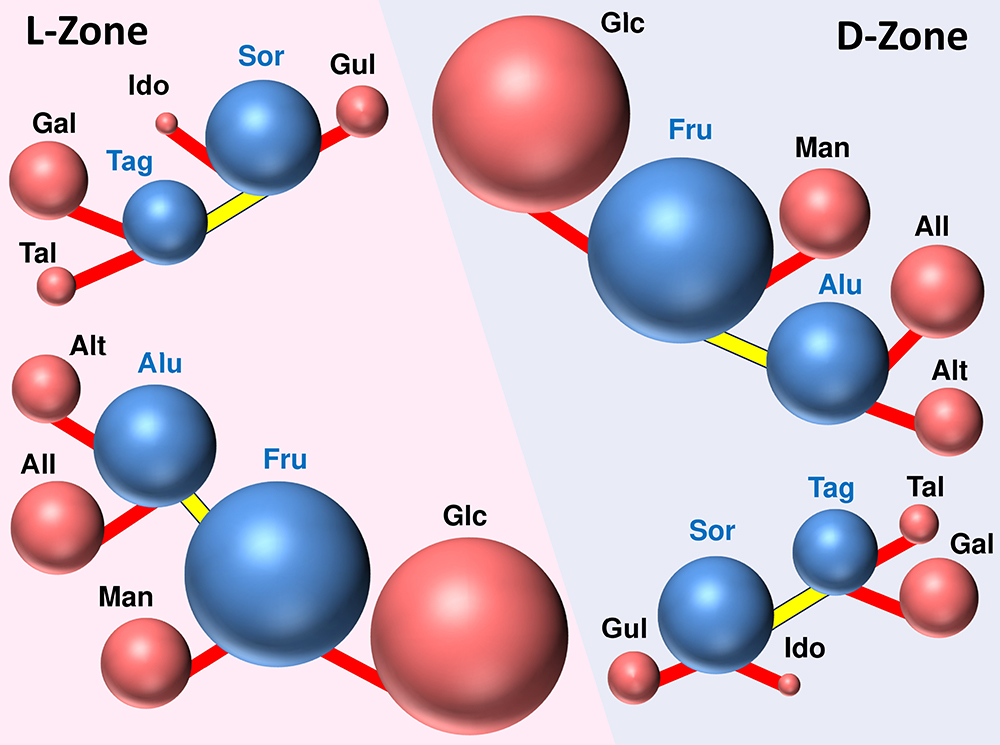
図 11より、以下のことがわかる。
以上より明らかなことは、isomeraseとepimeraseによる反応では、グルコースを原料として他の様々なヘキソースを生産することは大変非効率であり、反応させてもごく僅かな希少糖しか得られないということである。この理由を、水溶液中でのヘキソースの分子構造に基づいて考察する。
前述したようにヘキソース分子はフィッシャー投影式で描かれるような鎖状ではなく、殆どがpyranose型やfuranose型といった環状体として存在している。したがってヘキソースの熱力学的安定性はこれらの分子構造に基づいて考察しなければならない。さらに、水溶液中のヘキソースはpyranose型とfuranose型それぞれのアノマー位がα及びβのものと、少量の鎖状体の計5種の互変異性体が平衡に共存する混合状態となっていることも考慮する必要がある。
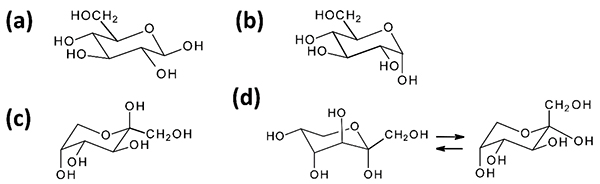
図 12には、pyranose型のD-glucoseとD-fructoseのα及びβアノマーの分子構造を示した。このうちβアノマーのD-glucose(β-D-glucopyranose)では4つの水酸基全てが4C1配座のピラノース環に対してエクアトリアルなので、特に安定な構造とみなされている。実際、25℃の水溶液中のD-glucoseの62%はβ-D-glucopyranoseであり、残りの38%はアノマー位水酸基がアキシャルのα-D-glucopyranoseである。一方、D-fructoseのβアノマー(β-D-fructopyranose)では、嵩高いCH2OH基がエクアトリアル配座をとる1C4配座のピラノース環に、アキシャル水酸基が2つ、エクアトリアル水酸基が2つの構造となり、この互変異性体が水溶液中で64%を占める。α-D-fructopyranoseは、ピラノース環が4C1配座だと2つの水酸基が1, 3-ジアキシャル配座、1C4配座だとCH2OH基がアキシャル配座になって構造が不安定であり、溶液中で僅か3%しか存在しない。そしてD-glucoseでは殆ど無かったfuranose型が32%、鎖状体が1%の構成比になっている。
fructoseはglucose と並び立つ熱力学的に安定なヘキソースであるが、その安定性の原因はピラノース環に関する考察のみでは不十分で、フラノース環の構造安定性も関係していると思われる。そこで、全ヘキソースについて水溶液中での互変異性体の平衡存在比率を参照し8,9,10、それぞれの熱力学的安定性との関係性を見てみた(図 13)。
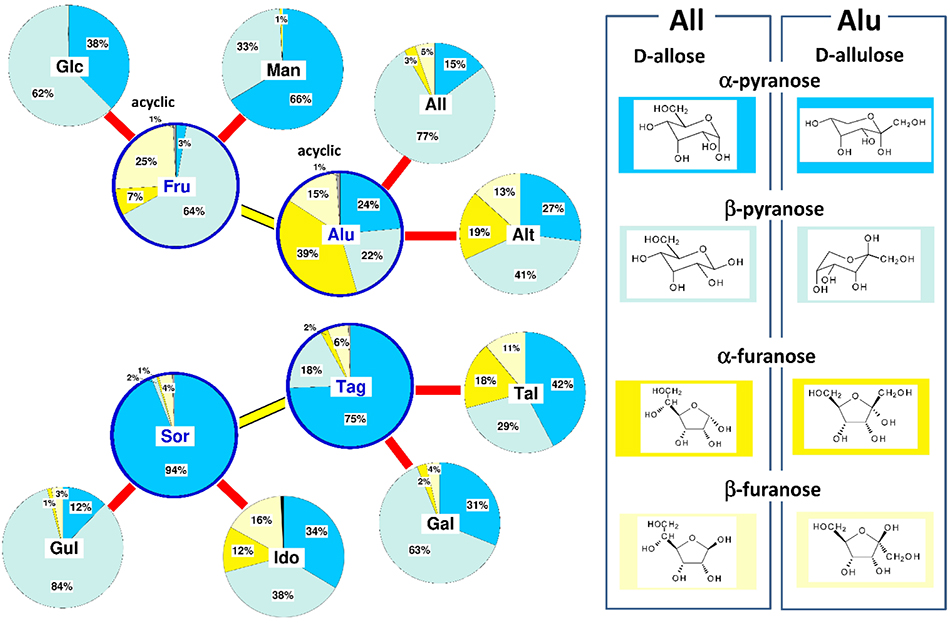
図 12に示したようにfructose以外のケトヘキソースも比較的安定であるが、互変異性体の構成比はかなり異なっている。allulose(Alu)はフラノース型を多く含み、α及びβアノマーをあわせると50%を超えている。一方、tagatose(Tag)とsorbose(Sor)ではα-及びβ-フラノース型はあわせても10%以下にすぎず、α-ピラノースが大半を占めている。これはTagとSorの4C1配座のピラノース環では水酸基の1, 3-ジアキシャル配座による構造不安定化が無くα-ピラノースが他の互変異性体より顕著に安定なことによる。アルドースではmannose(Man)、allose(All)、galactose(Gal)の安定性は中程度で似通っており、いずれもフラノース型は10%以下でピラノース型が多い。安定度の低いアルドース(Alt, Tal, Gul, Ido)になると、アキシャル配座になる水酸基が増加してピラノース環は不安定化し、gulose(Gul)を例外とするがフラノース型の割合が3割程度まで占めるようになる。
全体をまとめると、ヘキソースの熱力学的安定性は、基本的にはピラノース環を形成した時の安定性に支配されているようである。そしてアキシャル配座の水酸基が増えてピラノース環の安定性が低下するとフラノースの割合が増加する傾向が見られる。しかしこの傾向には当てはまらない例外もある。特にallulose(Alu)は比較的安定性が高いにもかかわらずフラノースの割合が多く、他のヘキソースとの相違が著しい。この相違がAluの理化学的性質や機能性に影響を与える可能性も考えられる。
イズモリングに示されたヘキソース間の変換反応の平衡定数を利用することで、希少糖を含む全ヘキソースの熱力学的安定性を明らかにすることが可能となった。希少糖生産の戦略図として作成されたイズモリングが、希少糖の基本的性質を知るためにも活用され、生産戦略上で解決すべき課題も明瞭にした。
全ヘキソースを酵素反応で繋げていくことによって、希少糖を計画的に生産するための戦略が明確となった一方、その弱点も見えてきた。すなわち、熱力学的安定性の低いヘキソースは、異性化やエピ化などの平衡反応では低い収率でしか得られず、生産困難であることが示された。これは特に、ケトースからアルドースを生産する場合に解決すべき課題である。
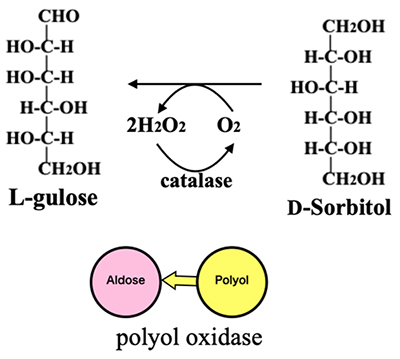
ケトースからアルドースを生産するには、isomeraseによる異性化の他に、ケトースをポリオールにしてから分子末端を酸化してアルドースにする経路も考えられる。そして、この反応を進行させる酵素としてポリオール・オキシダーゼがあり、酸素/カタラーゼの存在下でポリオールを全てアルドースに変換することが出来る(図 14)。実際、ある種のカビが生産するポリオール・オキシダーゼは約95%の収率でD-sorbitolをL-guloseに変換した11。Isomeraseでは生産困難なTalや Idoも、適当なポリオール・オキシダーゼが得られればそれぞれタリトールやイジトールから高収率で生産可能になるであろう。そこで、ポリオール・オキシダーゼによる反応経路に基づき、ヘキソース・ヘキシトールの配置換えをしてイズモリング の改定版(イズモリング Ⅱ)の作成に着手した。
元のイズモリング ではケトースとヘキシトールを繋げたリングを基本とした。イズモリング Ⅱでもこの基本は同じであるが、8つのケトースだけからなるリングを中心とし、その外側の同心円上にヘキシトール、さらにその外側の同心円上にアルドースを配置した。イズモリング Ⅱでは単糖の配置を変えているが、単糖間を繋ぐ基本的な酵素反応は元のイズモリングと同一である。
これまでイズモリングでは図中に糖の名称のみを記していたが、分子構造も記載すれば理解度が高まり利用しやすくなると考えていた。しかしフィッシャー投影式をそのまま用いるのは煩雑である。そこで狭いスペースでも記載可能な表記法を考案し、共同研究者であるオックスフォード大学のジョージ・フリート教授の名前をとってIzumofleet formulaと名付けた。例えばD-allulose → D-altritol (D-talitol) → D-tagatoseの変換をフィッシャー構造式で記載すると以下のようになる。
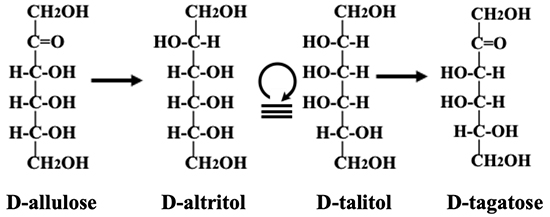
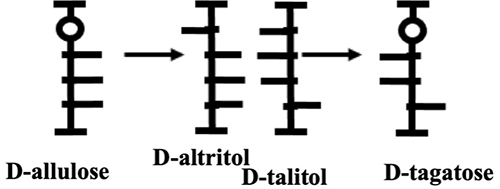
このように全てをフィッシャー投影式で記載することは煩雑で、分かりにくいのである。Izumofleet formula の方式は簡単である。以下(図 16)に示す約束で容易に解ることと思う。
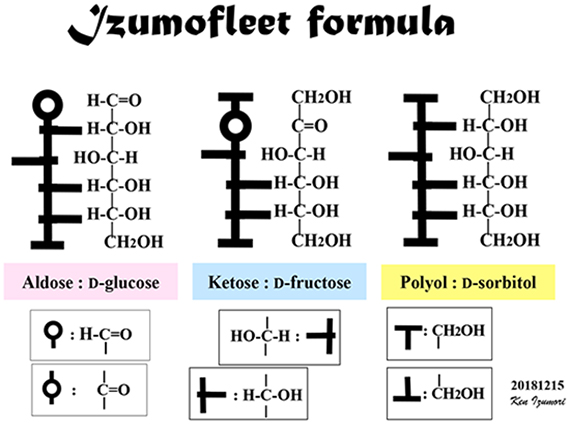
図 15の反応経路をIzumofleet formula で記載すると下図のようになる。
最後に、Izumofleet formula を用いて表記した新しい希少糖生産戦略図(イズモリング Ⅱ)を図 18に示す。
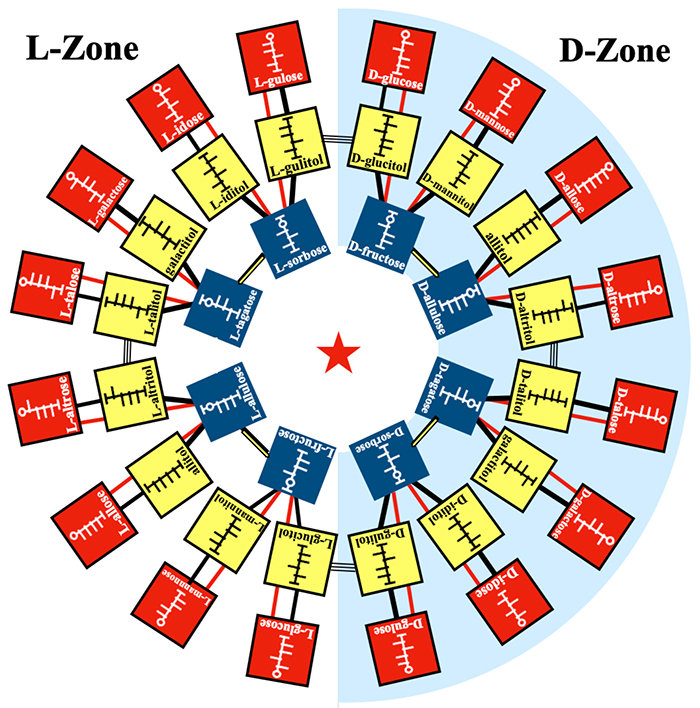
初代のイズモリング(イズモリング Ⅰ)とイズモリング Ⅱはいずれも34種のヘキソースが酵素反応で繋がれており、8種のケトースから成るリングの周囲にD体とL体のアルドースを点対称の位置に配置する基本は全く同じである。希少糖生産戦略図としての役割も同じであるが、イズモリング Ⅱでは中心部にあるケトースがその外側のポリオールに変換され、更に外側のアルドースにする経路が青線で示している。ケトースからポリオールへの変換はラネーニッケル触媒での水素添加、ポリオールからアルドースへの変換はポリオール・オキシダーゼによる酸化を想定しており、この経路であれば熱力学的安定性の低いidose 等でも効率的な生産が期待できる。なお、ケトースとアルドース間を繋ぐ赤線は(ポリオールを経由しない)isomeraseによる異性化反応であり、比較的熱力学的に安定なアルドースをケトースから生産する場合には、こちらの経路を利用すれば良い(例えばallulose → alloseの場合)。初代イズモリング(イズモリング Ⅰ)作成の際は、D-glucoseを出発原料として全てのヘキソースを酵素反応で繋ぐことからスタートしたが、イズモリング Ⅱではケトースからの変換を中心にして見た全ヘキソースの生産戦略図となっている。
イズモリング Ⅱはイズモリング Ⅰの進化形である。D-glucose等の入手しやすいアルドースやポリオールを原料とする場合はイズモリング Ⅰを、ケトースを原料とする場合はイズモリング Ⅱを用いるなど、それぞれを適切に使い分けることが有効であろう。
本稿に続く第三話からは、個々の希少糖の性質や、希少糖生産に使われる酵素について、そして希少糖の用途開発を産学官で協力して進めている現状について紹介していく。