氏名:神野 尚三
九州大学大学院医学研究院神経解剖学分野 教授
1992年九州大学医学部卒業、同年九州大学医学部附属病院精神科神経科入局、2000年九州大学大学院医学系研究科修了・博士 (医学)、同年九州大学大学院医学研究院神経形態学分野助手に着任。2004年連合王国Oxford大学MRCANU 博士研究員、2006年帰国。2008年九州大大学院医学研究院神経形態学分野学講師、2010年九州大大学院医学研究院神経形態学分野学准教授、2011年九州大大学院医学研究院神経解剖学分野教授、現在に至る。
細胞外マトリックス (extracellular matrix, ECM)は、脳のホメオスタシスに重要な役割を果たしていることが知られている1。その作用機転は多岐に渡るが、成長因子や栄養因子、神経伝達物質などを介してニューロンやグリアの制御に関わることが明らかになってきている。また、発達期の神経新生や軸索の伸展に細胞外マトリックスが関ることは従来から知られていたが2、成体の海馬においてニッチと呼ばれる神経幹細胞の微小環境を形成しており、神経幹細胞の分裂やニューロンへの分化に関わっていることが近年分かってきた3。コンドロイチン硫酸プロテオグリカン (chondroitin sulfate proteoglycan, CSPG)は、脳の細胞外マトリックスの主要な分子の一つであり、コアタンパクとグリコサミノグリカンの側鎖によって構成されている。本稿では、アルツハイマー病の治療に用いられているメマンチンの神経幹細胞のニッチに対する作用の研究に基づき、抗認知症薬の新規ターゲット分子としてのCSPGの可能性について概説する。
海馬は認知と情動の中枢であり4、成体でもニューロンが産生されている数少ない脳領域の一つである。神経幹細胞は海馬歯状回に分布しており、新生ニューロンは約2ヶ月かけて成熟し、神経回路に組み込まれる5。海馬の新生ニューロンは認知と情動の制御に重要な役割を果たしており6、加齢に伴う新生ニューロンの減少は認知機能障害の一因になっている。近年我々は、成体海馬神経新生についての研究に取り組んできた7。2018年には、海馬歯状回の細胞外マトリックスのCSPGが神経幹細胞のニッチとして、“豊かな環境”による神経新生の促進に関わっていることを明らかにした8。その後、同様の報告が相次いでおり、細胞外マトリックスを構成している様々な分子による海馬の神経新生の制御機序は、神経科学研究のトピックスの一つになっている9。
メマンチンは、NMDA型グルタミン酸受容体のオープンチャンネル阻害剤であり、アルツハイマー病の治療に用いられている10。先行研究では、酸化的ストレスや興奮毒性からニューロンを保護することで、メマンチンが認知機能の低下を抑制している可能性が示唆されている11。しかしながら、その作用機序の詳細は不明な点が多い。本研究で我々は、メマンチンにはコラーゲンIIとアグリカンによって構成されている軟骨の細胞外マトリックスの分解を抑制することが報告されていることに着目し12、独自の研究に取り組んだ。
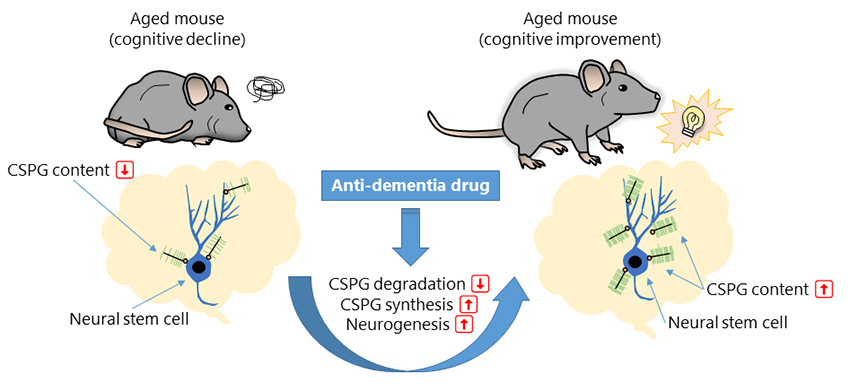
研究を始めるにあたり、若齢マウスと加齢マウスを用いて、成体海馬神経新生と海馬の細胞外マトリックスの加齢変化に対するメマンチンの作用を検討した。実験では、海馬歯状回(dentate gyrus, DG)における分子マーカーの発現パターンに基づき、神経新生関連細胞を同定した(図 1A-C)。加齢マウスのメマンチン投与群(memantine, MEM)では、コントロール群(vehicle, VEH)に比較して、神経新生関連分子の染色性が増強していた。次に、オプティカルダイセクター法13を用いて、空間分布密度 (numerical density, ND)の計測を行った(図 1D-G)。神経幹細胞(neural stem cell, NSC)や神経前駆細胞(neural progenitor cell, NPC)、新生ニューロン(newborn granule cell, NGC)の分布密度はいずれも、若齢マウスに比較して加齢マウスのコントロール群で低下していた。一方、加齢マウスのメマンチン投与群では、神経前駆細胞と新生ニューロンの分布密度が増加していた。海馬のアストロサイトの分布密度は、加齢やメマンチン投与の影響は認められなかった。
海馬歯状回とアンモン角における細胞外マトリックスの発現量の加齢変化とメマンチンの作用を検討するため、レクチン (Wisteria floribunda agglutinin, WFA)を用いてCSPGを標識し、蛍光強度の計測を行った(図 1H-K)。歯状回では、WFAの蛍光強度が加齢によって低下し、メマンチンの投与によって上昇していた(図 1L, M)。一方で、アンモン角のCA1領域とCA3領域では、WFAの蛍光強度の加齢変化やメマンチンによる変化は認められなかった(図 1N-Q)。これらの結果は、海馬歯状回のCSPGの発現量をメマンチンは増加させ、加齢に伴い低下した新生ニューロンの産生を回復させる可能性を示唆している。
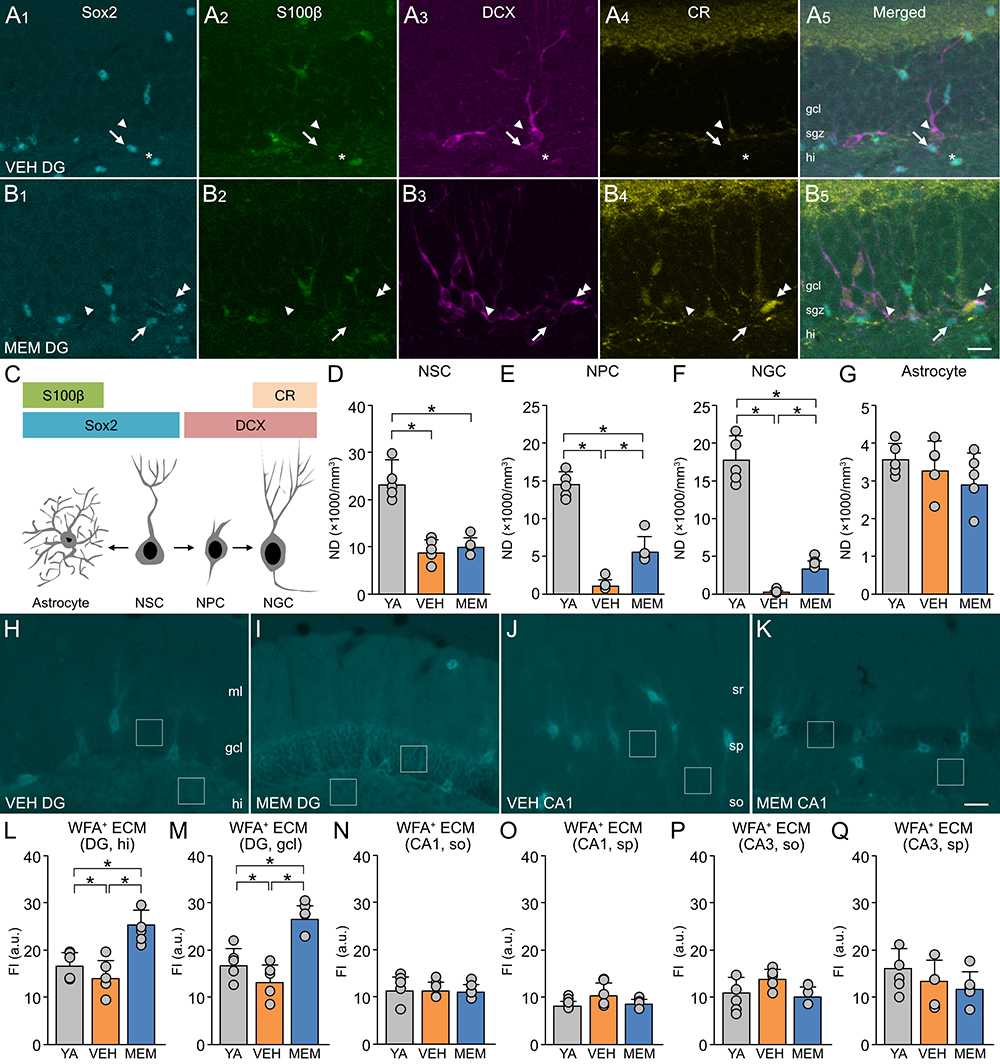
加齢マウスの海馬におけるCSPGの合成と分解に対するメマンチンの作用を明らかにするため、CSPG関連遺伝子の発現変動をreverse transcription-quantitative polymerase chain reaction(RT-qPCR)により計測した(図 2A-G)。CSPG合成の律速酵素とされるchondroitin sulfate N-acetylgalactosaminyltransferase 1(CSGalNAcT1)の海馬歯状回における発現レベルは、メマンチンの投与によって上昇していた。その一方で、CSGalNAcT2 や、chondroitin sulfate synthase 1(CHSY1)、chondroitin polymerizing factor 2(CHPF2) などのCSPG合成酵素の発現レベルは、メマンチンの投与では変化しなかった。同様に、CSPGの硫酸化に関わるchondroitin-4-sulfotransferase(C4ST)の発現レベルは、メマンチンの投与では変化しなかったが、C6STの発現レベルはメマンチンの投与によって海馬歯状回で上昇していた。一方で、アンモン角ではこれらのCSPG合成酵素の発現変動は認められなかった。
比較のため、CSPGの分解酵素の発現変動をRT-qPCRを用いて検討した(図 2H-N)。海馬歯状回とアンモン角のいずれにおいても、matrix metalloproteinase 2(MMP2)、MMP3、a disintegrin and metalloproteinase with thrombospondin motifs 1(ADAMTS1)、ADAMTS4、ADAMTS5の発現レベルはメマンチンの投与では変化しなかった。一方で、海馬歯状回におけるMMP9の発現レベルはメマンチンの投与によって低下していた。これらの結果は、メマンチンの投与によって、加齢マウスの海馬歯状回におけるCSPGの合成酵素が増加し、分解酵素が減少することで、CSPGの発現量が増加する可能性を示唆している。
上記の結果を確認するため、high performance liquid chromatography (HPLC) を用いて、CSPGの発現量を測定した(図 2O-R)。海馬歯状回におけるCSPGの全発現量は、メマンチンの投与によって増加していた。また、0-硫酸化コンドロイチン(CS-0)と6-硫酸化コンドロイチン(CS-6)の発現量はメマンチン投与で増加していた。その一方で、4-硫酸化コンドロイチン(CS-4)の発現量はメマンチン投与による変化は認められなかった。これらの結果は、メマンチンの投与によって、海馬歯状回におけるCSPG合成酵素と分解酵素の発現レベルが変化し、CSPGの発現量が増加していることを支持するものである。
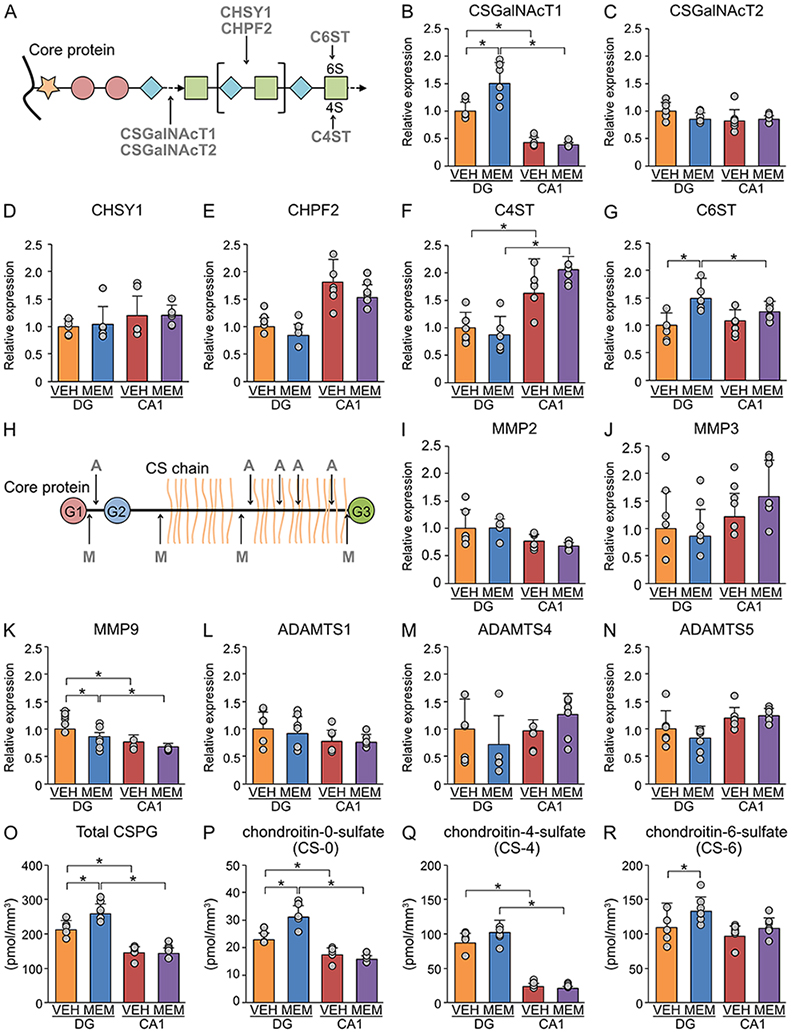
成体海馬神経新生の制御には各種の神経栄養因子が関わっていることが知られている14。また、神経栄養因子とCSPGの間に相互作用が存在することも明らかになっている15。このため我々は、脳由来神経栄養因子(brain-derived neurotrophic factor, BDNF)関連遺伝子に対するメマンチンの作用をRT-qPCRを用いて検討した。海馬歯状回とCA1領域のいずれにおいても、BDNFの発現レベルはメマンチンの投与によって上昇していた(図 3A)。また、海馬歯状回では、tropomyosin receptor kinase B(TrkB)やcAMP response element binding protein(CREB)、nerve growth factor(NGF)、TrkAの発現レベルはメマンチンの投与によって上昇していたが、protein kinase B(Akt)や extracellular signal regulated kinase(ERK)、calmodulin-dependent protein kinase II(CaMKII)の発現レベルにメマンチンの投与による変化は認められなかった(図 3B-H)。一方で、CA1領域では、これらの分子の発現レベルにメマンチンの投与による変化は認められなかった。
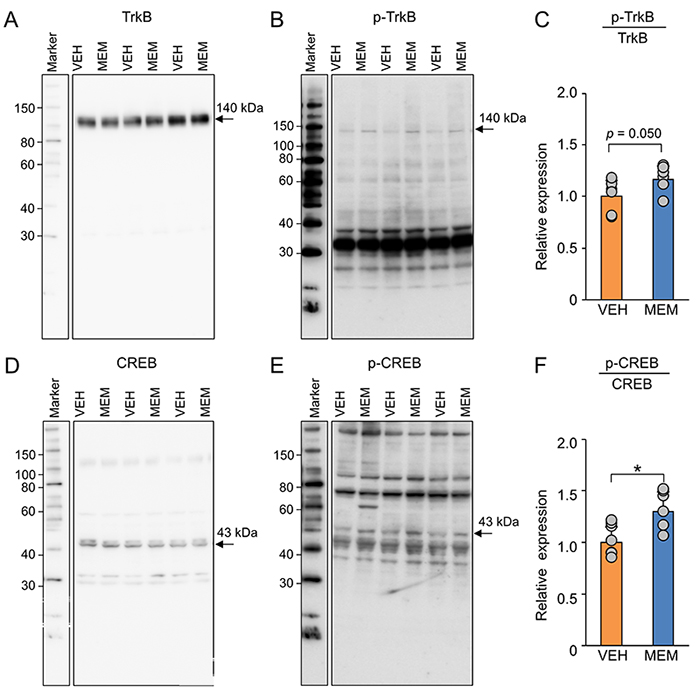
メマンチンの投与でBDNF関連遺伝子の発現レベルが海馬で上昇していたことから、BDNF下流分子のリン酸化について、ウェスタンブロットを用いて解析した(図 4)。その結果、TrkBとCREBのリン酸化率がメマンチンの投与で上昇していることが示された(図 4)。これらから、メマンチンは海馬歯状回におけるBDNFシグナル伝達を活性化することが示唆される。
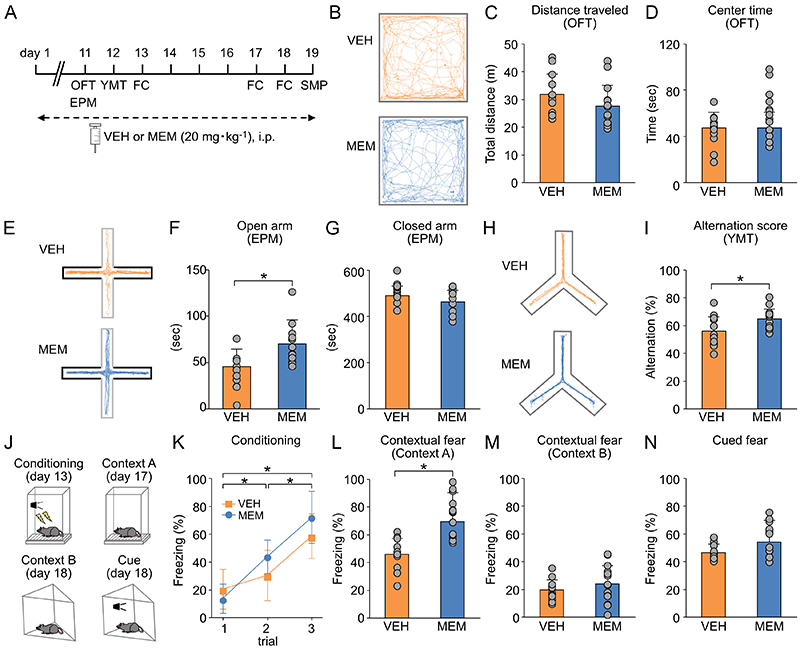
加齢マウスの認知と情動に対するメマンチンの効果について、行動テストバッテリーを用いて半網羅的に検討した(図 5A)。オープンフィールド試験(OFT)におけるセンターゾーン滞在時間(図 5B-D)にはメマンチンによる変化は認められなかったが、高架式十字迷路試験(EPM)におけるオープンアームの滞在時間(図 5E-G)は、メマンチン投与によって延長した。Y字迷路試験 (YMT)における交替率はメマンチンの投与によって改善した(図5H, I)。恐怖条件づけ試験では、海馬依存的とされる文脈記憶がメマンチンの投与によって改善していた(図 5J-M)。一方で、扁桃体依存的とされる手がかり記憶については、変化は認められなかった(図 5N)。これらの結果は、メマンチンの投与は加齢マウスの不安関連行動を抑制し、作業記憶と文脈記憶を改善する作用を有する可能性を示唆している。
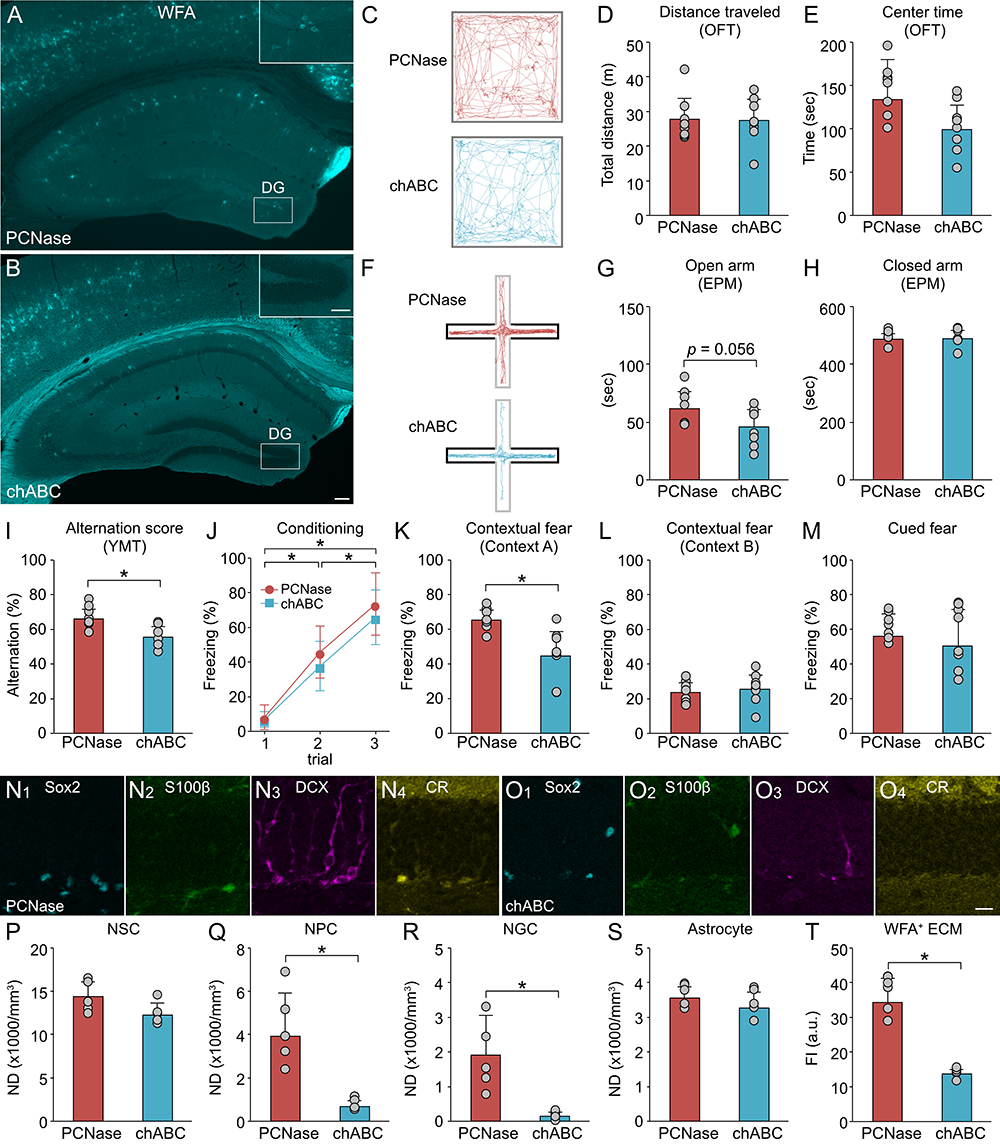
細胞外マトリックスの有無によるメマンチンの作用の違いを確認するために、薬理学的な検討を行った。実験では、メマンチンを投与した加齢マウスの海馬歯状回にchondroitinase ABC(chABC)を注入し、CSPGを分解した(図 6A, B)。コントロールとして、メマンチンを投与した加齢マウスの海馬歯状回にpenicillinase(PCNase)を注入した。オープンフィールド試験におけるセンターゾーン滞在時間 に変化はなかった(図 6C-E)。一方で、高架式十字迷路試験におけるオープアーム滞在時間はCSPGの分解によって減少する傾向が認められた。Y字迷路試験における交替率は、CSPGの分解によって低下していた(図 6I)。恐怖条件づけ試験では、メマンチンを投与した加齢マウスでは、CSPGの分解による海馬依存性の文脈記憶の低下が認められた(図 6J-M)。これらから、メマンチンの作用には海馬歯状回のCSPGが関わっていることが示唆される。
海馬歯状回のCSPGを分解したメマンチン投与マウスについて、分子マーカーを用いて神経新生の変化を検討した(図 6N, O)。神経幹細胞とアストロサイトの分布密度については、CSPGの分解による影響は認められなかったが、神経前駆細胞や新生ニューロンの分布密度はCSPGの分解に伴い低下していた(図 6P-S)。また、WFAでCSPGを標識し、chABC投与によって染色強度が低下していることを確認した(図 6T)。これらの結果は、メマンチンの認知機能改善作用には、海馬歯状回におけるCSPGの発現量の増加と、それに伴う神経新生の促進を介するメカニズムが存在する可能性を示唆している。
今回の研究成果から、加齢マウスの認知機能を改善するためには、神経幹細胞のニッチを構成するCSPGの合成と分解に関る分子の制御が重要であることが示唆される(図 7)。さらに、メマンチンの認知機能改善作用には、海馬歯状回のCSPGの発現量の増加と神経新生の促進を介するメカニズムが存在していることが明らかになった。今後は、CSPGの合成と分解に関わる分子を制御するメカニズムを同定し、認知機能の改善を可能にしている基本原理を明らかにしたいと考えている。さらに、神経細胞をターゲットにしてきた従来の抗認知症薬に代わる、細胞外マトリクスのCSPGを新規ターゲット分子とする革新的な認知症の治療薬の開発につながることが期待される。