
氏名:辻 祥太郎
群馬医療福祉大学 医療技術学部教授
1991年北海道大学薬学部卒業。1996年北海道大学大学院薬学研究科博士課程修了 博士(薬学)。静岡県立大学薬学部 助手、大阪府立成人病センター研究所 博士研究員、大阪大学微生物病研究所 助手、Florida Atlantic University 博士研究員、神奈川県立がんセンター臨床研究所 主任研究員を経て、2021年より現職。神奈川県立がんセンター着任後の2010年頃より中皮腫を中心に抗体医薬品の研究開発を行っている。
抗体医薬は、抗体ヒト化技術と生物製剤の製造技術の発展、そして優れた薬効により、急速に普及してきた医薬品である。今日、ブロックバスターには多くの抗体関連薬がならび、抗体医薬は医薬品として確固たる位置を占めるに至ったと言える。一方で、疾患特異的な治療に適した標的の枯渇が進んでおり、抗体医薬の開発では次世代の標的抗原の探索が重要な課題となっている。
我々は難治がんである悪性中皮腫に対する特異的がん抗原の探索を行っている。中皮腫は優れたがんマーカーが長らく見つからず、病理診断にも苦慮する「特徴の薄い」がんであった。我々が開発した抗中皮腫抗体は、新規タンパク質抗原の「中皮腫特異的な糖鎖修飾を含む糖ペプチド領域」を認識し、中皮腫の診断と治療に貢献する新規抗体医薬シーズとして、また、糖鎖を標的とする創薬シーズとして極めて有望な抗体である。本稿では、その研究開発の経緯と今後の臨床応用への展望について紹介したい。
がん化により細胞の糖鎖修飾が変化することは古くから知られている。特に糖鎖修飾が変化したムチン型膜タンパク質の検出は腫瘍マーカー検査として臨床の場で広く使用されており1,2、抗体医薬の標的枯渇に伴い次世代の標的抗原として「がん糖鎖抗原」が注目を集めている3。一方、腫瘍における糖鎖変化の多くは糖鎖構造の単純化や糖鎖付加部位の変化が中心で、糖鎖構造自体が腫瘍特異的であることは少ない4。抗体が腫瘍特異性を示すためには糖鎖自体ではなく、近傍の糖鎖修飾によるコアタンパク質の配座変化を認識する5、あるいは変化した糖鎖とペプチドを同時に認識する6必要があることが明らかとなりつつある。
しかし、このような糖鎖付加ペプチドを特異的に認識する抗体の報告は少なく、抗体がどのように糖鎖付加ペプチドを認識しているのかを明らかにできた例はさらに少ない。「組織特異的なタンパク質抗原」上にある「腫瘍特異的な糖鎖修飾」を認識できるような抗体はがん細胞に対する特異性という面で極めて優れた抗体医薬になりうるポテンシャルがあるものの、糖鎖とペプチドを同時に認識できる疾患特異的な抗体が本当に存在するのか明確ではないというのが現状であった。
我々が医薬品開発の標的にしている悪性中皮腫は、過去のアスベストの吸入ばく露により発生する治療抵抗性の難治がんで、アスベストによる健康被害の代表的な疾患として、近年、大きな社会問題となっている。中皮腫は遺伝子変異や特徴的な遺伝子の発現が少なく分子病理学的な診断が困難であり、診断には複数の抗体を用いた免疫組織染色を行うことが必要となる7。しかし、複数の抗体を用いた上でも経験豊富な専門家ですら診断に苦慮する症例がしばしば見られ、特異性と感度に優れた中皮腫のがん抗原の発見が渇望されてきた。
我々は、単純な遺伝子発現量解析では中皮腫に特異性の高いがん抗原を見つける事は困難と考え、中皮腫特異的な翻訳後修飾(特に糖鎖修飾)を捉える事が可能なモノクローナル抗体作製により、中皮腫がん抗原の探索を進めた。その結果、中皮腫に対して既存のマーカーよりはるかに優れた感度と特異性を示し、シアル化修飾されたタンパク質抗原を認識する抗中皮腫抗体SKM9-2を開発し、さらにその抗原として未知のムチン様膜タンパク質HEG1の同定に成功した8。
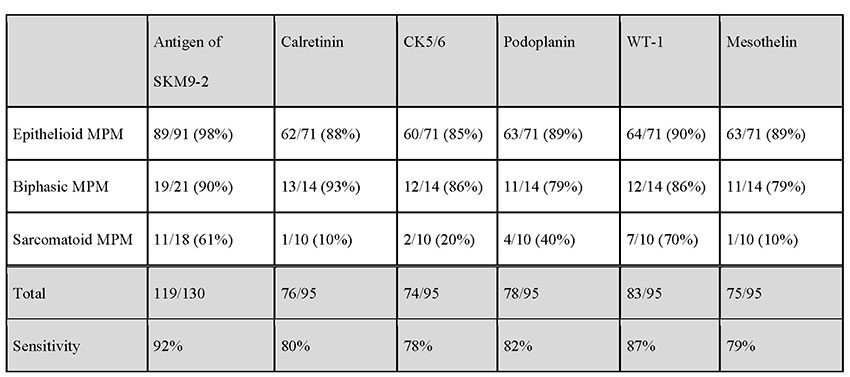
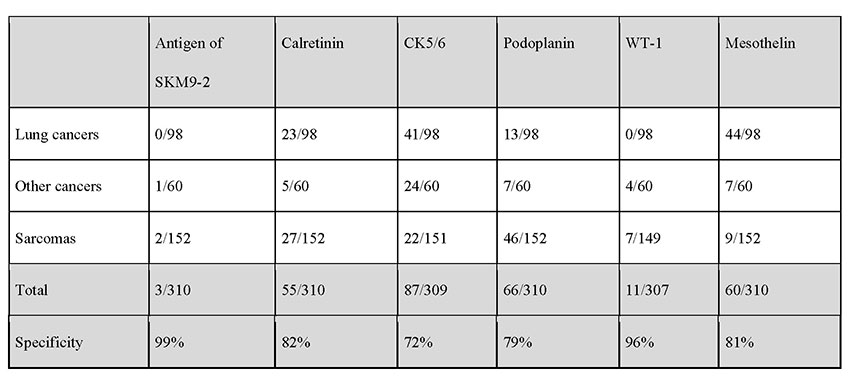
SKM9-2は患者の多くを占める上皮型中皮腫では陽性率は98%に達する。既存の中皮腫病理診断マーカーでは検出が難しい肉腫型中皮腫でも半数以上が陽性となり、既存の中皮腫マーカーと比べ一回り感度が高い(表 1)。さらに中皮腫に対する特異度が99%と極めて高く、他のがんにはほとんど結合しない(表 2)。加えて正常組織にもほとんど結合が見られない(図 1)8。既存の中皮腫マーカーの特異度は70〜80%程度であるため、SKM9-2は中皮腫の病理診断マーカーとして既存のマーカーよりも明らかに優れ、中皮腫の診断精度の向上に寄与すると期待されている9-11。ホルマリン固定パラフィン包埋切片を用いた免疫組織染色で使用可能であるため、病理診断で用いるための免疫組織化学染色試薬として株式会社ニチレイバイオサイエンスから販売されており、国外での販売(Bio SB, Inc.より)も開始されている。
 MPM, malignant pleural mesothelioma
MPM, malignant pleural mesothelioma
SKM9-2は細胞表面に発現する400 kDa以上の高分子抗原を認識しており、グリコシダーゼ処理の解析から、特定の膜タンパク質のシアル化O型糖鎖で修飾された領域を認識していると考えられた。酸を用いた分別沈殿とゲル濾過を中心としたクロマトグラフィーで精製を進め、SKM9-2の抗原同定に成功した。同定された分子・HEG1は分子の7割を占めるSer/Thr richドメインとEGFドメインからなるI型膜タンパク質で、多数の糖鎖がSer/Thr richドメインに結合しており、膜型ムチン様の分子構造をとっている8(図 2)。ほとんど報告がなく、有効な抗体も市販されていない未知の分子であった。
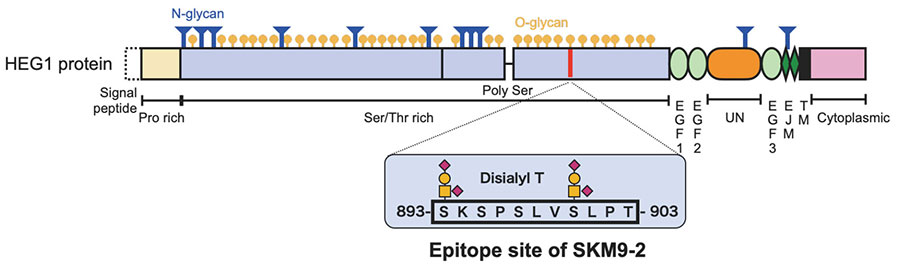
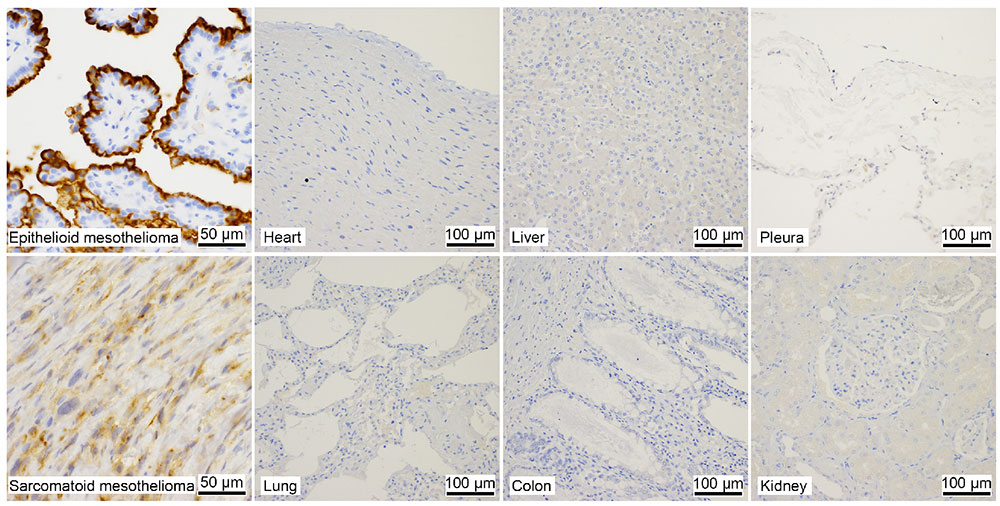
HEG1のmRNAは肺や心臓で検出されるが、免疫染色ではSKM9-2は中皮腫特異的に結合し、心臓や肺を含むほとんどの臓器に結合しない(図 1)8。またSKM9-2の結合はシアル酸依存的である。そのため、中皮腫のHEG1では他の組織のHEG1では見られないシアル化糖鎖の付加がおこっており、SKM9-2はこの糖鎖修飾された領域を認識するものと考えられた。そこでN末端から段階的にアミノ酸配列を削ったHEG1の欠損変異体を作製してSKM9-2のエピトープの解析を行い、最小ペプチド配列(893-SKSPSLVSLPT-903)を決定した。さらにこの配列に含まれる糖鎖構造を解析し、糖鎖を含むエピトープ構造を決定した12(図 2)。
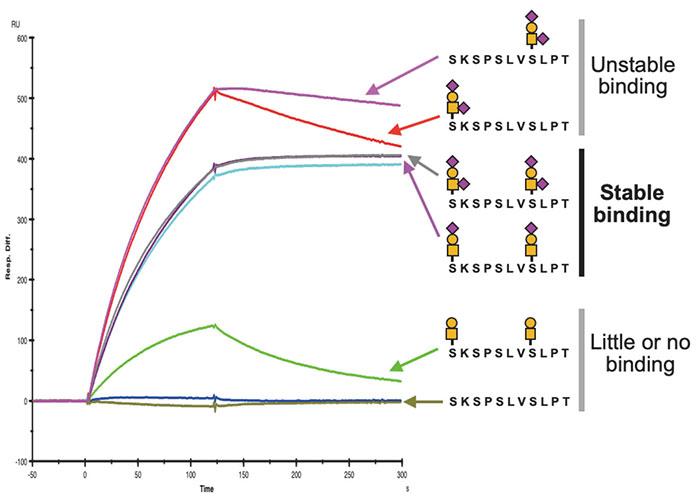
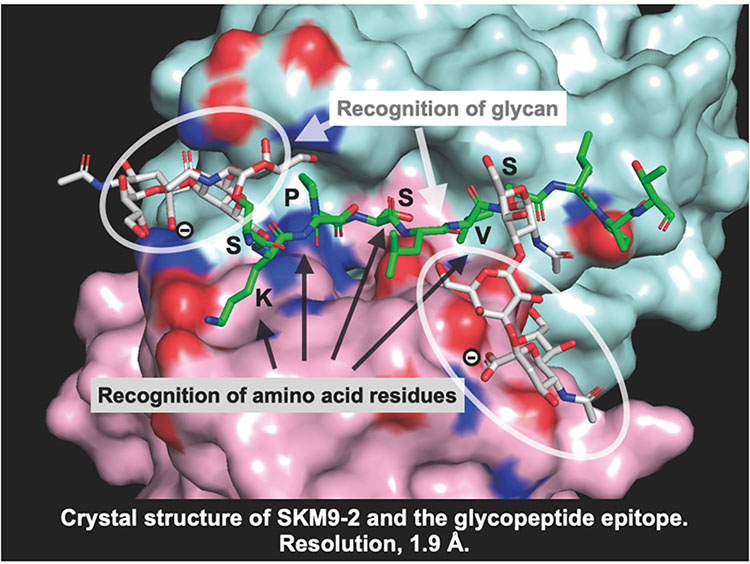
判明したエピトープ構造を元に糖ペプチドを合成し結合性についてSPR解析を行うと、抗体の安定な結合には893Serと900Serにsialyl Tまたはdisialyl Tの二本の糖鎖付加が必要であることが明らかとなった(図 3)。X線結晶構造解析を行うと、抗体のH鎖とL鎖の間に深い溝が形成されており、そこにペプチド部分がはまり込み、付加されたシアル化糖鎖をH鎖とL鎖が両側から包み込むような形でエピトープを認識することが明らかとなった(図 4)。これらの結果から、SKM9-2が二つの糖鎖とペプチドを同時に認識するユニークな抗体であることが明らかとなった。
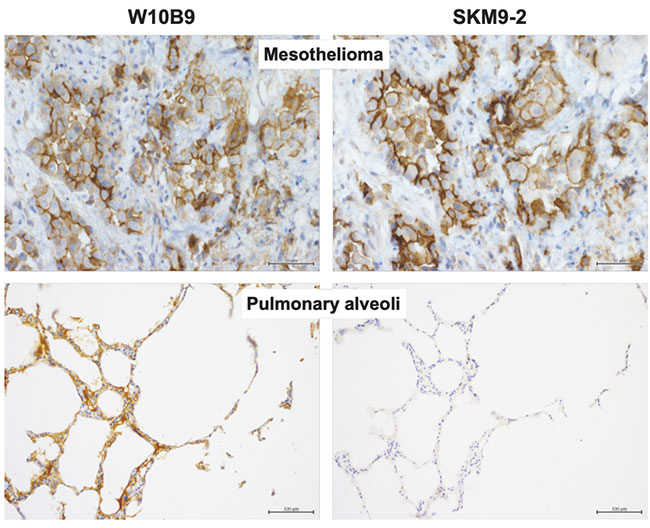
糖鎖認識の重要性が明らかとなったため、中皮腫以外の組織にはSKM9-2が反応できないHEG1(シアル化糖鎖がないHEG1)が存在するのかについて、糖鎖非依存的な抗HEG1抗体(W10B9)を作製し解析を行った。肺胞など一部の組織でW10B9陽性、SKM9-2陰性となる染色像が見られ(図 5)、肺胞などの組織では893Serと900Serにシアル化糖鎖がついていないHEG1が発現しているものと考えられた。従って、SKM9-2の高い中皮腫特異性は、中皮腫のHEG1に特徴的な糖鎖修飾を認識しているためであると考えられた。
SKM9-2は主要な臓器や健常組織にはほぼ結合せず、中皮腫に対して高い特異性を示す。そのためSKM9-2は中皮腫に対する治療用の抗体医薬シーズとして有望と考えられた。現在上市されている抗体医薬には、抗体の中和活性やADCC活性を利用した「古典的な」抗体医薬と、Antibody Drug Conjugate(ADC)13、Antibody Radionuclide Conjugate(ARC)14のような細胞傷害剤標識抗体や二重特異性抗体15といった「次世代の」抗体医薬、抗体とTCRの融合遺伝子をT細胞に組み込み細胞治療薬とするChimeric Antigen Receptor T(CAR-T)細胞療法などがある16。SKM9-2は古典的な抗体医薬としての薬理活性は認められなかったため、我々は現在、次世代抗体医薬として開発を進めている。
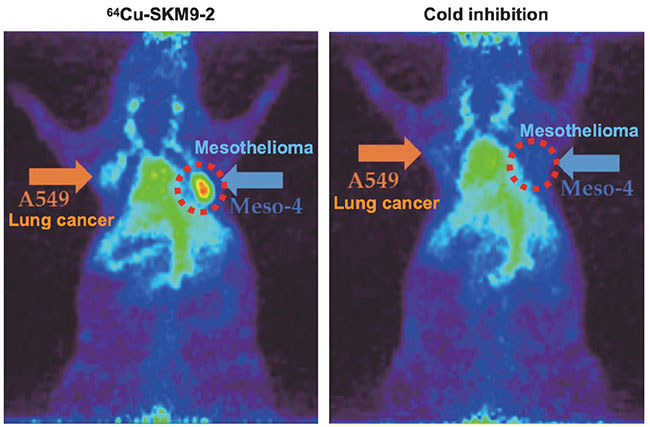
放射標識したSKM9-2を中皮腫の皮下移植モデルマウスに投与し抗体の特異的集積について解析を行ったところ、中皮腫腫瘍へのSKM9-2の特異的な集積が観察された(図 6)。細胞内に取り込まれると蛍光を発する色素で標識されたSKM9-2を用いた観察から細胞上のHEG1に結合したSKM9-2は細胞内に取り込まれることが確認され、ADCやARCへの応用が可能と考えられた。現在、ヒト化SKM9-2製造用のマスターセルバンクを構築し抗体原薬の製造を進めており、ARCとして非臨床試験を計画している。
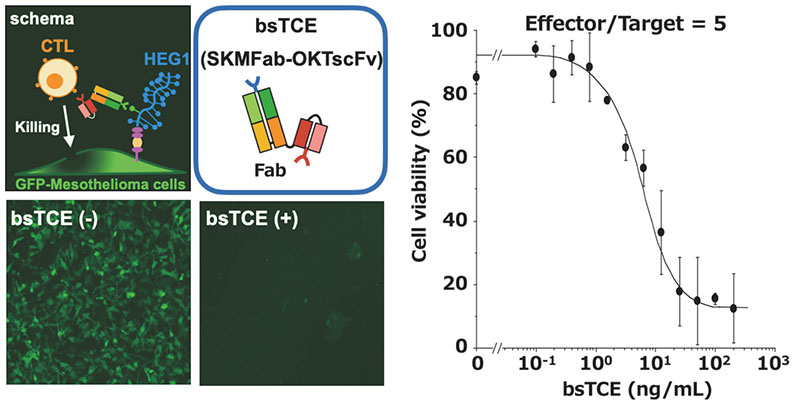
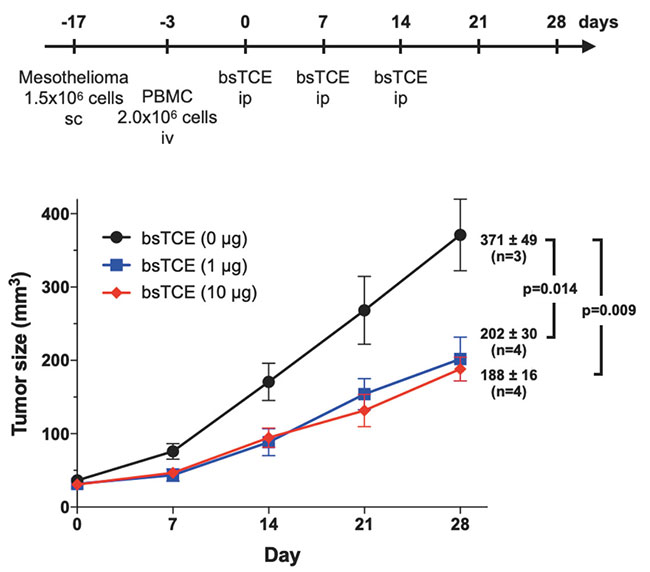
また、細胞性免疫を利用したT細胞誘引二重特異性抗体(T cell-engaging bispecific antibody (bsTCE))14の開発も進めている。bsTCEはすでに医療承認されている二つのscFvを連結したタンデムscFv型(BiTE)が代表的であるが、SKM9-2のscFvの安定性が悪くCHO細胞での生産性も悪かったため、SKM9-2のFabに抗CD3抗体のscFvを連結したFab-scFv型のbsTCEを開発し検討を行った。中皮腫細胞株を標的としてbsTCEとヒト末梢血単核球を加えると、bsTCE 100 ng/mLで全ての標的細胞が傷害される強力な殺細胞活性を有することが明らかとなった(図 7)。また、免疫不全マウスに中皮腫細胞株を皮下移植した後にbsTCEとヒト末梢血単核球を投与すると、腫瘍の増大に対して有意に抑制効果が見られた(図 8)。従って、SKM9-2を用いたbsTCEは極めて強力な殺中皮腫細胞活性を有し、中皮腫治療薬候補として極めて有望と期待される。
ARCやbsTCEのような次世代抗体医薬は強力な殺細胞活性を有しており、開発過程においてがん特異性(健常組織への非結合性)の確認が従来の抗体医薬よりも重要となっている。しかし、疾患特異的な糖鎖修飾が関係する抗原の場合、各組織での発現をmRNAベースの発現解析で確認できず、標的特異性と安全性を示すことが容易ではない。免疫組織染色による解析から、糖鎖修飾を受けたSKM9-2エピトープの発現は健常組織ではほとんど見られないと推定されるが、組織染色に用いる切片が臓器全体のごく一部であること、標的分子のHEG1自体のmRNAの発現は各種臓器で見られることから、導出の際に企業側の安全性に関する不安を払拭することが難しい。このような安全性と体内分布に関する問題点は、mRNAの発現量と糖鎖修飾された標的(エピトープ)の量が比例しない糖ペプチドを標的とする医薬品開発に共通の問題と考えられる。問題の解決のためには、放射標識抗体を用いて患者を対象にマイクロドーズ試験を行い、投与後の抗体の組織分布を調査する以外になく、このようなFirst-in-human試験を行うためには規制面、費用面、実施面で高いハードルが存在する。糖鎖に関連した抗原は標的疾患に対し高い特異性を期待でき次世代の疾患標的として有望である反面、導出にFirst-in-human試験が必要となる分、アカデミアからの医薬品開発では従来のタンパク質抗原よりも深い「死の谷」が存在するように思える。
本研究は、幸いにもAMEDの支援のもとRI医薬品企業と連携する機会が得られ、First-in-human試験実現への見込みが立ち非臨床試験の実施が具体化している。実用化に成功すれば、糖鎖に関連した抗体医薬開発のモデルケースの一つにもなりうるであろう。一刻も早く患者に薬を届けることを目標に、早期の医薬品化に向けて開発を進めている。
本稿の研究は、多くの共同研究者のご協力とAMED(Grant Number JP16cm0106406, JP18ae0101071)の支援のもとに行われております。この場を借りて深く感謝申し上げます。