
氏名:浦島 匡
国立大学法人帯広畜産大学、農学博士
1986年東北大学博士取得後、帯広畜産大学畜産学部酪農化学教室に赴任、ミルクオリゴ糖の研究に従事。1991年文部省在外研究員としてシドニー大学生化学部門にて、Dr. Michael Messerの下でタマーワラビー(有袋類)の乳腺における糖転移酵素の研究に従事。以後、Messerと共同で単孔類、有袋類、いくつかの種の有胎盤類のミルクオリゴ糖の化学構造の比較研究を行う。哺乳類への進化過程で、現在の乳成分がどのように獲得されたかに興味をもち、とくにミルクタンパク質αラクトアルブミンの獲得がミルクオリゴ糖とラクトースの発生と生理的意義の変化にどのように影響を及ぼしたかの探索を生涯の研究テーマにしている。2003年~2022年、帯広畜産大学教授。現在、名誉教授。日本酪農科学会会長、日本糖鎖科学コンソーシアム幹事。

氏名:平林 淳
東海国立大学機構名古屋大学 糖鎖生命コア研究所 特任教授
1982年東北大学修士取得後、帝京大学薬学部生物化学教室(笠井献一教授)に赴任、動物レクチンの研究に従事。1999年、GlycoXV(東京)にてグライコミクスを提起、2002年産業技術総合研究所(つくば)に異動、NEDO「糖鎖エンジニアリング」プロジェクト等に参画。2006年糖鎖医工学研究センター・副センター長、2012年幹細胞工学センター・首席研究員等を歴任。理学博士。現在、東海国立大学機構名古屋大学・糖鎖生命コア研究所にてプロジェクトマネージャー(Human Glycome)を担当。グライコームの着想(1998年12月)より四半世紀の年月を経て、ようやくその実現を迎えようとしている。日本糖質学会理事、日本糖鎖科学コンソーシアム副会長、香川大学および横浜市立大学客員教授。
ヒトの乳に12~13 g/Lの濃度で含まれるオリゴ糖(ヒトミルクオリゴ糖, HMOs)は、これまでに約250種類が分離され、160種類以上の化学構造が決定されている1,2,3。それらはフコースやシアル酸を含まないコア骨格構造に基づいて、20のシリーズに分類されるが、コア骨格の生合成系はiGnT, IGnT, β3GalT, β4GalTの活性に基づいて提案されている2,3。また、ウシの初乳からも約50種類のミルクオリゴ糖が分離・構造決定されているが4-7、それらのコア骨格の生合成経路も提案されている8,9。
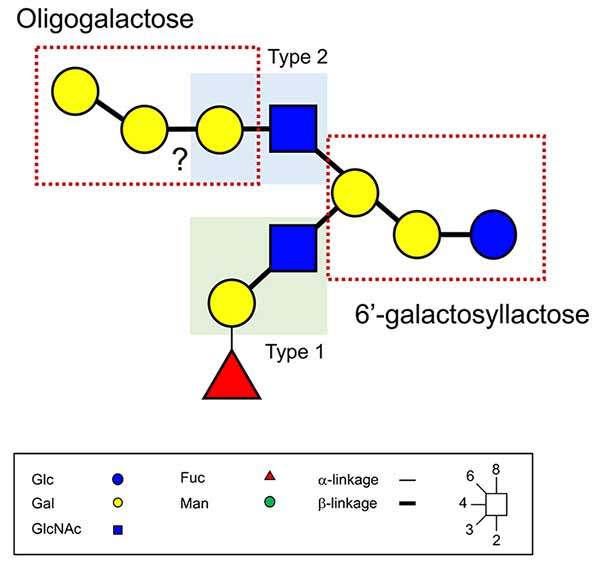
しかしながら、最近提案されたような、従来考えられてきた生合成経路では説明できない、新規な構造のミルクオリゴ糖が発見された。HanischとKunz(2021)は、図 1のように6’-ガラクトシルラクトースの非還元末端ガラクトースに1型ラクトサミン(Galβ1-3GlcNAc)と2型ラクトサミン(Galβ1-4GlcNAc)が付加し、末端にH抗原とポリガラクトースを含むHMOを分離精製し、構造決定した10。ごく最近、台湾中央研究所のC.K. Ni博士のグループによって、ヒト、ウシ、およびヤギのミルクから驚くような構造をもったミルクオリゴ糖が分離された11。それらはミルクからの糖質の抽出後、サイズ排除クロマトグラフィーとAmide-80カラムによる高速液体クロマトグラフィー(HPLC)、ならびに多孔性グラファイトカーボンカラム(PGC)を使用したHPLCによる分離の後、logically derived sequence (LODES)多次元タンデムマススペクトロメトリー(LODES/MSn)と呼ばれる新しい質量分析方法を使用して構造決定された。
質量分析方法による構造決定方法は、オリゴ糖に含まれる単糖の種類、結合位置、グリコシド結合のアノマー配向の決定が困難であることが難点であったが、Ni博士のグループは、標準オリゴ糖を使用して質量分析によるオリゴ糖のフラグメンテーションパターンから、それらを解析できる経験則を発見した12,13。それは、LODES/MSnによるナトリウム、またはリチウムアダクトとなったオリゴ糖のフラグメンテーションにおいて、(1) 分子の脱水反応はオリゴ糖の還元末端で主に生ずる、(2) 環開裂は主に還元末端で、レトロアルドール開裂によって起こる。環開裂からのフラグメンテーションパターンは還元末端での糖の結合位置の決定に利用できる、というものであり14-16、分析にあたってはオリゴ糖の還元末端を18Oラベルした。この方法によって構造推定されたオリゴ糖の標準化合物を化学合成によって調製し、HPLCの保持時間と質量分析でのフラグメンテーションパターンを比較した。PGCによるHPLCではあえてオリゴ糖を還元せず、還元末端のαならびにβアノマーによる2本のピークの保持時間と質量分析パターンを、試料から分離したオリゴ糖と合成標準物質において比較した。構造決定されたオリゴ糖(三糖と四糖)を、下記に述べるような予想生合成経路に基づいて分類した図 2に示す。いずれの構造も驚くようなものだが、緻密な分析に基づいたものであり、信用すべきものと判断される。今回見つかった新規構造は、いずれもフコースやシアル酸を含まず、グルコース、ガラクトース、N-アセチルグルコサミン、N-アセチルガラクトサミンの新たな組み合わせや結合によるものである。

分類したカテゴリーのうち第一は、Manα1-6Manβ1-4GlcNAcβ1-4GlcNAcの様に、N-グリカンのエンドグリコシダーゼによる分解物と思われるものである。あるいは、N-グリカン生合成の際のドリコールリン酸結合中間体の分解物かもしれない。第二のカテゴリーは、還元末端Glcに対する分岐型三糖であるGalβ1-4(Galβ1-2)Glc, Galβ1-4(Glcα1-2)Glc, Galβ1-4(GalNAcβ1-2)Glcからなる。これらは未発見の分岐型グリコシルトランスフェラーゼによる反応生成物と予想される。ただし、構造既知のGalβ1-6Galβ1-4GlcとGalβ1-3Galβ1-4GlcとともにGalβ1-4(Galβ1-2)Glcの生成は、乳腺細胞内でのβ-ガラクトシダーゼによるラクトースへの糖転移反応の結果であることも考えられる注1)。実際、市販のガラクトオリゴ糖は、ラクトースからβ-ガラクトシダーゼを利用した反応によって調製される17,18。一方、Galβ1-4(Glcα1-2)Glc, Galβ1-4(GalNAcβ1-2)Glcも、グリコシルトランスフェラーゼによる反応生成物ではなくて、α-グルコシダーゼやβ-N-アセチルガラクトサミニダーゼによる、ラクトースに対するグルコースやN-アセチルガラクトサミンの転移反応生成物とも考えられる注2)。
注1)ラクトースを基質としたβ-ガラクトシダーゼによる反応は、加水分解反応ばかりではなくて、基質の濃度を高めることによってガラクトース転移反応を起こすことも可能である(加水分解の逆反応ではないことに留意)。それはGalβ1-4Glc + Galβ1-4Glc → Galβ1-6Galβ1-4Glc + Glcのような反応式で表示することができる。このような原理によって工業的に調製されたガラクトオリゴ糖混合物を構造解析すると、実際、Galβ1-6Gal, Galβ1-3Gal, Galβ1-3Glc, Galβ1-2Glc, Galβ1-6Glc, Galβ1-4(Galβ1-6)Glc, Galβ1-6Galβ1-6Glc, Galβ1-6Galβ1-4Glc (6’-GL), Galβ1-4Galβ1-4Glc (4’-GL), Galβ1-3Galβ1-4Glc (3’-GL), Galβ1-6Galβ1-6Galβ1-4Glc, Galβ1-3Galβ1-3Galβ1-4Glc, Galβ1-6Galβ1-6Galβ1-6Galβ1-4Glcなどが含まれていた18。二糖は一度生成した三糖の加水分解生成物と考えられるが、二糖Galβ1-2Glcは、Galβ1-4(Galβ1-2)Glcの加水分解生成物かもしれない。なお、この反応に使用するβ-ガラクトシダーゼの種類の違いによって、生成物も異なるであろう。
注2)グリコシルトランスフェラーゼによる糖転移反応は、厳密にアクセプターへの転移位置が制御されるのに対し、グリコシダーゼによる糖転移反応では転移位置への制限は緩い。時には、驚くような位置への転移反応がおこる場合がある。例えばラクトースとフコースを基質として、カビAspergillus niger由来のα-フコシダーゼを使用した反応では、Galβ1-4Glcβ1-1αFucという非還元糖の生成が見出された19。Galβ1-4(Glcα1-2)Glc, Galβ1-4(GalNAcβ1-2)Glcも通常の分岐型グリコシルトランスフェラーゼ生成物としては予想されにくいため、あるいはグリコシダーゼによる反応生成物の可能性の方が高いのかもしれない。
第三のカテゴリーはGalNAcβ1-4GlcNAcβ1-6Galβ1-4Glcについてである。論文の著者Wengらは11、ヒト、またウシ乳試料にGlcNAcβ1-6Galβ1-4Glcが発見されていないことから、ラクトースに対するGalNAcβ1-4GlcNAc(LacdiNAc)という二糖単位の転移生成が起こった可能性を示唆している。そうであれば、二糖単位を転移する新規グリコシルトランスフェラーゼとともに、ドナーGalNAcβ1-4GlcNAc-UDPの存在が必要となる注3)。
注3)後述するようにUDP二糖、または三糖はまれにいくつかの哺乳動物の乳、また初乳に検出されるものの、いつも安定して見出されるわけではない。よって、安定した生合成系の想定は難しいかもしれないが、一つの可能性として「誤認」による生合成が考えられる。たとえばGalNAcβ1-4GlcNAc-UDPの生合成において(このような化合物が存在するのであれば)、GlcNAc-UDP合成酵素が、本来の基質であるGlcNAcの代わりに、間違ってGalNAcβ1-4GlcNAcにUDPを結合させることである。
すなわち、以下を想定する。
1) 本来の反応:GlcNAc-P + UTP => GlcNAc-UDP + PP
2) 誤認による反応:GalNAcβ1-4GlcNAc-P + UTP => GalNAcβ1-4GlcNAc-UDP + PP
つまり、酵素が本来の基質であるGlcNAc-Pの代わりにGalNAcβ1-4GlcNAc-Pを誤って選択することによって、2)の反応が起こってしまう。
一方、GalNAcβ1-4GlcNAc-UDPの生合成に対して、別の可能性も考えられる。つまりLacdiNAcを合成するβ4GalNAc転移酵素が、本来のアクセプター基質であるGlcNAc-Rの代わりに、GlcNAc-UDPをアクセプター基質とすることである。
3) 本来の反応: GalNAc-UDP (D) + GlcNAc-R (A) + => GalNAcβ1-4GlcNAc-R
4) 誤認による反応: GalNAc-UDP (D) + GlcNAc-UDP (A) + => GalNAcβ1-4GlcNAc-UDP
この場合、本来3)の反応が行われるべきところ、誤認によって4)が生じてしまう。
酵素の本来のアクセプター(あるいはドナーも)が、ある種の条件のもとで変更されることを筆者らは酵素の「よろめき(wobbling)」と呼んでいる。本シリーズ番外編(Glycoforum. 2021 Vol.24(3), A6)において、そのような例としてβ4Gal-T1がミルクタンパク質α-ラクトアルブミンと会合することで、その基質特異性がGlcNAcからGlcに変更することを紹介した20。このケースではα-ラクトアルブミンの存在が「よろめき」の鍵となっているが、上のように、GlcNAc-UDPを合成する酵素に「よろめき」が起こるとしたら、GlcNAc-UDP合成酵素といったいどのタンパク質がどのように会合するのだろう?現時点では全くの机上の空論である。
ヒト21、ブタ22、トナカイ23などの乳/初乳にGalβ1-4GlcNAc-UDPは発見されているが、GalNAcβ1-4GlcNAc-UDPは報告例がない。かつて、木幡 陽博士はヒト乳にGalβ1-4GlcNAc-UDP21やFucα1-2Galβ1-4GlcNAc-UDP24を見つけている。このため、博士はオリゴ糖単位で転移反応を行うグリコシルトランスフェラーゼ活性をヒト乳に探したが、試みは成功しなかった20。グライコフォーラム「ガレクチン」シリーズ、ガレクチンとミルクオリゴ糖(番外編)の中でも紹介したように、UDPオリゴ糖はヒト21, 24、ヤギ25、ヒツジ26などの乳/初乳での報告例はあるものの、再現よく検出できるわけではない1, 27。この論文の筆者(Wengら)は、新規オリゴ糖ではないが、ウシ乳に見出されたGalβ1-4GlcNAcβ1-3Galβ1-4Glc(LNnT)とGalβ1-4GlcNAcβ1-6Galβ1-4Glc(イソLNnT)に関しても、前駆三糖としてGlcNAcβ1-3Galβ1-4GlcとGlcNAcβ1-6Galβ1-4Glcが検出できなかったことから、ラクトースからの二糖ブロック転移でこれらの四糖が生合成される可能性を示唆している。そのような酵素の探索は、これまでに厚い壁に跳ね返されてはいるが、もし発見されれば画期的なことである。この場合、GlcNAc転移酵素(I/i)が本来のドナー基質であるGlcNAc-UDPばかりでなく、Galβ1-4GlcNAc-UDPも転移可能かという問いかけにもなる。ウシ乳にGalβ1-4GlcNAc-UDPは発見されていないが、ヒト21、ブタ22、トナカイ23の乳/初乳には見出されているので、このドナー基質の存在は想定範囲といえる注4)。
注4)糖鎖生合成系において二糖、または三糖単位でのブロック転移があるとすれば、二または三糖に特異性をもった新規のオリゴ糖転移酵素が存在するか、あるいは本来単糖を転移する酵素に「よろめき(誤認)」が生じて二または三糖を転移するという二つの可能性が考えられる。上述のように、歴史的にはオリゴ糖転移酵素の探索は試みされたものの成功していない。後者の場合であれば、たとえばGlcNAc転移酵素の本来のドナー、GlcNAc-UDPの代わりにGalβ1-4GlcNAc-UDPをドナーとしてしまうことが考えられる。
すなわち、以下を想定する。
5) 本来の反応:GlcNAc-UDP + Gal-R → GlcNAcβ1-3Gal-R
6) 誤認による反応:Galβ1-4GlcNAc-UDP + Gal-R → Galβ1-4GlcNAcβ1-3Gal-R
この場合、本来5)の反応が起こるべきところ、誤認によって6)が生じる。このような酵素の「よろめき」があるとすれば、GlcNAc転移酵素と何かのタンパク質の会合が引き金になるのであろうか?あるいは、αラクトアルブミンのような介在分子がなくとも、酵素の特異性が甘いことや、pHや基質濃度などの環境の違いが、誤反応(よろめき)を助長することがあるかもしれない。αラクトアルブミン-β4Gal-T1の場合は、明確な分子論的基盤がある。科学的に検証されているが、分子基盤の確立されている反応を「よろめき」反応、そうでないものを誤反応というような言葉の使い分けも必要かもしれない。
また、遊離形、ないし糖タンパク質の非還元末端単位としてのGalNAcβ1-4GlcNAc(LacdiNAc)はウシ初乳/乳に見出されているが4, 28、ヒト乳では見つかっていない29。LacdiNAc単位を非還元末端側にもつ四糖がヒト乳に発見されたことは、HMO生合成の観点から非常に興味深い。
第三のカテゴリーの説明が長くなったが、第四のカテゴリーとして、ウシ乳に発見されたGalβ1-3GalNAcα1-3Galβ1-4Glcは、GalNAcα1-3Galβ1-4Glcへのガラクトース転移によって生合成されたことが予想される。GalNAcα1-3Galβ1-4Glcはウシ初乳以外にもヤギ乳やヒツジ乳にも発見されている4,5,30。ちなみに、Galβ1-3GalNAcα1-3Galβ1-4Glcの非還元末端二糖単位(Galβ1-3GalNAc)は、κ-カゼインなどムチン型糖鎖コア1構造(T抗原とも)と同一の構造である31。よって、上記四糖は、ムチンコアユニットを生合成するガラクトシルトランスフェラーゼと同一の酵素によって、GalNAcα1-3Galβ1-4Glcから作られる可能性も考えられる。
さて、この論文の筆者も指摘しているように、もっとも奇妙なのはGalβ1-4Glcβ1-4Glcの存在である(第五のカテゴリー)。HMOを含む大半のミルクオリゴ糖はラクトース(Galβ1-4Glc)を起点として合成されるという原則に成り立つ。(ウシ、ヤギなどのミルクオリゴ糖には少量ながら、還元末端側にGalβ1-4GlcNAcを含むものも発見されている)しかし、今回見つかった本構造の還元末端二糖はラクトースでなくセロビオース(Glcβ1-4Glc)である。セロビオースに対して、β4ガラクトシルトランスフェラーゼ1とα-ラクトアルブミンの共同作用によってガラクトース転移反応が起こることは考えられるが、そもそも乳腺細胞含めた哺乳動物の体組織においてセロビオースの合成が起こることは予想しにくい。食事(食餌)に含まれるセロビオースが、ごく少量腸管吸収され、それが体内循環してから乳腺細胞に取り込まれるのであろうか?それとも、Glcに対して二糖単位でGalβ1-4Glc-UDPからGalβ1-4Glcを転移する酵素があるのであろうか?新たな謎が生まれた。
ヒト乳においてガラクトシルラクトース(3’-GLと6’-GL)の濃度は、2’-FL(Fucα1-2Galβ1-4Glc)やLNT (Galβ1-3GlcNAcβ1-3Galβ1-4Glc)などの主要オリゴ糖の濃度と比べて2桁も低いことが知られている32。しかし、今回ヒト乳に発見された新規三糖(第二のカテゴリー)は、6’-GLや3’-GLよりもさらに濃度が低い。一方、ウシ乳やヤギ乳に発見された新規三糖の濃度は、これまでに報告されている3’-GL, 6’-GL, Galα1-3Galβ1-4Glc(イソグロボトリオース)と比べて低いものの、著しい濃度差はなさそうである。
このような新規三糖、四糖のミルクオリゴ糖の発見は、生物学的にどのような意味を持つのだろうか。その答えはともかく、新たな分析手法の登場がミルクオリゴ糖の化学に新たな境地をもたらすことは間違いない。これらの結果の再現性の確認が急務であるとともに、今回見出された新規構造を含めたミルクオリゴ糖の機能に関する議論が活発化することが期待される。