
氏名:若森 晋之介
東京農業大学生命科学部・助教 博士(農学)
2009年3月早稲田大学理工学部化学科卒業(指導教員:鹿又宣弘 教授),2011年3月東京大学大学院農学生命科学研究科修士課程修了,2014年3月同博士後期課程修了(指導教員:渡邉秀典 教授)。2012年4月より日本学術振興会・特別研究員DC2,2014年4月より信越化学工業株式会社合成技術研究所・研究員,2016年6月より関西学院大学大学院理工学研究科・博士研究員,2018年4月より関西学院大学理工学部・助教(研究室主催者:故 山田英俊 教授,村上慧 准教授)を経て,2021年4月より現職。有機化学的アプローチによって天然有機化合物の合成や機能の解明を目指している。
シクロデキストリン(CD)は、α-1,4-D-グルコピラノシドの環状オリゴマーで、分子の中央にある空孔が小分子を包摂する機能を有し、環状6〜8量体(CD6—8)が広く応用されている。大きなCDではCD数百まで知られている一方で、小さなCDではCD5の化学合成が報告されているのみであった。さらに小さなCD4とCD3は分子サイズがあまりに小さく、ピラノース環が安定なイス型配座を取ることができないため、これまで合成されたことがなかった。本稿では、CD4とCD3両方の化学合成について記述する。合成に成功した主要因は、D-グルコースの3位と6位酸素を架橋する官能基の開発である。すなわち本架橋基によって、CD4とCD3の合成に必要な立体選択的グリコシル化反応とピラノース環の立体配座の柔軟化が実現した。
シクロデキストリン(CD)はD-グルコースがα-1,4結合した環状オリゴ糖である1。中でも、酵素を用いる大量生産によって入手が容易かつ安価な環状6〜8量体(CD6〜CD8)が主に知られている(図 1上)2。これらはD-グルコースだけで構成されるため毒性が無く3–5、分子中心部の疎水性空孔に小さな分子を包摂できるため、工業製品や医薬品をはじめ、一般家庭で使われる製品にも広く利用されている。
CDを構成するD-グルコースの数によって包摂できる化合物が変化するため、CDのサイズに関する多くの研究がなされている。CD8より大きなものではCD35まで構造が確定している6一方で、CD6より小さな場合、化学合成されたCD5が実在するCDとして最小であった7。さらに小さなCD4とCD3に関しては、それらの存在が確認されないまま議論だけが先行していた。1957年にFrenchは、CD3から無限大のグルコースの数をもつCDの空間充填模型を組み立てることができるが、グリコーゲンを、真正細菌の一種であるBacillus maceransで処理して得られるCDの最小は、CD6であろうと報告している8。1970年にはSundararajanらがCD6未満は環状化できないと化学計算を根拠に述べているが9、1994年に中川らがCD5の化学合成を実現した7。その翌年Immelらは、構成するD-グルコースのピラノース環が最も安定なイス型(4C1配座)をとれないため、CD4とCD3の合成が極めて難しいと推定している(図 1下)10。これまでに、結合様式が異なり構成するD-グルコースのピラノース部位がイス型の類似化合物の合成はいくつか報告されているが11–14、α-1,4結合のみで構成され、ひずみの大きなCD4とCD3の合成は残された課題であった。
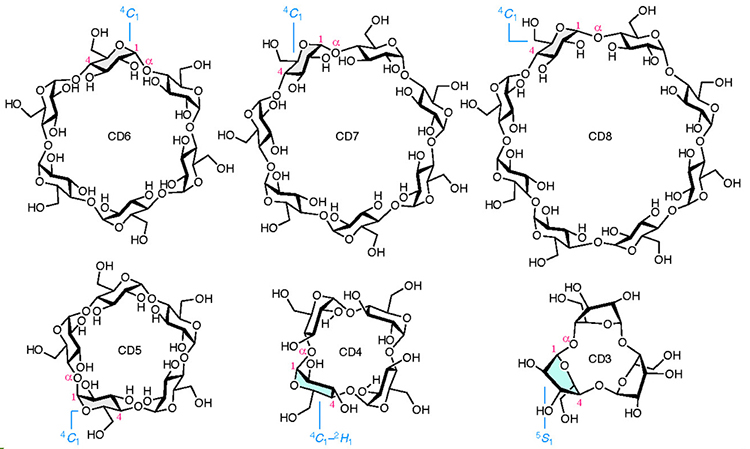
私たちはCD4とCD3の化学合成を達成し、それらの存在を証明した15。この研究成果における鍵は、D-グルコース誘導体の3位酸素と6位酸素に導入した架橋基であり、その詳細を中心に述べる。なお本稿では、立体配座が未決定のピラノース環は平面構造式で、後述する手法で立体配座を決定したものを立体構造式で記載する。
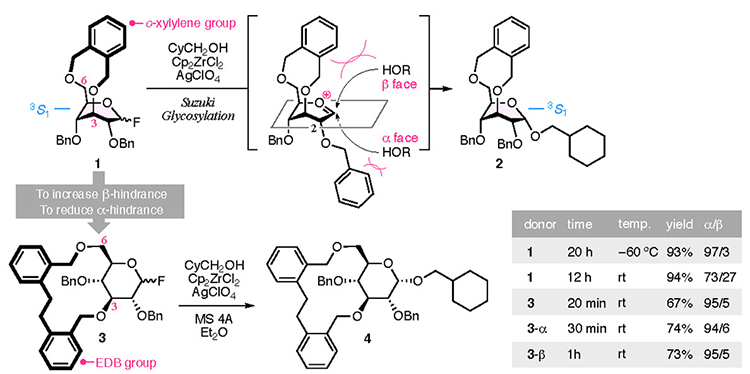
架橋基の存在により、CD合成に必要な高α-選択的グリコシル化反応が実現した(図 2)。これまで私たちは、キシリレン架橋基を報告している16,17。ジルコノセンジクロリドと過塩素酸銀を用いる鈴木グリコシル化反応18の条件下において、キシリレン架橋した1とシクロヘキサンメタノールは速度論支配の反応を起こし、高いα-選択性が発現する。しかし、この架橋基はピラノース部分を3S1型に固定し、2位酸素のベンジル基をα面にアキシアル配向させ、逆効果となる立体障害を生み出す。そのため、反応温度を高めた場合では、グルコシド2のα-選択性が低下する。この問題を、β面での立体障害を大きくし、α面における2位酸素のベンジル基の張り出しを減少させて解決を図った。すなわちキシリレン基より自由度の高い架橋基の導入を発想し、EDB基を考案した。EDB架橋基を有するフッ化グルコシル3は、反応温度が室温でも、わずか20分の反応時間で対応するグルコシド4をα-選択的に与えた。本反応は、アノマー異性体である3-αあるいは3-βどちらを用いても同様のα-選択性で進行したため、オキソカルベニウムイオン中間体を経て進行すると考えている。
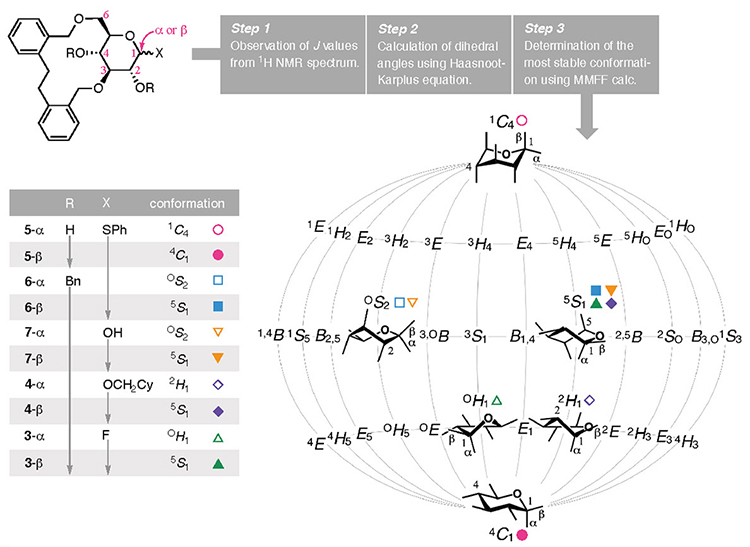
開発した架橋基のもう一つの特徴は、ピラノース部位がさまざまな形をとることである。D-グルコースのピラノース環上に架橋基を導入すると二環性分子となり、新しくできた環がピラノース環の立体配座に影響する。その結果、D-グルコースのピラノース環の立体配座が、最安定なイス型の4C1配座から変化する。短い架橋基の場合、1や219、あるいはその他の文献に見られる化合物のように20–24、アキシアル位に配向した置換基がより多い形に立体配座を「固定」する。本研究では架橋基としてEDB基を採用したことで、ピラノース環の立体配座が、その周辺のわずかな変化によって大きく変わることを、3〜7の1H NMRスペクトルの結合定数から明らかにした(図 3)。立体配座の決定には、以下の手法を開発した。まず1H NMRスペクトルから得られる結合定数を読み取り(Step 1)、Haasnootの改良Karplus式25を用いて二面角を算出した(Step 2)。この式では、1つの結合定数から最大4つの解が得られるので、取りうる二面角の組み合わせのうち、最も安定な立体配座を分子力場計算から決定した(Step 3)。得られた立体配座を解析すると、2位・4位酸素に保護基Rがなく(R = H)、置換基Xがフェニルチオ基の場合(X = SPh)、1位の立体化学がαの5-αは1C4配座で存在したが、そのアノマー異性体である5-βでは同じイス型でも4C1であった。二つのヒドロキシ基をベンジル基で保護した6-αと6-βでは(R = Bn)、ねじれフナ型であるOS2配座および5S1配座と導き出された。このように算出された3〜7を1C4配座と4C1配座を両極とする立体配座地図(Cremer-Pople-Stoddart座標)26,27にそれぞれ当てはめると、図 3に示すように広い範囲で分布した。この現象は、EDB基による緩やかな制約が、安定なイス型配座をとるピラノース環本来の性質と競合した結果と私たちは考察している。つまり、EDB架橋基によりピラノース環が「しなやか」になり、フッ化グルコシル3を用いたα-選択的グリコシル化反応と合わさることで、CD4とCD3の合成が可能になった。
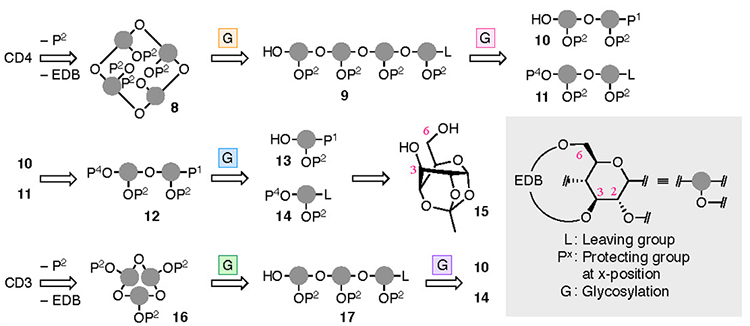
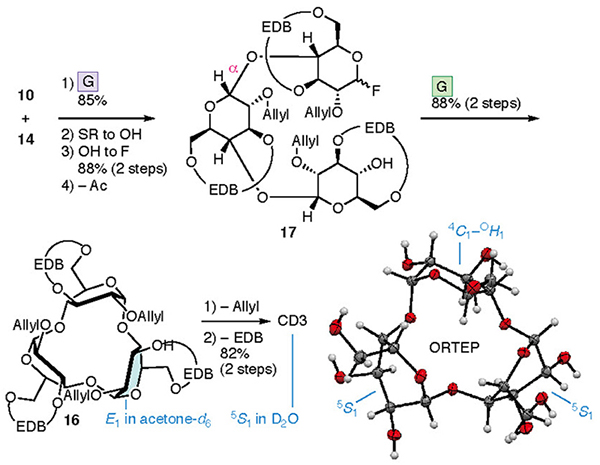
CD4およびCD3の合成概略を以下に述べる(図 4)。D-グルコースのα-1,4結合の繰り返しから成り立つCD4およびCD3の化学合成ではα-1,4結合以外の酸素原子を保護した。既に3位および6位酸素をEDB基で保護しているので、更に2位酸素を保護(P2)して合成を進めた。CD4は、前駆体8のすべての保護基を除去して得た。環状四量体8は直鎖四量体9の分子内グリコシル化反応によって合成し、直鎖四量体9は、10と11のグリコシル化・保護基の付け替え・脱離基(L)の付与を経て調製した。二糖10と11は単糖13と14から誘導し、これらに存在するEDB架橋基の導入を容易にするため、3位および6位酸素が同じ方向になるよう立体が固定された1,2,4-オルトアセチルグルコース(15)28を本合成の出発物質とした。CD3の合成においては、環状三量体16を直鎖三量体17から分子内グリコシル化反応によって合成し、直鎖三量体17は二糖10と単糖14から導いた。脱離基(L)をフッ素とすることで、CD合成に必要なグリコシル化反応のα-選択性29,30を発現させ、EDB架橋がもたらしたピラノース環の「しなやかさ」によって、4C1配座のままでは不可能な環状化が進行し環状四量体8と環状三量体16を構築できたと考えている。
二糖12の合成を図 5に示す。出発化合物15と2,2′-ビス-(ブロモエチル)-ジベンジル31とのエーテル化反応によって、EDB架橋した18を得た。この反応では、15の濃度を10 mM以下に保つことで18の収率の再現性を確保した。得られた18へのオルトエステルの開裂を伴うアリールチオ基の導入は、臭化インジウムを用いることで完全なβ-選択性を伴って進行した。続いて、残存した2位酸素のアセチル基を除去して19あるいは5-βとして、それぞれ13と14に変換した。変換した両者を用いてグリコシル化反応することで、二糖12を完全なα-選択性で与えた。フッ化グルコシル14を用いた本グルコシル化反応は、前述した3を用いた場合と比較して高い選択性で進行した。保護基(P2)がベンジル基からアリル基へ変更されα面に張り出す立体障害が減少したため、選択性が向上したと考えられる。二糖12のアノマー位の立体化学は、ピラノース環が4C1配座の20に変換して図中に示した1H NMRスペクトルの結合定数から確認した。

CD4は、直鎖四量体を環化させることで合成した(図 6)。二糖12由来の10と11から直鎖四量体21を得た。新しく生じたグリコシド結合の立体化学は、複雑なNMRシグナルのため未決定である。続いて、アノマー位をフッ素化し4位のアセチル保護を除去して9へと導いたのちに、分子内グリコシル化反応によって環状四量体8を得た。環状四量体8の1Hおよび13C NMRスペクトルは単糖のパターンであったため、4個あるアノマー位の立体が同一であることを示した。さらに8は1'位がαであることを確認した12から生じているため(図 5)、アノマー位の立体は全てαであると決定した。ただし分子内グリコシル化反応の再現性と収率は低く、17回の実験のうち成功は6回で、最高収率は25%であった。環状四量体8からアリル基を除去し32、加水素分解では問題なくEDB基を除去でき、CD4の合成を達成した。なお環状四量体8とCD4の1H NMRスペクトルは、ピラノース環の立体配座が2H1配座および4C1配座と2H1配座の間にあることをそれぞれ示した。これらのピラノース環の形は、より大きなCDのピラノース環より平坦化していた33–35。
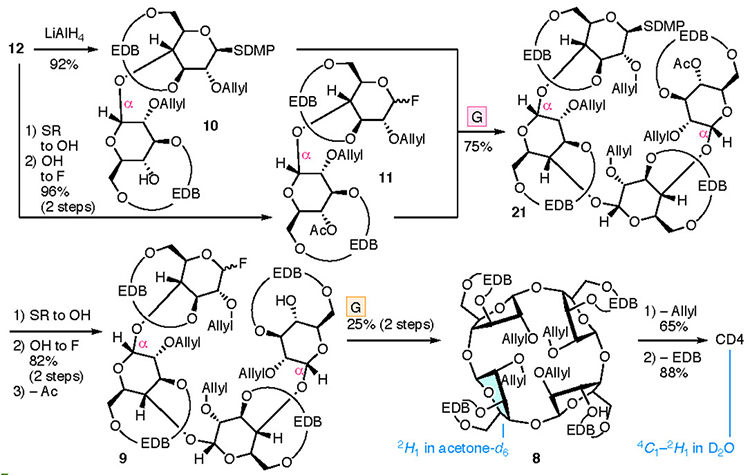
CD4と同様の工程を経て、CD3の合成も達成した(図 7)。二糖10と単糖14から直鎖三量体17を経て、環化させることで環状三量体16を得た。分子内グリコシル化反応は環状四量体8の合成時より効果的に進行し、収率は88%に達した。アリル基とEDB基をそれぞれ除去して、CD3へ導いた。CD3の構造は、1Hおよび13C NMR、単結晶X線構造解析によって確認された。環状三量体16とCD3のNMRスペクトルは等価な単糖パターンを示し、ピラノース環の平均化された立体配座はE1配座および5S1配座であった。CD3の1H NMRにおいては、5位酸素による反遮蔽効果と考えられる5位水素の特異な低磁場シフトが観測された。また単結晶X線構造解析は、結晶格子中ではCD3の三個あるピラノース環の立体配座は異なることを示した(5S1配座が2個、4C1配座とOH1配座の間が1個)。
立体配座に柔軟性をもたせたグルコース単量体によって、歪んだCDであるCD4とCD3の合成が可能になった。架橋基による緩やかな配座制御を受けた「しなやかな」糖は、他の歪んだ化合物の化学合成や、機能発現に柔軟な構造を要する場合などへ応用できると考えられる。また、CD4とCD3のNMRで観測された平均化されたC3およびC4対称性は、分子触媒や金属有機構造体の構築に利用できる可能性を示している。さらに、中心部の空孔に他の分子を包摂するCDの特徴から類推すると、CD4には、現在入手可能なCDに適した分子より小さな分子を包摂することが期待できる。現在、さらなる物性の解析や機能の開拓を進めるため、CD4とCD3をグラムスケールで供給できる手法を検討している。
本研究は,関西学院大学理工学部 山田英俊研究室で,駅伝競走のようにたすきを受け継いで行われてきました。本研究に情熱をもって取り組んでくれた,平田さん・生田さん・川崎さん・嶋田さん・萩森さん・松本さんに深く感謝いたします。また,本研究を支えていただいた苫米地祐輔 博士(現:東海大学工学部)ならびに池内和忠 博士(現:北海道大学大学院理学研究院)に厚く御礼申し上げます。
本来ならば本稿をご執筆されていたはずの山田英俊 先生は,2019年11月23日に急逝されました。現役真っただ中での突然の不幸に,ただただ残念と申し上げるしかありません。先生の化学に対する淀みのない敬意・研究に対する真摯な姿勢・何事にも発揮される情熱を,ご指導いただいた私たちが継承してゆきたいと考えております。心より先生のご冥福をお祈り申し上げます。