
氏名:⼭崎 達也
愛知医科⼤学医学部 感染・免疫学講座 助教
2006年 東京理科大学基礎工学部生物工学科卒業、2011年 東京理科大学大学院基礎工学研究科生物工学専攻 博士課程修了、博士(工学)。2011年 公益財団法人 東京都医学総合研究所 ゲノム医科学研究分野 ウイルス感染プロジェクト 流動研究員、2013年 東京大学医科学研究所 感染症国際研究センター感染制御系ウイルス学分野 特任研究員を経て、2016年より現職。インフルエンザウイルスに対する抗体遺伝子を用いた受動免疫法の開発、ウイルス特異的IgA抗体誘導メカニズムの解析、膜タンパク抗原に対する抗体作製方法の開発、IgE抗体の機能解析などを行っている。

氏名:髙村(赤司)祥子
愛知医科大学医学部 感染・免疫学講座 教授、講座長
1992年佐賀医科大学医学部卒業、同大学内科研修医、麻生飯塚病院及び佐賀医科大学医員(呼吸器内科)を経て2000年 佐賀医科大学大学院博士課程修了(医学、免疫血清学教室)。同年 同大学免疫血清学教室助手、2001年より東京大学医科学研究所・感染遺伝学教室助手のち助教、2014年より現職。血清タンパクMD-1や補体制御因子C4BPの免疫機能解析、およびハチ毒PLA2の皮膚における免疫賦活作用の解明などに取り組んでいる。
抗体の機能において糖鎖は重要な役割を果たしている。たとえばIgG抗体に付加した、ある1つの糖鎖を除去することで、細胞傷害活性が劇的に上がることが知られている。本稿で話題の中心となるIgE抗体に付加された糖鎖についても、それを酵素で除去することで、IgEの受容体(FcεRI)への結合能が著しく低下すると報告されている。しかし、特異的にIgEの糖鎖を切断し、その機能に影響を与える酵素はまだ見つかっていない。我々は偶然にも、コレラ菌由来の成分がIgE(マウス)を特異的に不活化することを見出した。現在、ヒトIgEでも同様の効果が得られるか研究を進めている。これらの研究成果によって、IgEの糖鎖を標的とした新しいアレルギー治療法の開発に貢献したいと考えている。
IgEはI型アレルギーの主要因の1つとして知られている。約50年前に石坂らによって発見された1,2。IgEは、ほかの抗体(アイソタイプ)に比べて、血中濃度は微量であり、半減期も短い3,4。しかしIgEによって誘導されるアレルギー反応は、時には生命を危険に陥れるほど強力であり(アナフィラキシーショック)、時には慢性化してQOLを著しく低下させる疾患(慢性喘息など)を引き起こす。これらのアレルギー誘導に深くかかわっているのが、マスト細胞である。この細胞はIgEの高親和性レセプターであるFcεRIを発現している。IgEは、このFcεRIといったん結合すると、数週間程度マスト細胞上にとどまる3,4。この状態でアレルゲンがIgEに結合すると、IgE-FcεRI複合体はアレルゲンを介して架橋され、マスト細胞が活性化する。すると脱顆粒が起こり、サイトカインやヒスタミンなどの炎症性誘導物質が放出され、アレルギー反応が誘発される5,6。
IgEは血中で遊離の状態では不安定であるが、FcεRIと結合すると安定的になる。さらに厄介なことに、IgEの結合はFcεRIの発現量を上昇させる5。すると、ますますIgEがFcεRIに結合することになり、アレルギー反応の増大や、微量なアレルゲンでもアレルギー反応を誘発してしまうことになる5。以上から、アレルギー治療において、IgEを標的とし、FcεRIへの結合を阻害することは有効な方法の1つであると考えられる。そこで登場したのがヒト化抗IgE抗体のオマリズマブである。オマリズマブは、重篤な喘息や慢性特発性蕁麻疹患者に有効性が認められている抗体医薬である7。
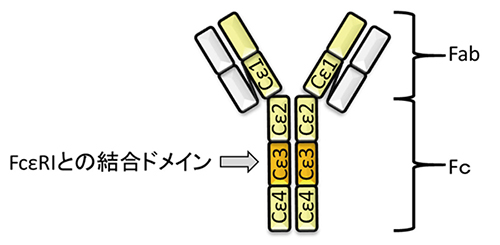
オマリズマブのアレルギー抑制効果について以下に簡単に述べる。IgEの定常領域はCε1, Cε2, Cε3, Cε4の4つのドメインからなる。その中で、IgEのFcεRIへの結合にはCε3ドメインが関与している8(図 1)。オマリズマブはこのCε3ドメインに結合し、IgEがFcεRIに結合することをブロックする8。するとアレルゲンに暴露されてもマスト細胞はFcεRIを架橋できず、その結果、アレルギー反応が抑制されるのだ。しかしオマリズマブは、すでにFcεRIに結合しているIgEには結合できず、そのため治療効果が数週間から数か月ほど遅れてしまう8ことは課題である。
ところで、IgEは他のアイソタイプの中で最も糖鎖が付加された高分子である。過去の報告で、IgEに付加している糖鎖を切断することで、FcεRIへの結合能の低下や、その結果、アレルギー反応が抑制されたことが報告されている4,9。また我々は偶然にも、インフルエンザウイルスの研究でよく使用される、市販のコレラ菌抽出物(Receptor destroying enzyme, RDE)が、中和IgE抗体のウイルス抗原への結合能を消失させていることを見出した10。詳細な解析の結果、RDEはIgEの糖鎖へ影響していることが分かり、さらにRDEで処理したIgEのアレルギー誘導能は大きく低下することも分かった11。本稿では、我々の研究と過去の報告をもとに、IgE の機能と糖鎖の関連性を概説したい。IgEの糖鎖を標的とした新しいアレルギー治療法の可能性について、ご意見をいただければ幸いである。
糖鎖は抗体の機能において、重要な役割を果たしていることがわかっている。抗体の構造を機能的にみるとfragment antigen-binding(Fab)とfragment crystallizable(Fc)という2つのドメインに分けられる12(図 1)。Fabは抗体結合部位を形成し、Fcは抗体の機能を決定するドメインである。たとえばヒトIgG(IgG1, IgG2, IgG4)の場合は、FcのCγ2ドメインに糖鎖が1つ付加されている13。この糖鎖付加は297番目のAsn(N297)において高度に保存されていて、antibody-dependent cellular cytotoxicity(ADCC)活性, complement dependent cytotoxicity(CDC)活性、FcRへの結合性に影響することが分かっている14。一方で、IgG3、IgA(IgA1, IgA2)、IgD、IgMへのN結合型糖鎖付加は複数個所でおこるが13、その中で、IgEは7か所(マウスでは9か所4)と最も多く糖鎖付加が起こる。IgGと同様にやはりIgEの糖鎖もFcRへの結合性に影響する。
20年以上も前の研究であるが、ヒトIgEをFlavobacterium meningosepticum(髄膜敗血症黄色菌)由来のPeptide-N-glycosidase(PNG)で処理するとFcεRIへの結合能が低下することが in vitroの実験において示されている9。Shadeらは、さらに詳細な解析を行い、ヒトIgEに付加している7つの糖鎖のうち、Cε3に付加している高マンノース型糖鎖(N394)が、FcεRIへの結合に重要であることを明らかにした4。マウスではN384に付加している糖鎖が高マンノース型であるが、ヒトIgEと同様の結果であった。すなわち高マンノース型糖鎖を切断する酵素(EndoF1)で処理したIgEや、組み換え技術によって作製したIgE変異体(N394Qなど)を用いると、FcεRIへの結合能は低下していた。さらに、それらIgEのマスト細胞を介したアレルギー誘導能の低下もin vivoで示されていた。
しかし、ほとんどの高マンノース型糖鎖を破壊するような酵素を投与すれば、その副作用は大きいと容易に予想できる。つまり次の課題としては、IgEに付加している糖鎖をいかに“特異的”に破壊して、その機能を不活化できるか、ということではないだろうか。我々は、市販のコレラ菌抽出物(RDE)はIgG(IgG1)にはほとんど作用しないが、IgEでは抗原結合能や、IgEの構造を大きく変化させる可能性を見出した11。その詳細について、次項で紹介したい。
RDEとはコレラ菌の培養ろ液を粉末状にした市販品である。ワクチン接種後の血清などの中和価を測定する際に、非特異反応を防ぐ目的で古くから用いられている15。インフルエンザウイルスは宿主のシアル酸を介して細胞へ感染する。このシアル酸は血清などのサンプル中にも含まれるため、中和価を測定したいサンプルとウイルスをそのまま混合すると、非特異にウイルス感染が阻害(中和)されてしまうことがある。RDEはプロテアーゼ活性のほかにシアリダーゼ活性も有することが知られている15。そこでRDEとサンプルを混合して37℃で一晩反応させるという処理をすることで、この非特異反応を防ぐことができる。
これまでの研究で我々は、抗体遺伝子を用いた新しい受動免疫法で、インフルエンザの予防16や治療10ができることを報告した。詳細は総説にもまとめている17。この研究において、インフルエンザウイルス抗原の1つであるヘマグルチニン(HA)に結合する中和IgG抗体遺伝子をクローニングした。さらにクローニングした抗体遺伝子のうち、可変領域遺伝子は保存し定常領域遺伝子のみ、ほかのアイソタイプ(μ鎖,α鎖, δ鎖,ε鎖)に組み替えた抗体遺伝子(Anti-HA IgM, Anti-HA IgA, Anti-HA IgD, Anti-HA IgE)を作製した10。それら抗体遺伝子をHEK293T細胞へそれぞれトランスフェクションし、培養上清に分泌された抗体の中和能をIn vitro中和アッセイで調べた。これらの抗体遺伝子の構造は、可変領域遺伝子は全く同一であるので、In vitroでは同程度の中和能を示すと予想していた。しかし予想に反して、Anti-HA IgEとAnti-HA IgDでは中和能を全く示さないことが分かった。解析の結果、トランスフェクション後の培養上清をRDEで処理することで、Anti-HA IgGの抗原結合能にはほとんど影響はないが、Anti-HA IgEで抗原結合能が消失していることが分かった11。我々はRDEが特異的にIgEの機能を変化させるのであれば、アレルギー治療につながるのではないかと考えた。そこで、RDEのIgEへの作用について詳細な解析を行うことにした。
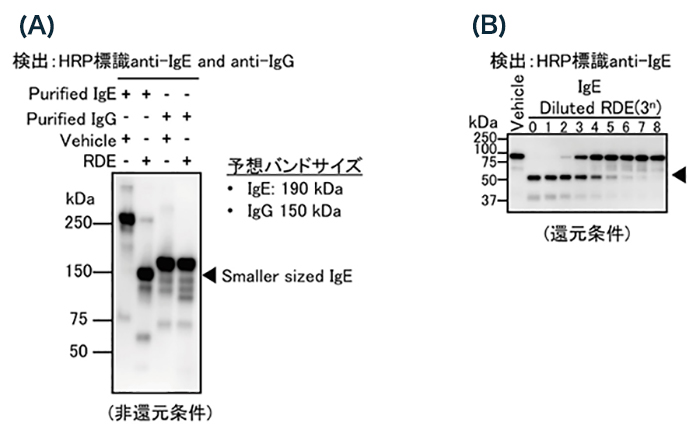
RDE処理によって、Anti-HA IgEの抗原結合能が消失した。そこでまず、RDEがIgEの構造を変化させているかを、市販の精製抗体を用いて、W.B(非還元条件)で確認することにした。IgEの予想バンドサイズは190 kDaである。しかし実際に検出されたIgEのバンドサイズは250 kDa以上の大きさであった(図 2A lane1)。この結果よりIgEは特殊な構造を形成している可能性が考えられた。興味深いことに、RDE処理によって、IgEのバンドサイズは150 kDa付近まで大きく低下していた(図 2A lane2)。RDEはプロテアーゼもしくはシアリダーゼ活性を有する。バンドサイズは予想サイズ(190 kDa)よりも大きくは変わらなかったことから、RDEはIgEの一部のアミノ酸、もしくは糖鎖に作用して、バンドサイズを低下させることが示唆された。また、RDEで処理したIgEを用いて還元条件でW.Bを行った結果、H鎖(ε鎖)のバンドサイズの低下は認められたが、L鎖には大きな変化は認められなかった(図 2B)。これよりRDEはIgEのH鎖に作用していることが分かった。一方で精製IgGをRDEで処理をしてもIgEのようなハンドの変化は認められなかった(図2A lane3,4)。すなわち、RDEの作用には特異性があることも分かった。
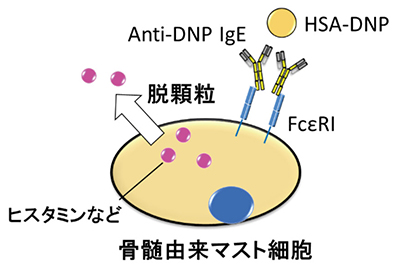
RDEは特異的にIgEの構造を変化させていることが示唆された。そこで我々は、RDE処理したIgEのアレルギー誘導能を確認することにした。In vitroにおけるアレルギー誘導モデルは、骨髄から誘導したマスト細胞に、抗dinitrophenol(DNP) IgEを結合させてアレルゲンであるHuman serum albumin(HSA)-DNPを添加し、ヒスタミンなどのアレルギー誘導物質を測定する系を用いた(図 3)。その結果、RDE処理したIgEではマスト細胞への結合能が低下し、さらにヒスタミンなどの放出量も低下することが分かった。このアレルギー誘導能減少効果は、RDE処理によってIgEの構造が変化した結果であると考えている。
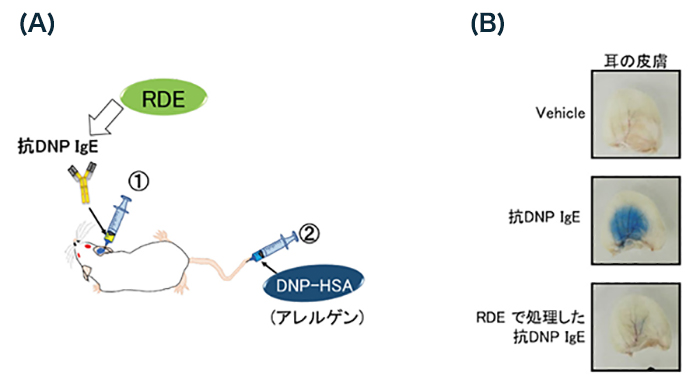
生体内においても、RDEで処理したIgEはアレルギー誘導能が低下しているのだろうか。それを確かめるために、Passive cutaneous anaphylaxis(PCA)反応をマウスに誘導して解析を行った4,18(図 4A)。具体的には、抗DNP IgEをあらかじめマウスの耳の皮膚に投与しておき、エバンスブルーを含んだアレルゲンHSA-DNPを静脈注射すると、抗体投与部位で血管透過性が亢進し、エバンスブルーの滲出が耳の皮膚でおこる。これを観察し、RDEで処理した抗DNP IgEのアナフィラキシー誘導能について解析した。すると未処理の抗DNP IgEを投与した場合では、耳の皮膚が青く変色したのに対し、RDE処理した場合、そのような変化はほとんど認められなかった(図 4B)。以上の結果から、RDEでIgEを処理すると、IgEはアナフィラキシー誘導能を消失することがin vivoにおいても明らかとなった。
前述したようにRDEはシアリダーゼ活性やプロテアーゼ活性を有する15ことが知られているが、他にも様々なコレラ菌由来の成分がRDEには含まれていると考えられた。最初に、RDEのIgEへの作用が酵素反応であるかどうか確かめるために、100℃で熱処理したRDEをIgEへ作用させて、W.Bでそのバンドサイズを解析した。すると、IgEのバンドサイズの低下は認められなかったことから、RDEの作用は酵素反応であることが示唆された。そこで、いくつかのプロテアーゼ阻害剤を用いて、RDEのIgEへの作用を抑制できるか解析を行った。しかしプロテアーゼ阻害剤ではRDEの作用を抑制できなかった。さらに、もうひとつの候補であったシアリダーゼ活性についても検討した。具体的には、Arthrobacter ureafaciens由来の精製シアリダーゼでIgEを処理した。しかし、RDEで処理した場合のようなIgEのバンドサイズの低下は認められなかった。以上の結果から、RDEのIgEへの主要な作用は、プロテアーゼやシアリダーゼ活性ではないと考えられた。
前述したShadeらの報告などから、EndoF1やPNGでIgEを処理すると、FcεRIへの結合能が低下することが分かっている4,9。すなわち、IgEの糖鎖が変化すると、その機能が消失する。そこでRDEもIgEの糖鎖構造に作用しているのではないかと考え、どのような糖鎖が変化しているか、レクチンマイクロアレイ19を用いて解析を行うことにした。レクチンマイクロアレイとは、糖鎖に結合しやすいタンパク質(レクチン)を、スライドガラスなどの基板上に多数固相化し、解析したい糖鎖構造を網羅的に測定できるマイクロアレイの一種である。我々は95種類のレクチンが固相化されたレクチンマイクロアレイを用いて、RDE処理したIgEの糖鎖構造について解析を行った。
レクチンマイクロアレイには2種類のIgE(前述の精製IgE(#1)、抗DNP-IgE(#2))を用いて、未処理とRDE処理の場合で、IgEへの結合性が変化しているレクチンの同定を試みた(図 5A)。まずシアル酸と結合する以下のレクチン、ADA(α2-6Siaと結合)、WGA(polySia)、SNA(α2-6Sia)、PVL(Sia)、LFA(Sia)について、RDE処理の有無で有意な変化は認められなかった。この結果は、前述の精製シアリダーゼでIgEを処理した実験結果と矛盾しない。一方で、RDE処理によって、2種類のIgEに共通して有意に結合能が低下したレクチンは、LEL(トマトレクチン(Lycopersicon esculentum lectin))とPHA-L(Phaseolus Vulgaris Leucoagglutinin)という2つが同定された(図 5B,C)。LELはオリゴN-アセチルグルコサミンもしくはポリラクトサミン(ガラクトースとN-アセチルグルコサミンの繰り返し構造)と結合し20、PHA-Lは3もしくは4本分枝鎖(Gal(1–4)GlcNAc(1–6)Man)と結合する21,22。このレクチンマイクロアレイの結果を追試するために、LELもしくはPHA-Lを用いてレクチンブロットを行った。その結果、RDEで処理したIgEのバンドシグナルは、どちらのレクチンで検出しても低下することが確認された。以上の結果から、RDEは主に、IgEに付加したLELもしくはPHA-Lに結合性を持つ糖鎖に作用していることが分かった。一方で興味深いことに、LEL、PHA-LはIgGにまったく反応性を示さなかった。この結果は、IgGにはLELもしくはPHA-Lに結合性を持つ糖鎖は付加されていないので、RDEはIgGにほとんど作用しなかった、ということを示唆している。以上の結果から、RDEはIgEに付加している一部の糖鎖を特異的に認識して作用し、IgEの構造を変化させ、IgEの機能を不活化している可能性が示唆された。
コレラ菌はシアリダーゼとは別のグリコシダーゼも持っている。たとえばモノカルボン酸アミドを加水分解するアミダーゼがある23。細胞分裂時に、細胞壁の主成分であるペプチドグリカンを分解する必要があるが、その加水分解にアミダーゼは重要な役割を果たしている。他にも、細胞壁の構成成分やコレラ菌のコンピテンシーに関与していることで知られているキチン24,25(ポリアセチルグルコサミン)を分解する酵素(キチナーゼ)もいくつかあることが知られている26。RDEには様々なコレラ菌由来の成分が含まれていると考えられる。LELやPHA-Lが認識する糖鎖に作用する、コレラ菌のグリゴシダーゼ候補はまだ見つけられていないが、いずれかの酵素がIgEの糖鎖に作用して、IgEを不活化できる可能性があると考えている。しかし、ダニが持つキチナーゼはアレルギーの原因物質である27という報告もあるので、RDE中の候補因子の安全性についても十分考慮する必要がある。

RDEはマウスIgEと同様にヒトIgEへも作用するであろうか。RDEで処理したヒトIgEをW.Bで解析したところ、マウスIgEと同様に、そのバンドサイズは大きく低下していた(未発表データ)。さらに、ヒトIgEもLEL、PHA-Lと反応性があることをレクチンブロットで確認できた(未発表データ)。RDE処理したヒトIgEのFcεRIへの結合能やアレルギー誘導などに関して、現在解析を進めているところである。
抗体の機能においても糖鎖は重要な役割を果たしている。IgGに付加したN結合型糖鎖からフコースを除去するとADCC活性が大幅に上昇する28、という発見は抗体医薬の発展にとって大きな貢献である。一方で、IgEは喘息や花粉症などのアレルギーの主要因の1つである。IgEは他のアイソタイプの中で最も糖鎖が付加しており、その中で治療のターゲットとなるような糖鎖が同定できれば、アレルギーのあらたな治療法開発に貢献できると考えている。そのために、ヒトIgEの機能不活化に重要なRDE中の分子(酵素)を同定することが重要であると考えている。
本稿で紹介した研究のレクチンマイクロアレイは、国立研究開発法人 産業技術総合研究所 創薬基盤研究部門 舘野浩章 博士のグループに解析していただきました。また、プロテアーゼインヒビターの実験に関しては、熊本大学 薬学部 今井輝子 教授にアドバイスをいただきました。この場を借りて深く感謝申し上げます。