
氏名:小川 浩司
北海道大学病院消化器内科助教。医学博士
1997年大阪市立大学医学部を卒業。北海道内における主要病院にて消化器内科、主に肝疾患を中心とした臨床研修後、2014年より現職。現在は北海道大学病院肝疾患相談センター長も兼ねる。
研究テーマ:坂本直哉教授指導のもと、肝疾患全般にわたって臨床に即した研究を行っている。また、NAFLDを中心とした肝疾患における糖鎖解析の研究も開始している。

氏名:坂本 直哉
北海道大学大学院医学研究院 消化器内科学教室 教授。医学博士
1987年東京医科歯科大学医学部を卒業。消化器内科(肝臓)を中心とした臨床研修後、1994年より米国コネチカット州立大学医学部リサーチフェローにて留学、帰国後東京医科歯科大学消化器内科での研究指導を経て、2012年より現職。
研究テーマ:現在肝炎ウイルスやNAFLD、肝線維症、肝癌などの肝疾患の研究を行いながら、消化器内科の教室員の指導を行っている。2017年より日本医療研究開発機構 肝炎等克服実用化研究事業「慢性肝疾患の組織病態進展機構の解析および血清組織糖鎖の網羅的探索による予後予測マーカーの構築」代表を務めている。
糖鎖マーカーは疾患の発症や重症度に連動した、特定の糖たんぱく質に見いだされる糖鎖構造変化に着目している。近年、微量な糖鎖構造変化を検出する技術が進歩し、糖鎖マーカーという新たな検査が可能となった。本稿では肝疾患に対する糖鎖の網羅的解析の現状、および当グループで行っている脂肪性肝疾患症例に対する糖鎖解析についても紹介する。
糖鎖を含む生体高分子は複合糖質と言われ、複合糖質には糖たんぱく質、糖脂質、プロテオグリカンがある。糖たんぱく質の糖鎖は、N-グリカンとO-グリカンに大別される。複合糖質は体内のすべての細胞で合成され、すべての細胞表面は複合糖質に覆われている。糖鎖の機能は多様で、親水性のため血清など体液に溶けやすくなる。血清中のたんぱく質の多くは肝臓から分泌されるが、アルブミン以外のたんぱく質はほとんどが糖たんぱく質であり、細胞膜上のたんぱく質も糖鎖が結合した糖たんぱく質である。糖鎖修飾は、たんぱく質の最も頻繁で重要な翻訳後修飾であり、発癌などにおいて病理学的段階に関与している1。糖鎖は結合位置、分岐構造、立体異性による非常に複雑な構造をとっている。最近解析方法の進歩により、この複雑な糖鎖構造を検出することが可能となった。そのため、肝疾患に関連する糖鎖解析が進んでいる。
グライコミクスは、遊離またはタンパク質や脂質などのより大きな分子に結合した糖またはグリカンの解析である。最近では、本邦にて肝線維化マーカーとして、Mac2 binding protein glycosylation isomer(M2BPGi)が開発された2。M2BPGiは背景肝疾患によりカットオフ値は異なるものの、肝線維化進展群の囲い込みに有用である。現在は発癌予測への有用性も報告され、すでに実用化されている。
本稿では肝疾患と糖鎖の解析について、特に肝細胞癌と非アルコール性脂肪性肝疾患に注目して解説する。
肝細胞癌はウイルス性をはじめとする慢性肝疾患における最も重要な合併症であり、この発癌や癌の進行は予後に大きな影響を及ぼす。肝細胞癌に関連する糖鎖としてはフコシル化AFPが知られている。AFPは肝炎や肝硬変などの良性肝疾患においても上昇することが知られているが、フコシル化修飾を受けたAFP-L3分画は肝細胞癌の検出に高い特異性を示し3,4、すでに慢性肝疾患に対する肝細胞癌スクリーニングにて活用されている。
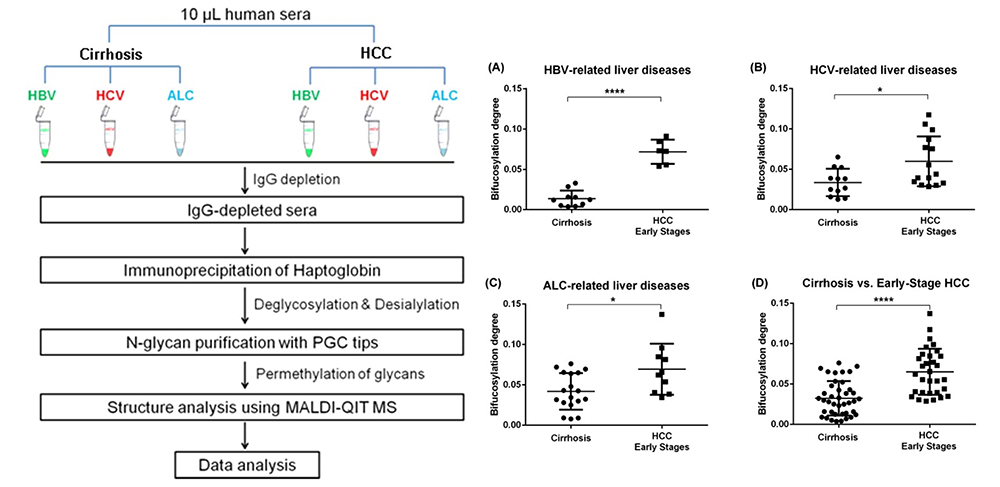
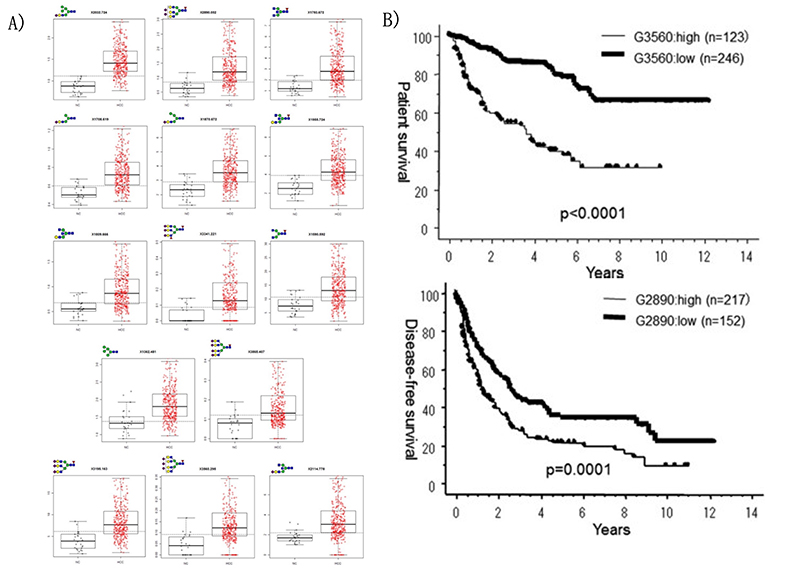
マトリックス支援レーザー脱離/イオン化質量分析(MALDI-MS)は、臨床サンプルのN-グライコニック分析に効果的な手法で、HCCにおけるN-グリカンの解析に広く使われている5。Zhu Jらは肝細胞癌と肝硬変の血清ハプトグロビンのN-グリカンついて検討した。免疫沈降により得られたハプトグロビンをMALDI-MSにて解析し、ハプトグロビンのバイフコシル化の上昇により、各病因カテゴリーの早期肝細胞癌患者を肝硬変から識別できることを報告した(図 1)6。神山らは肝細胞癌切除症例を対象として、術前の保存血清からN-グリカンの質量分析を用いて糖鎖解析を行った。369人の肝細胞癌切除患者と対照群として肝移植ドナー26人を比較解析し、HCCにて有意に変化した糖鎖として14分子を同定した。その中で、再発に関連する糖鎖としてG2890、予後に関連する糖鎖としてG3560を同定し、これらの糖鎖は腫瘍数、大きさ、血管侵襲と相関していることが示された(図 2)7。最近では糖鎖解析方法の進歩とともに、肝発癌に関連する糖鎖や癌の生物学的悪性度に関連する糖鎖に対する研究が進められている(図 3)8,9。
HBVやHCVに対する抗ウイルス療法の劇的な進歩により、ウイルス性の慢性肝疾患は克服されつつある。ウイルス性肝疾患を原因とする肝細胞癌は年々減少傾向にあるが、脂肪性肝疾患に起因する肝細胞癌は増加傾向である。特に近年、肥満や糖尿病を背景とした非アルコール性脂肪性肝疾患(NAFLD)が注目されている。非アルコール性脂肪性肝疾患(NAFLD)は非アルコール性脂肪肝(NAFL:NAFLDの非進行型)と非アルコール性脂肪肝炎(NASH:肝硬変や肝がんの発症につながる進行型)に分類される。現在でも、NAFLD診断および病期分類のゴールドスタンダードは肝生検による組織学的な診断である。しかし、肝生検はサンプリングエラー、病理医間の診断不一致といった問題もある。さらに、侵襲を伴う検査であるため、NAFLD全例に肝生検を行うことは困難で、非侵襲的なバイオマーカーの登場が期待されている。しかし、NAFLDに関連する糖鎖マーカーの報告は少ないのが現状である。
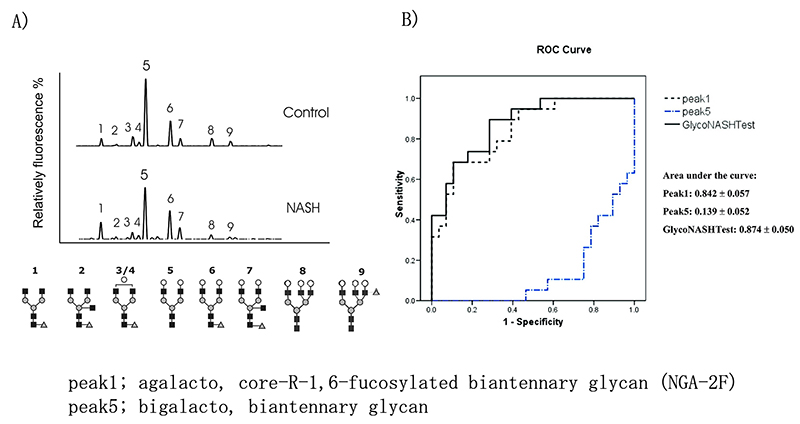
Chen C10らは47人のNAFLD患者(NASH38人、NAFL9人)および健常人13人のN-グリカンをDNA Sequencer Assisted Fluorophore Assisted Carbohydrate Electrophoresis(DSA-FACE)にて解析した。NASH患者においてpeak1; agalacto, core-α-1,6-fucosylated biantennary glycan(NGA-2F)が有意に高く、peak5; bigalacto, biantennary glycan(NA2)が有意に低く(図 4A)、この対数比(GlycoNashTest:log[NGA2F]/[NA2])がNASH診断に有用であると報告した。このGlycoNashTestはNAFLDにおける肝線維化と有意に相関し、ROC解析による高度線維化(F3/4)を有するNASH診断のAUCは0.874、感度89.5%、特異度は71.4%であった(図 4B)。さらに、Blomme Bらはこの糖鎖マーカーが肥満手術予定のNAFLD患者におけるNASH診断11、小児期のNAFLD患者におけるNASH診断に有用であったと報告し12、肝組織における炎症との相関についても報告している。
M2BPGiは当初C型肝炎における肝線維化診断への有用性が証明されたが、その後も様々な疾患で肝線維化との関連が報告されている。NAFLDにおいても線維化診断13や発癌予測14への有用性が報告されている。Kamada Yらは糖鎖マーカーであるフコシル化ハプトグロビンのNAFLD診断への有用性を検証し、さらにM2BPを組み合わせることで、NASH診断が向上したと報告15しています。
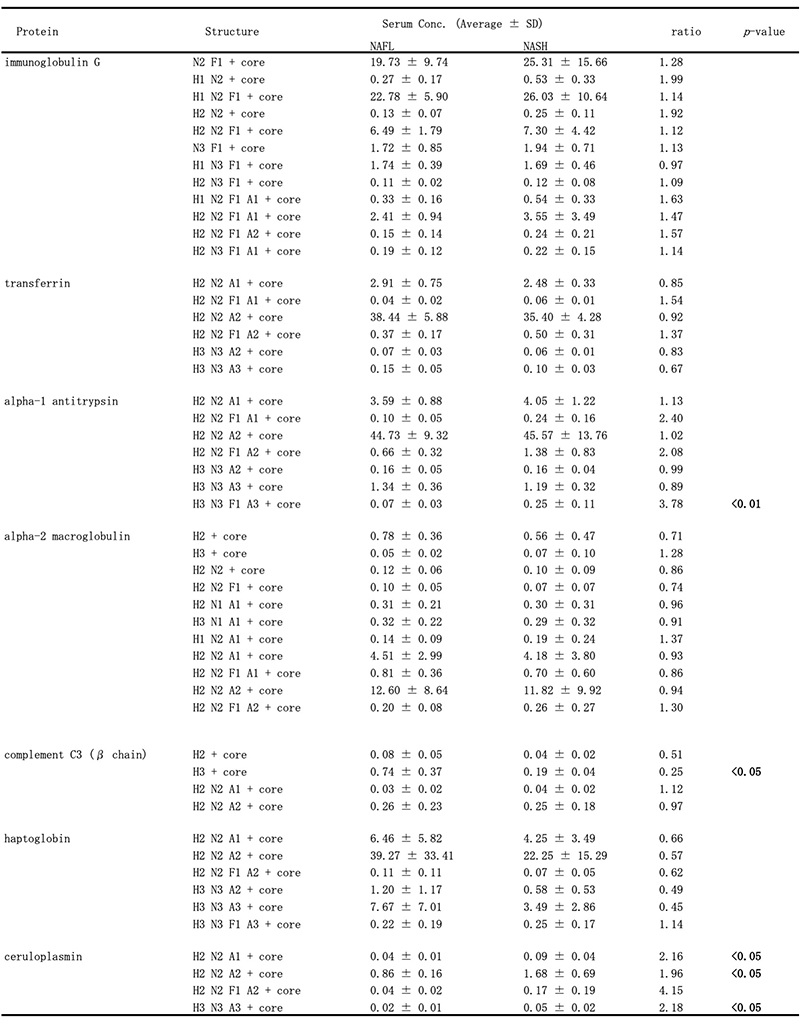
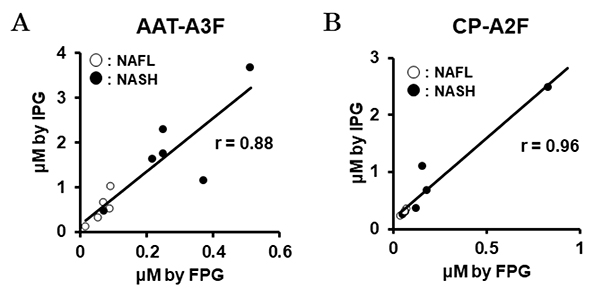
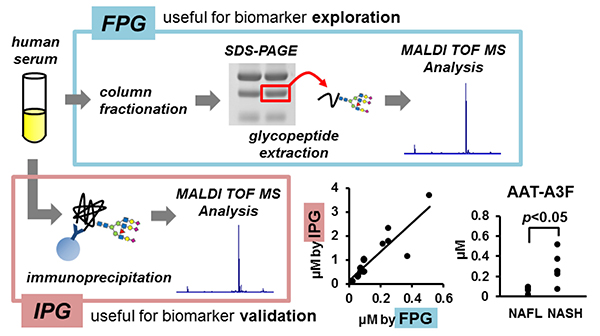
最近、当グループにおいてもNAFLD患者を対象とした網羅的な糖鎖マーカーの解析を行っているので、解析手法について紹介する。 Nグリカンは、炎症や線維症、癌の進行など、多くの疾患の診断および治療のバイオマーカーになる可能性があると報告されています。NAFLDにおいても、いくつかのグリカンはNASH診断のバイオマーカーになりえると報告されています16。そこで、我々はfocused protein glycomics(FPG法)17を用いてNAFLD患者におけるN-グリカンを解析した。この方法により、NAFL患者に対してNASH患者で有意に高値であったいくつかのNASH診断の候補糖鎖を抽出した。その中でtri-sialylated mono-fucosylated tri-antennary glycan of alpha-1 antitrypsin(AAT-A3F)が最も変化が大きく有用なマーカーと考えられた(表 1)。しかし、FPG法は包括的な解析には有用であるが、煩雑で時間もかかるため多数例での検討には適さない。そのため標的糖鎖に対する多数例での解析を可能とするimmunoprecipitation-glycomics(IPG)法18による解析手法を開発した。我々は抽出されたIPG法とFPG法による測定値を比較検証した.これらの2つの方法によるNグリカン測定値は有意に相関していることが確認され、この簡略化されたIPG法により標的蛋白質の定量Nグライコミクスが可能となった(図 5)。このようにFPG法は多数の糖鎖構造の中から疾患関連糖鎖を抽出する網羅的解析に有用で、抽出した標的糖鎖の臨床的有用性の検証にはIPG法を併用することにより、肝疾患をはじめとする疾患に関連する糖鎖を解析することが可能になる(図 6)19。現在最も有力な候補糖鎖として期待されたAAT-A3F のNASH診断における有用性を検証するため、多施設共同で検証研究を進めている。
肝疾患診療においては、肝線維化や炎症、発癌など病態に応じて非侵襲的なバイオマーカーが必要とされている。特に肝炎ウイルスの克服とともに、肝疾患においてNAFLDは重要な位置を占めてくると予想される。そのため、NAFLDに関連する糖鎖は今後さらに注目されてくる分野と考えられ、糖鎖の解析手法の進歩とともに、解明が進んでくるものと期待される。