
氏名:伊達 公恵
お茶の水女子大学ヒューマンライフイノベーション研究所 特任講師
2000年お茶の水女子大学理学部卒、2002年同博士前期課程修了、製薬会社、特許事務所に正社員として勤務後、2012年同博士後期課程修了、博士(理学)(小川温子研究室)。学振特別研究員DC2、PD、RPD、イェール大学リサーチフェローを経て、2017年より現職。2017年ロッテ重光学術賞受賞。膵臓酵素の糖結合性や細胞外マトリックス糖タンパク質糖鎖の機能解明に取り組んでいる。創薬など世の中に役立つ成果を出すことを目標としている。
アミラーゼは、1833年に発見された初めての酵素である。デンプンなどの多糖類をマルトオリゴ糖やマルトースにまで分解する消化酵素で、古くから現在まで、その基質特異性の解析や阻害剤の開発が盛んに行われている。膵α-アミラーゼは、膵臓で合成後に小腸に分泌されて多糖類の消化を行う。我々は、膵α-アミラーゼが糖タンパク質のN-型糖鎖に結合するという発見をきっかけに、これまでの消化酵素としてのアミラーゼ研究とは少し異なる視点から研究を行っている。最近、膵α-アミラーゼは、その糖結合性により、小腸内における膵α-アミラーゼの局在決定や糖質消化・吸収の調節など、多糖類の消化以外の機能があることが分かってきたので、紹介する。
膵臓酵素は、主に多糖類、脂質、タンパク質、核酸を分解する消化酵素から構成されている。脂質分解酵素は4種類、タンパク質分解酵素は9種類、核酸分解は2種類と、各々の基質に対する消化酵素は一つではなく複数の酵素が存在し補っている。しかし、多糖類に対する動物消化酵素は、α-アミラーゼ一つだけである1-3。また、タンパク質分解酵素は、膵腺房細胞では不活性なプロ酵素として合成されるのに対し、α-アミラーゼを含むその他の膵臓酵素は活性型として合成される。α-アミラーゼは、ラット膵液では26.5%と膵臓酵素の中で最も多い含有量を示す2。我々は、植物レクチンの研究を進める中で、膵α-アミラーゼに糖結合性があることを発見し、その生体内機能の解明を進めている。糖尿病や肥満の予防や治療、炭水化物の消化異常症状の改善に役立つ食事療法や創薬に繋がる研究を目指している。
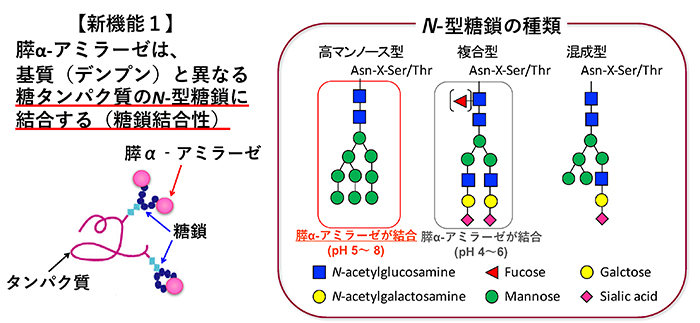
α-アミラーゼ [EC.3.2.1.1] は、多糖類のα-1,4グリコシド結合を鎖の途中で加水分解するエンド型酵素であり、大量のマルトースを生成する。ヒトのα-アミラーゼは、膵臓と唾液腺以外でも検出されるが、そのほとんどが膵臓と唾液腺由来のα-アミラーゼである。両者のアミノ酸組成は約97%と非常によく類似しており、どちらもC末端に2カ所のN-型糖鎖付加部位が存在する。膵α-アミラーゼは分子量54,000で糖鎖がほとんど付加しておらず、唾液腺α-アミラーゼは糖鎖付加された分子量62,000のfamily-Aと、糖鎖付加されていない分子量56,000のfamily-Bが存在する4,5。実際、我々が行った糖組成分析によっても、ブタ膵α-アミラーゼには、ほとんど糖鎖が付加されていないことを確認している。α-アミラーゼに糖鎖が付加することで、熱安定性は増加するが、基質との結合性、ならびに膵外分泌に対してα-アミラーゼの糖鎖付加の影響はないことが報告されている4,5。α-アミラーゼは血中にも存在し、正常時には、膵臓と唾液由来の各α-アミラーゼが約1:1の割合となっている6。血中での膵臓と唾液由来の各α-アミラーゼの割合や活性が、膵炎などの病態診断に利用されている。各α-アミラーゼの血中での役割や血液への移行経路は未だ明らかにされていない。
膵α-アミラーゼの糖結合性は、まずブタ膵α-アミラーゼ(PPA)について、セファロースビーズに固定化した糖タンパク質カラムを用いた糖溶出、糖ビオチン化ポリマープローブを用いたELISA、表面プラズモン共鳴センサー等により調べた7。PPAは、単糖レベルでは、特にマンノースに対して最も高い結合を示す。糖タンパク質レベルでは、O-型糖鎖をもつ顎下腺ムチンなどには結合せず、N-型糖鎖をもつ糖タンパク質によく結合する(図 1)。複合型N-型糖鎖を主にもつフェツイン、トランスフェリンへの結合は、中性では非常に弱く、酸性になるにつれて結合が強まる。一方、高マンノース型N-型糖鎖をもつリボヌクレアーゼBへは、弱酸性だけでなく中性条件下でも結合する。ブタ由来以外にヒト膵α-アミラーゼの糖結合性を解析するため、レコンビナント ヒト膵α-アミラーゼ (recHPA) を酵母に発現させ精製した。recHPAは、PPAと同等の糖結合特異性を有する8。膵α-アミラーゼの糖タンパク質への結合定数Kaは106~7M-1であり、植物レクチンの糖結合性に比べると1〜2桁ほど低い。膵α-アミラーゼが糖質消化酵素として働く小腸は、糖衣と呼ばれる糖鎖で覆われている。主成分はムチンであるが、小腸刷子縁膜にはN-型糖鎖をもつ様々な膜糖タンパク質が発現している。膵α-アミラーゼが糖結合性により、小腸刷子縁膜上の膜糖タンパク質のN-型糖鎖と相互作用することが分かってきたので、次に述べる。
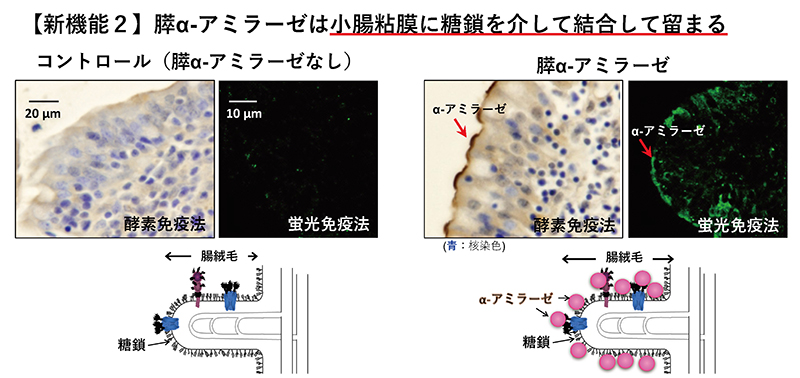
膵α-アミラーゼは、膵腺房細胞で合成され、他の膵臓酵素と共にチモーゲン顆粒中に貯蔵される。チモーゲン顆粒中の膵臓酵素は、消化管ホルモンなどの外的刺激により、膵腺房細胞の頂端側から膵管側にチモーゲン顆粒が開口し、膵液中に分泌される9。分泌された膵液は、膵管から十二指腸へ送られる。十二指腸に到達した後の膵α-アミラーゼの局在は、これまでよく知られていなかった。そこで、我々は十二指腸における膵α-アミラーゼの局在と糖結合性の関連を調べた。
ブタ十二指腸を用いた免疫組織染色から、膵α-アミラーゼは、小腸の刷子縁膜上に結合することがわかった(図 2)8。膵α-アミラーゼの小腸刷子縁膜への結合は、マンノースの多糖であるマンナンで阻害される。ガラクトースの多糖であるガラクタンや、シアル酸の多糖であるコロミン酸で阻害されない。これらの結果と膵α-アミラーゼの糖結合性の特徴とから、膵α-アミラーゼが小腸刷子縁膜上の高マンノース型N-型糖鎖に結合することが示唆された。この小腸刷子縁膜に膵α-アミラーゼが結合することで、糖類の消化・吸収にどのような影響を与えるのかを実験により調べた結果を次に示す。
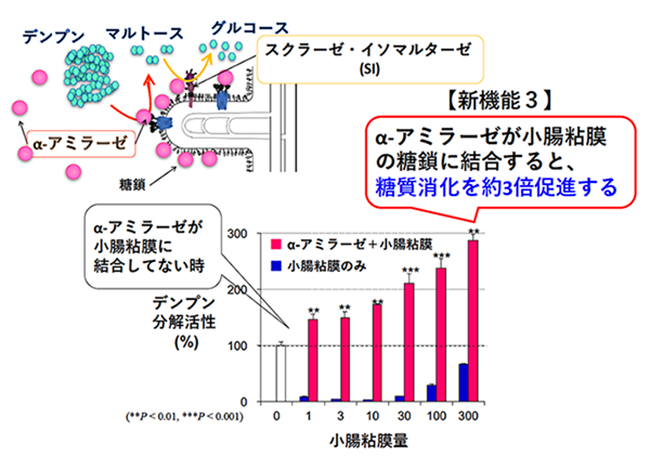
食事由来の多糖類は、十二指腸で、膵液中のα-アミラーゼによりニ糖のマルトースにまで分解される。マルトースは、小腸刷子縁膜の膜酵素であるスクラーゼ・イソマルターゼにより単糖のグルコースにまで分解される。マルターゼ・グルコアミラーゼも小腸刷子縁膜に局在し、マルトースを基質としてグルコースに分解する。腸内でマルトースを分解する酵素の寄与割合は、スクラーゼ・イソマルターゼが8割、マルターゼ・グルコアミラーゼが2割と報告されている10,11。このように、十二指腸管腔では、膵α-アミラーゼがデンプンなどの多糖類からマルトースまでの消化を、主にスクラーゼ・イソマルターゼがマルトースからグルコースまでの消化を担い、膵α-アミラーゼとスクラーゼ・イソマルターゼが連携して糖質消化を行っている。我々はこの連携消化に注目し、膵α-アミラーゼと小腸刷子縁膜の糖タンパク質スクラーゼ・イソマルターゼとの相互作用解析を行った。
先に述べたように、膵α-アミラーゼは、膵臓から分泌され十二指腸に到達すると、その糖結合性により小腸刷子縁膜の糖鎖に結合する。膵α-アミラーゼは、小腸刷子縁膜へ結合することで、結合しない時に比べて、デンプン分解酵素活性を約3倍増強させ、多糖類消化を促進する(図 3)8。スクラーゼ・イソマルターゼは、スクラーゼとイソマルターゼとで複合体を形成し、スクラーゼ側に膜貫通部位があり、イソマルターゼは小腸管腔側に飛び出した状態でいる。スクラーゼ・イソマルターゼは、高度にグリコシル化された215 kDaの膜糖タンパク質である。ヒトではN-型糖鎖結合部位が多数存在し、複合型と高マンノース型N-型糖鎖とO-型糖鎖の付加が確認されている12,13。膵α-アミラーゼは、小腸刷子縁膜上のスクラーゼ・イソマルターゼのマンノースを含むN-型糖鎖に結合する。この結合によって、スクラーゼ・イソマルターゼのマルトースの分解活性は約2倍に増強する8。刷子縁膜に結合した膵α-アミラーゼも、先に述べたようにデンプン分解活性が増強する。このように、膵α-アミラーゼの糖結合性は、スクラーゼ・イソマルターゼの糖鎖との相互作用によって、デンプンからグルコースまでの小腸での多糖類連携消化を促進し、効率的なエネルギー獲得を生み出している。
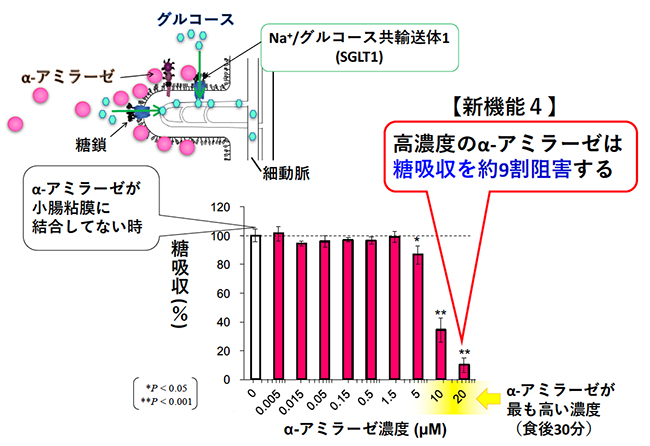
生体内で糖を輸送するトランスポーターは、GLUT(Glucose transporter)とSGLT(Sodium-glucose cotransporter)がある。小腸でのグルコース吸収は、刷子縁膜に発現するSGLT1により能動的に行われる。細胞内に取り込まれたグルコースは、基底膜側に発現するGLUT2により受動的に輸送され、血糖値が上昇する14。SGLT1は、ウサギ小腸では細胞外の一ヶ所に3-4本鎖の複合型糖鎖が付加している15。膵α-アミラーゼとSGLT1との関連性についての報告はほとんどなかったため、我々は、膵α-アミラーゼがSGLT1のグルコース吸収活性に与える影響を明らかにするために、再構成刷子縁膜小胞を用いてSGLT1活性測定を行うことにした。
小腸刷子縁膜小胞に膵α-アミラーゼを加え、SGLT1のナトリウム依存的なグルコース吸収を測定すると、膵α-アミラーゼは濃度依存的にSGLT1のグルコース吸収を阻害した(図 4)8。高濃度の膵α-アミラーゼによって、SGLT1のグルコース吸収は約90%まで阻害された。膵液のタンパク質濃度は、正常なブタで4.2 mg/ml、ウシで5-16 mg/mlである16。その約26.5%をα-アミラーゼが占めることから、SGLT1活性を阻害する膵α-アミラーゼ濃度は、生理的にあり得る濃度だと考えられる。
SGLTの阻害剤は、糖尿病治療薬として研究開発されている。りんごや梨の樹皮に含有するフロリジンは血糖値を下げる効果が知られており、SGLTを阻害する17。しかし、フロリジンは、経口投与では代謝されてしまい有効な血中濃度を保つのが難しいことから、製薬会社では、代謝安定性のある化合物での創薬が行われ、開発されたのがSGLT阻害剤である。SGLT2阻害剤は、腎尿細管に特異的に発現するSGLT2のみを選択的に阻害し、尿中から過剰なグルコースを排出させる。低血糖リスクの少ない画期的な糖尿病治療薬とされている18。近年、SGLT1とSGLT2を二重に阻害する経口薬にも有効性が示され、SGLT1を阻害することも糖尿病治療に利用可能との報告がある19。
これまで述べた通り、膵α-アミラーゼは、小腸の刷子縁膜上の糖鎖に結合して留まることで、多糖類消化を促進する一方で、グルコース吸収を抑制する。膵α-アミラーゼは、摂食状態のブタ小腸では強く免疫蛍光染色されるが、絶食状態のブタ小腸では、ほとんど染色されない。そこで、絶食状態のブタ小腸に膵α-アミラーゼを添加し、膵α-アミラーゼの局在を観察した。その結果、膵α-アミラーゼは、4℃で刷子縁膜上に結合し、37℃で徐々に組織内への移行が観察され、やがてリソソームへと局在することが分かった20。また、3週間単層培養して小腸様に分化させた腸上皮細胞 Caco-2による実験においても、膵α-アミラーゼは、4℃で細胞膜に結合し、37℃で取り込まれ、エンドサイトーシス経路を通りリソソームへ到達することが示された。膵α-アミラーゼは、リソソームで全て分解されないことから、小腸上皮細胞内に取り込まれ後にエキソサイトーシスにより血中に移行する可能性も考えられる。
小腸刷子縁膜上のSGLT1は、膵α-アミラーゼと共局在する20。しかし、SGLT1は、膵α-アミラーゼと共にエイドサイトーシスにより細胞内に取り込まれるのか、そのまま膜に留まるのか、それとも膵α-アミラーゼとは異なる経路で移動するのかは、はっきりと分かっていない。
小腸様に分化したCaco-2細胞を用いた実験によって、細胞表面に局在したSGLT1は、培地交換後30分で細胞表面から消え、60分で再び細胞表面に戻ることが明らかになった20。SGLT1の半減期は2.5日であることから21、SGLT1は細胞表面と細胞内でリサイクリングしていると考えられる。このSGLT1のリサイクリングは、外因性の膵α-アミラーゼに影響されず、リン酸緩衝液や培地交換だけでも観察される。また、リソソーム阻害剤であるクロロキンによる影響も受けない。培地交換に類似した刺激、例えば胃液や膵液などが小腸刷子縁に流れ込むような刺激が起こると、SGLT1が小腸刷子縁膜から細胞内へ移行し、急激な血糖値上昇を防ぐといった自己防衛機能があるのかもしれない。面白いことに、血糖値が最も高くなる食後30分と、SGLT1が培地交換から細胞内へ移行する時間は30分と一致している20。
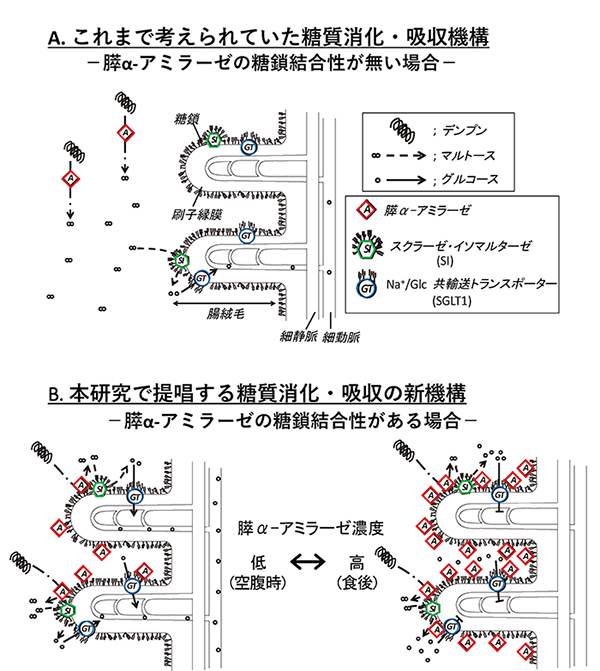
これまで考えられていた膵α-アミラーゼによる多糖類の消化・吸収は、膵α-アミラーゼが小腸管腔を移動しながらデンプンを消化する。次いで、膵α-アミラーゼによってデンプンから生成したマルトースは、小腸刷子縁のスクラーゼ・イソマルターゼ (SI)に近いもののみグルコースに分解されると考えられてきた(図 5A)。膵α-アミラーゼの糖結合性の発見から、次のような糖質消化・吸収の新機構が考えられる(図 5 B)。膵臓から十二指腸へ分泌された膵α-アミラーゼは、小腸刷子縁上のN-型糖鎖と結合して留まる。空腹時などの膵α-アミラーゼ低濃度時には、膵α-アミラーゼは、SIと共に活性化して糖質消化を盛んに行い、グルコース生成を促進する (図 5B左)。食後などの膵α‐アミラーゼが腸内で高濃度状態になると、SGLT1活性を阻害してグルコース吸収を抑制する(図 5B右)。このように、膵α-アミラーゼの糖結合性は、SIとともに消化促進して空腹時血糖が下がりすぎないようにする機能と、SGLT1を阻害して食後の急激な血糖値の上昇(食後高血糖)を防ぐ機能とを持つ。膵α-アミラーゼは、濃度に応じてこれら2つの機能を選択的に使い分け、血糖値恒常性に寄与すると考えられる。
膵α-アミラーゼの糖結合性の発見をきっかけに、膵α-アミラーゼには、多糖類を分解する消化酵素としての機能以外に、膜消化やグルコース吸収を調節する機能を持つことが示された。膵α-アミラーゼと小腸糖鎖との相互作用を促進または阻害することで、糖質の消化・吸収を調節する物質を探索し、糖尿病や肥満などの予防や治療に活用できることを期待している。
謝 辞
本稿で紹介した内容は、多くの方々のご協力とご支援によりなされました。本研究はお茶の水女子大学の小川温子先生が始められた研究であり、この場をお借りして深く感謝申し上げます。また、酵母細胞を用いたレコンビナント ヒト 膵α-アミラーゼの発現にご協力頂いた独立行政法人産業技術総合研究所の故地神芳文先生、仲山賢一先生、梅村真理子先生、Caco-2分化培養にあたり、ご助言くださった岡山大学の佐藤あやの先生らに深く感謝申し上げます。地神先生には、第1回 地神芳文記念研究助成金(特定非営利活動法人酵母細胞研究会)糖鎖部門においてもご支援頂きましたこと厚く御礼申し上げます。