
氏名:木下 タロウ
大阪大学微生物病研究所籔本難病解明寄附研究部門 教授
東京大学農学部卒業(1974)、同大学院農学系研究科修士課程修了(1977)、大阪大学大学院医学研究科博士課程修了(1981)。医学博士。日本学術振興会奨励研究員(1981)、ニューヨーク大学博士研究員(1982)、大阪大学医学部細菌学助手(1982)、同講師(1988)を経て、大阪大学微生物病研究所教授(1990)。同研究所所長(2003)、同大学免疫学フロンティア研究センター副拠点長(2007)。2017年から現職。大阪科学賞(2001)、文部科学大臣表彰(2010)、IGO Award 2015、武田医学賞(2017)、日本免疫学会ヒト免疫研究賞(2017)。補体とタンパク質GPIアンカーに関する研究を行ってきた。
真核生物の数多くの細胞表面タンパク質は、GPIと呼ばれる糖脂質を膜アンカーとして細胞膜外葉に挿入されており、GPIアンカー型タンパク質(GPI-AP)と呼ばれる(図1)。GPI-APは、ヒトでは150種余りが知られており、加水分解酵素、受容体、接着因子、補体制御因子、プリオンなど様々な機能を持つ分子が含まれる1。原生動物には様々な病原微生物が含まれるがそれらにはGPI-APが特に多く存在することが知られており、GPIは細胞表面タンパク質の主要な膜アンカー構造である2, 3。また、タンパク質の膜アンカーGPIと類似の構造を持つGPI様の糖脂質が、タンパク質に結合しないフリーの形で存在することも知られている。病原性真菌も含め真菌類にもGPIアンカー型タンパク質が多く存在する。出芽酵母では、約6,000遺伝子のうち60程度がGPIアンカー型タンパク質の遺伝子である。真菌のGPIアンカー型タンパク質は、細胞膜上に存在するもの以外に、GPIの糖鎖内での切断後、細胞壁の糖鎖に転移され細胞壁成分として存在するものがあることが特徴である4。
GPI-APは、原核生物には存在しない。例外として、結核菌などの抗酸菌にGPIに類似の糖脂質が豊富に存在することが挙げられる。抗酸菌は、ホスファチジルイノシトール(PI)を膜リン脂質として多く持ち、それにマンノース(Man)のポリマーが結合したホスファチジルイノシトールマンノシド (PIM)、リポマンナン (LM)、リポアラビノマンナン (LAM) が細胞壁の主要成分のひとつのグループとして存在している5。結核菌のLAMやPIMは、宿主免疫細胞上のレセプター型Cタイプレクチンのリガンドであり、免疫系を活性化させる6。
古細菌のGPI/GPI-APに関する研究はほとんど報告がないが、Sulfolobus acidocaldariusにおいてエタノールアミンなどGPI構成成分を含む膜タンパク質の存在が示されている7, 8。GPI-APの存在を示唆するデータであるが、構造研究の報告が待たれる。
GPIは、マンノース3つとグルコサミン(GlcN)からなる糖鎖、イノシトールリン脂質そしてタンパク質と糖鎖をつなぐエタノールアミンリン酸(EtNP)からなり、EtNPからイノシトールリン酸に至る骨格の構造は生物種間で広く保存されている(図1)。EtNのアミノ基がタンパク質のC末端とアミド結合している。骨格の構造は、C末端- EtNP-6Manα-2Manα-6Manα-4GlcNα-6myoInositol-P-lipidである。GPIの糖鎖骨格の特徴は、Nアセチル化されていないグルコサミンが含まれていることである。生物種によって、また一つの生物種内でも組織やタンパク質によって、骨格は種々の側鎖で修飾され、GPIアンカー構造に多様性が導入される。イノシトールリン脂質部分は、生物種、組織などによって変化がある。哺乳動物では1-アルキル-2-アシルPI型が主体で、ジアシルPI型は少数成分である。酵母やAspergillusなどの真菌ではジアシルPI型とイノシトールリン酸セラミド型がある。イノシトールリン酸セラミドはPIではないが、このセラミド型も含めてGPIと総称している。マウス・ヒトの精巣上体や原生動物では、イノシトール環の2位がアシル化された1-アルキル-2-リゾPI型が存在する。
睡眠病トリパノソーマは、アフリカのサハラ砂漠以南の多くの国に分布し、吸血昆虫であるツェツェバエによって媒介され、人に睡眠病を、家畜にナガナと呼ばれる疾患を引き起こす病原性原生動物(原虫)である。睡眠病トリパノソーマを唾液腺に持つツェツェバエに吸血された時に感染する。トリパノソーマは細胞に侵入することなく血漿中で増殖し、発熱を伴う急性感染を引き起こす。その後、寛解と発熱を繰り返す期間を経て、脳症状を伴う段階へと進展する。治療がなされないと、昏睡から死に至る場合も多い。
ヒトや家畜に病気を起こす血流型のトリパノソーマは、GPI-APであるvariant surface glycoprotein (VSG)で細胞表面が覆われている(図2A)。VSGは、細胞当たり107分子存在し、原虫細胞を宿主の補体から保護するコートを形成している3。VSGはGPIアンカー型であることによって、膜貫通型タンパク質であるよりも細胞膜上に密に存在し得ると考えられている。血流型のトリパノソーマでは、VSGが形成するグリコカリックスが細胞膜を血中の高濃度の補体の作用から保護するのに必須である9。VSGは防御コートとして働くとともに、抗原変異を起こして免疫を回避し、持続する感染に関与する。すなわち、トリパノソーマは異なる配列を持つ1,000を超えるVSG遺伝子をゲノム中に持ち、一つの細胞ではそのうちの1種類だけを発現している。VSGは抗体誘導能が高く、感染後、宿主の抗体産生は主としてVSGに向けられる。抗VSG抗体が産生されると、抗体と補体の作用でトリパノソーマはほとんどが速やかに死滅し、いったん血中から消失するが、集団中には遺伝子変換(gene conversion)によって別のVSG遺伝子に発現が切り替わった個体ができ、それが異なるコート構造のため抗体の結合を免れて再び増殖する。この過程が繰り返され感染が持続される9。
血流型のトリパノソーマは、VSGのコートに加え、GPIアンカー型のトランスフェリン受容体を発現しており、鞭毛ポケットでのトランスフェリン取り込みに働く10。トランスフェリンは、血流型トリパノソーマの増殖に必須である。
血流型トリパノソーマからGPI生合成に必須なTbGPI10遺伝子のノックアウト細胞を得ることはできない。あらかじめエピゾームとしてTbGPI10 cDNAを持たせておくとゲノム上のTbGPI10遺伝子のノックアウトが可能であるが、トリパノソーマはTbGPI10 cDNAを載せたエピゾームを失うことができない。すなわち、GPIの生合成は、血流型トリパノソーマの生存に必須である11。トランスフェリン受容体の欠損が必須性の原因であると思われる12。また、VSGでできた表面コートの欠損による細胞の物理的脆弱性も必須性に寄与している可能性がある。
この結果は、トリパノソーマ特異的にGPIの生合成を阻害する薬剤は、睡眠病やナガナ病の治療薬になる可能性を示している12。実際、GPI生合成経路の第2ステップを触媒するGlcNAc-PI脱アセチル化酵素の特異性の違いを利用した基質アナログの阻害剤が報告されている13。
睡眠病トリパノソーマはツェツェバエによって媒介される。ヒトや家畜の血中で増殖した血流型トリパノソーマは増殖を停止し、吸血によってツェツェバエに取り込まれ、消化管(中腸)内で増殖するステージであるプロサイクリック型へと変化(分化)する。プロサイクリック型トリパノソーマの細胞表面は、VSGとは全く異なるプロサイクリンと呼ばれるGPI-APで覆われている(図2B)。プロサイクリンには、グルタミン酸とプロリンの繰り返し構造をもつEPプロサイクリンとグリシン-プロリン-グルタミン酸-グルタミン酸-スレオニンの繰り返し構造をもつGPEETプロサイクリンの2種があるが、どちらもGPI-APである14。
プロサイクリンのGPIアンカーにはラクトサミンの繰り返し構造を含む糖鎖の側鎖が結合し、さらにラクトサミンのガラクトースにシアル酸が結合する(図2B)15。プロサイクリンはシアル酸を含む大きな側鎖を持つGPIアンカーによって原虫体表面にグリコカリックス層を形成し、おそらく消化酵素による障害を防ぐことにより、ツェツェバエの消化管での生存に寄与している。
トリパノソーマはシアル酸合成系を持たないが、プロサイクリック型トリパノソーマの表面にはシアル酸が豊富に存在し、その主体はGPIアンカーの側鎖に結合している。これらのシアル酸は、ツェツェバエが吸血した哺乳動物の血液成分(赤血球表面や血漿のシアル酸含有タンパク質)から、トランスシアリダーゼによって移し取られる16。プロサイクリック型トリパノソーマは細胞表面にトランスシアリダーゼを発現しており、この酵素自体もGPI-APである。
プロサイクリック型トリパノソーマのフラスコ中での増殖にはGPIは必須ではなく、TbGPI10遺伝子をノックアウトしたプロサイクリック型原虫を作製することができ、増殖速度にも大きな影響はない。しかしTbGPI10破壊株を馬血液と共にツェツェバエに吸い込ませる実験から、中腸内での速い増殖にはGPIが必須であることがわかった17。
マラリアは、熱帯、亜熱帯に広く存在する疾患で、ハマダラカの仲間によって媒介されるマラリア原虫によって引き起こされる。人にマラリアを起こす種は5種で、熱帯熱マラリア原虫 (Plasmodium falciparum) と三日熱マラリア原虫(P. vivax)による症例が多い。マラリア原虫は、睡眠病トリパノソーマと異なり、細胞内寄生性である。媒介カの唾液腺に存在するスポロゾイトが吸血時に血管に入り、短時間のうちに肝細胞に侵入し、無症状の期間ののち、肝細胞から放出されたメロゾイトが赤血球に侵入、増殖、放出、侵入を繰り返すことにより発症する。感染赤血球の破壊に伴うメロゾイト放出時に熱発する。また、熱帯熱マラリアの場合には、感染赤血球が毛細血管内皮に接着することにより、脳症状や腎障害などの重度の症状を引き起こす。
媒介カから放出されて感染を成立させるスポロゾイトは、CSP (circumsporozoite protein)と呼ばれるGPI-APで覆われている18。また、赤血球ステージとして主症状を引き起こすメロゾイトも、その主要表面タンパク質であるMSP1 (merozoite surface protein 1)やその他いくつかのタンパク質がGPI-APである(図2C)19。
熱帯熱マラリア原虫のメロゾイトあるいは感染赤血球からはGPIが遊離し、宿主にTNFαなどのサイトカインを産生、分泌させることで病態の増悪に働く(GPIトキシン)とされている。宿主のGPIとの構造上の違いは脂質部分にあるので、トキシン活性には脂質部分が関与していると思われる。GPIの化学合成糖鎖をキャリアタンパクのKLHと結合させたワクチンは、マウスの重症マラリアモデルで有効であったと報告された20。
トキソプラズマも、マラリア原虫と同じく細胞内寄生性の原虫で、トキソプラズマ症の原因になる。感染した妊婦から垂直感染した胎児に起きる先天性トキソプラズマ症は、水頭症、精神運動機能障害、視力障害などが主症状である。免疫力が正常な成人では感染しても無症状であるが、エイズ患者など免疫が低下した人には、肺炎、脳炎など重篤な症状をきたすトキソプラズマ症を引き起こす。
トキソプラズマは細胞表面にGPIアンカー型タンパク質を大量に発現している。加えて、タンパク質に結合していないフリーGPIを高レベル産生する。フリーGPIは細胞表面に存在するだけでなく、周囲へ遊離している。フリーGPIは、第1マンノースにβ1-4結合したNアセチルガラクトサミンに、さらにグルコースがα1-4結合した宿主哺乳類にはない側鎖構造を持つ(図2D)21。この構造は免疫原性が高く、感染初期にはフリーGPIに対するIgM抗体が産生される。
Candida albicansの表層に存在する多くのタンパク質がGPIアンカー型であり、総数104種のタンパク質がGPI-APであると実証ないし推定されている。C. albicansのGPI研究は、出芽酵母での研究結果を参考に進められてきており、両者のGPIは基本的によく似ていると言える(図2E)。酵母GPI-APの特徴は、細胞膜にGPI-APとして存在するものと、細胞壁成分として存在するものに分かれる点である4。前者は脂質部分がセラミド型である。後者は脂質部分がジアシル型で合成され、細胞表面へ輸送後、第1マンノースとグルコサミンの間で切断され、細胞壁グルカンに転移される。GPI-APは細胞壁の重要な成分であり、GPI生合成欠損株は、細胞壁欠損の表現型を示す。GPI-APを細胞壁グルカンに転移する酵素は宿主には存在しないので、抗真菌剤の標的候補である。
小胞体でのGPI生合成はGlcNAc-PIが脱アセチル化されてグルコサミン(GlcN)-PIになり、さらにGlcN-PIのイノシトール2位にアシル基(主としてパルミチン酸)が付加されてGlcN-(acyl)PIを生成する。出芽酵母ではGwt1pがイノシトールアシル化酵素で、哺乳動物のPIGWと相同な酵素である4。しかし、真菌類のGwt1pを選択的に阻害する薬剤が抗真菌剤として開発されており、相同酵素であっても種間の差異によって選択性が得られることを示している22。
セラミド型のGPIは真菌GPIの特徴の一つで、酵母類だけでなくアスペルギルス症の原因となるアスペルギルス フミガーツス(Aspergillus fumigatus)などにも存在する。セラミド型GPIは小胞体でジアシル型GPIから変換される脂質リモデリングによってできる。このステップにはCWH43遺伝子が必要であるが、変換反応の詳細は解明されていない4。
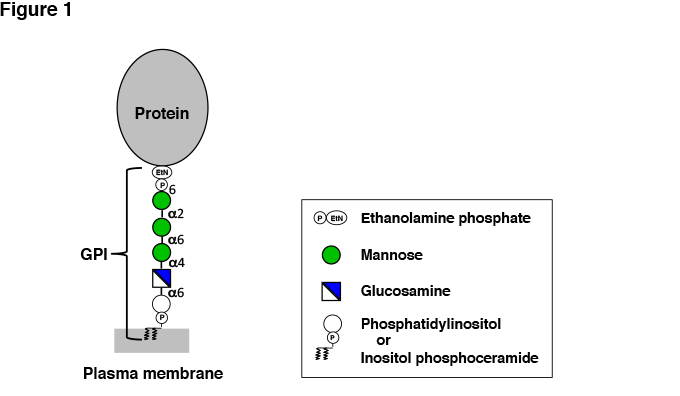
図 1 GPIアンカータンパク質の基本構造。
GPIアンカー部分は、生物種間で保存されている骨格の構造だけを示している。
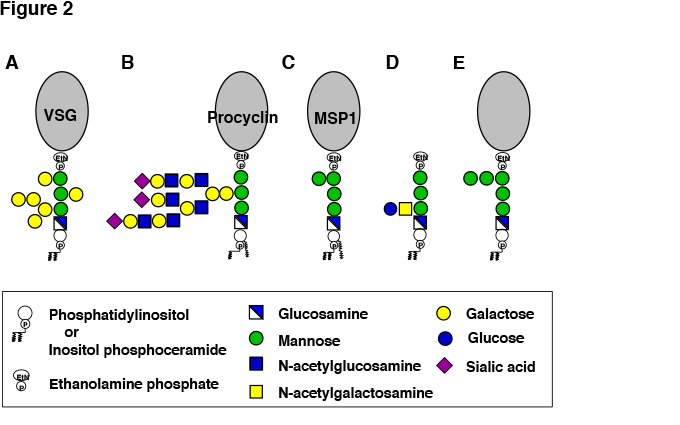
図 2 病原微生物のGPI。
A、血流型睡眠病トリパノソーマのGPI-AP。B、プロサイクリック型睡眠病トリパノソーマのGPI-AP。C、マラリア原虫のGPI-AP。D、トキソプラズマのフリーGPI。E、病原性真菌のGPI-AP。