
氏名:大谷 克城
旭川医科大学医学部微生物学講座 准教授
摂南大学薬学部卒業。神戸大学大学院農学研究科修士課程修了。医学博士。
1993年扶桑薬品工業株式会社研究開発センター研究員。2004年旭川医科大学医学部微生物学講座助手。2013年から現職。1999年にコレクチンCL-L1発見後、3種の新規コレクチンの生体における役割について研究を進めている。ようやくその一端が明らかになりつつある現在、その全貌の解明を目指している。

氏名:若宮 伸隆
旭川医科大学医学部微生物学講座 教授
弘前大学医学部医学科卒業。大阪大学大学院医学研究科博士課程修了。医学博士。
1986年ハーバード大学ダナファーバー癌研究所研究員。1988年大阪大学微生物病研究所助手。2000年より現職。主として、コレクチンが生体防御や生体の恒常性の維持にどのように関与しているのかというテーマを、補体活性化というユニークな機能に着目しながら、その生体における役割を研究している。
1970年代分子生物学の隆盛とともに、細胞性免疫や液性免疫を含む獲得免疫が一時代を築き、その後Toll-like受容体の発見から、自然免疫の重要性が明らかになった。そして現在、多くのレクチン研究が免疫学に新しい息吹を吹き込んでいる。糖鎖と生物学が融合するきっかけとなった最初の研究は、Kawasakiらによるマンナン結合タンパクの発見であろう。本レクチンが多量体構造をもつことで、複合糖質末端糖鎖に複数の結合手で結合し、高い結合力と生物学的特性を示すことが明らかにされ、自然免疫のパターン認識のアイデアが着想された。さらに、近年Dectinなどの膜型レクチンでは、糖鎖結合受容体の細胞内ドメインが、病原微生物に対する応答性を制御して、宿主防御に有効に働くように仕組まれていることが明らかになっている。本稿では、分子内部にコラーゲン様構造を有するレクチン(コレクチン, collectin )の感染防御機能に焦点を当て概説する。
コレクチンは、コラーゲン様構造を分子内部に有するC型レクチンスーパーファミリーの仲間であるが、ヒトではその遺伝子とタンパク質の構造から5つの分泌型コレクチンと1つの膜型コレクチンに分類される1, 2(図1、表1)。
(1) MBL (MBP/MBL, mannan-binding protein or mannan-binding lectin)
(2) SP-A (surfactant protein A)
(3) SP-D (surfactant protein D)
(4) CL-L1 (collectin liver 1)
(5) CL-K1 (collectin kidney 1)
(6) CL-P1 (collectin placenta 1)
コレクチン分子は、生物の進化の観点からみると、脊椎動物の最も古い祖先とされるナメクジウオで66遺伝子出現しているが2, 3、その後魚類で4遺伝子が認められ、陸上動物になって肺呼吸ができるようになると新たに2つの肺コレクチンが出現し、最終的にヒトでは6つのコレクチン遺伝子(COLEC)の存在を認める(図2)。本コレクチンは、補体活性化に関与するMASP(MBL-associated serine protease)結合モチーフが、ほぼすべてのコレクチンのコラーゲン領域のアミノ酸の一次構造で想定されており、本コレクチンは補体関連レクチン(complement-related lectin)と位置付けられている4(図3)。
以下に、コレクチンの発見から遡って主な知見について概説する。1980年代のKawasaki、YamashinaらによるMBL発見後5、その個体レベルの機能は1989年Superらによる、MBL欠損小児の微生物に対する易感染性の報告で初めて明らかにされた6。ここでは、血液に存在するMBLが、微生物に結合してオプソニン分子として働くことで、体内の微生物の総量を減少させて、宿主を守る自然免疫機能に働く仮説が提唱され、コレクチン分子のオプソニン活性が生体防御機能に重要な役割をはたす可能性が示された。このヒトでのMBL欠損症はその後、遺伝学的研究から、MBL遺伝子の一塩基多型(SNP)に由来するアミノ酸変異やプロモーター領域のSNPsが関与することが明らかになった7(図4)。一方、肺コレクチンSP-AとSP-Dは1985年以降に独立して発見されたが8, 9、当時肺コレクチン遺伝子は同定されておらず、MBLと同じコレクチン遺伝子ファミリーを形成するとは理解されなかった。最初のコレクチン発見から約20年後、1999年からOhtaniらの逆遺伝子手法により3つのコレクチン遺伝子群が同定され、コレクチン遺伝子ファミリーの全貌が明らかになった10-12。これらのコレクチンは、組織での分布がそれぞれのコレクチンによって大きく異なることに特徴がある。MBLは、主に肝実質細胞で産生され、血中に分泌タンパク質として存在する。肺コレクチンSP-AとSP-Dは、肺胞タイプII上皮や気管支上皮、腸上皮などから肺胞・気管上皮や腸粘膜に分泌され、肺サーファクタントタンパク質として主に存在する。しかしながら、新しく発見された3つのコレクチンは、非常にユニークな分布をとる。CL-P1は、胎盤cDNAライブラリーから発見されたが、のちに全身の血管組織に主に発現することが明らかになった13。一方、CL-L1 は、当初肝臓cDNAライブラリーから遺伝子がクローニングされ、細胞質存在型タンパク質として報告されたが、のちに分泌タンパクであることが明らかになり、さらにCL-K1とヒト血中ではヘテロダイマー構造をとることが明らかになっている10, 14。現在、このCL-L1とCL-K1は全身の臓器で発現することが明らかになっているが、血中分子は主に肝臓から分泌されることが想定されている15。このCL-L1とCL-K1のハイブリット分子は、HansenらによりCL-LKと名付けられているが、本分子がどの過程でヘテロダイマー構造になるのか、またその生体での役割については現在のところ不明である14。
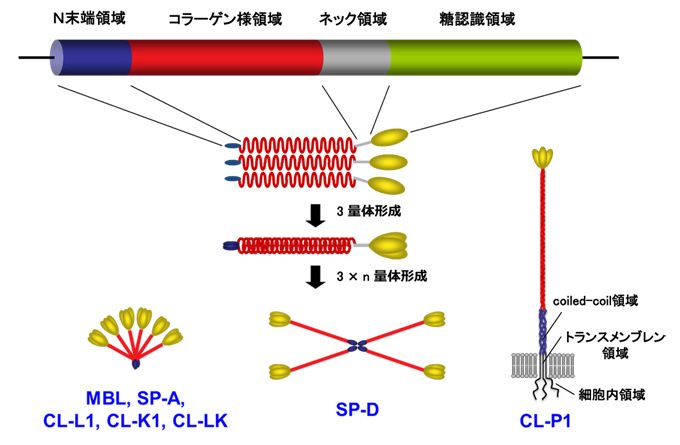
図 1 コレクチンの分子構造
表 1 コレクチンの特徴
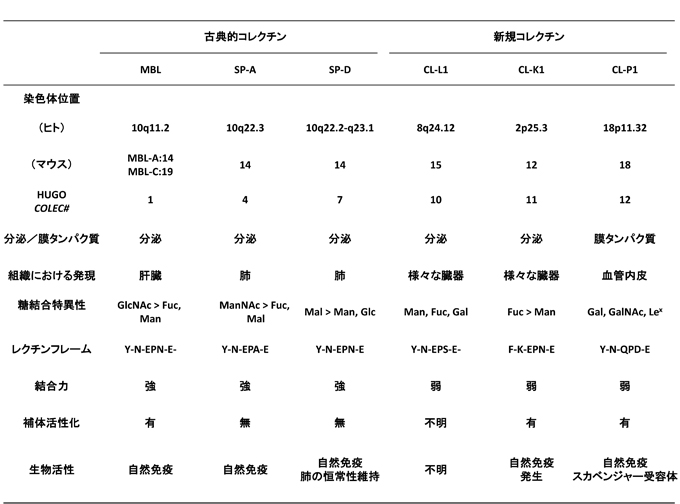

図 2 コレクチンとC1qの遺伝子進化の概略

図 3 補体活性化に関与するコラーゲン様領域のMASP結合モチーフ4
X = 任意のアミノ酸、‘:’ 完全保存されたアミノ酸、‘.’ 高度に保存されたアミノ酸
Gly-X-Yトリプレット中の3番目の位置のプロリンはヒドロキシプロリンである可能性が高い。コラーゲン様領域の予想されるMASP結合モチーフは青色で表示。結合に関与する残基は太字で示され、かつ不可欠なリジン(MBL55)は、アスタリスクで表示。
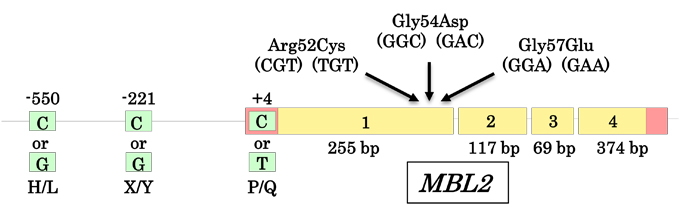
図 4 MBLのSNPs
コレクチンの微生物における生体防御機能は、MBLの欠損症と種々の微生物感染についての分子生物学的研究と疫学的研究から明らかになっている。グラム陰性菌では、MBLは細菌表面のリポ多糖(LPS)上の糖鎖構造を認識すると考えられている。実際にサルモネラ菌とMBLを用いた研究によると、MBLとの結合はsmooth型LPSを持つ菌株に対しては見られないがO抗原を欠いたrough型LPSに対しては見られるとの報告がある16。また、 MBLは淋菌LPSに結合するが、この糖鎖にシアル酸が付加されると結合が著しく低下することも報告されている17。さらにこれらの菌の変異体あるいは糖鎖関連遺伝子ノックアウト株を用いた詳細な研究によりMBLの結合部位がLPSのコア領域であることが明らかとなっている。一方、グラム陽性菌の結合リガンドはリポマンナン又はグルコース置換型のリポテイコ酸であることが報告されている18。グラム陰性、陽性どちらの細菌においても莢膜を有する菌株に比べて莢膜を持たないものに対するMBLの結合が高い傾向を示している。MBLは、これらの細菌に結合してオプソニン分子として働き、その後貪食細胞と協力して体内の細菌数を減少させると考えられる。これらの細菌とは性質を異にする結核菌が属する抗酸菌では、細菌表面にはリポアラビノマンナン(LAM)とアラビノガラクタン(AG)と呼ばれる多糖構造およびフェノール性糖脂質(PGL)、 コードファクター(Trehalose-dimycolate, TDM)と呼ばれる長鎖脂肪酸と糖の複合体が存在する。MBLはこれらのうちLAM構造に強く結合する。LAMのうちでもマンノースキャップLAM(Man LAM)と末端のマンノースを欠いたLAM(AraLAM)では、病原性の強い菌に見られるMan LAMのほうにより強く結合することが報告されている19。また、多様な病原細菌に対してMBLと補体が菌体上に沈着する現象が観察され20 glycosyltransferase遺伝子を欠損したブルセラ菌に対してMBLが補体系を活性化させ、殺菌的に働くことも報告されている21。一方、抗酸菌感染においてコレクチンは感染防御ではなくむしろ感染の助長に働いている可能性も報告されている。つまり、結核性髄膜炎に罹患していないグループは、罹患したグループに比べて54番目のアミノ酸のグリシンがグルタミンに変化するMBLの変異を持ち、MBLの血中濃度が低い傾向が認められた22。MBLの54番目のアミノ酸変異はMBLの血中濃度を大きく下げることが判明しており、MBLの生体内濃度が低いグループが結核性髄膜炎に罹患しにくいことが示唆された。コレクチンは細菌感染症において感染防御と感染助長の二面性を持っていると考えられる。
ウイルスは、細菌よりも小型の微生物に位置されるが、自立増殖ができず宿主の細胞質内に侵入して自己のウイルス遺伝子を複製することによって増殖する。このウイルス感染とコレクチンの関わりに関しては、多岐のウイルスにわたって報告されているが、ここではインフルエンザAウイルスを例に解説する。1970年頃には、インフルエンザウイルスについては赤血球凝集阻止(HI)活性を担う物質として、血液中に存在するα、β、γの3種の内因性インヒビターの存在が知られていた。AndersらやWakamiyaらは、このβインヒビターの本体がコレクチンであることを明らかにした23, 24。その後、Kaseらの研究により、MBLは、インフルエンザウイルスの2つのエンベロープタンパク質であるヘマグルチニン(HA)とノイラミニダーゼ(NA)の糖鎖に結合することによって、感染抑制作用をもつことが明らかにされていた25。さらにMBLは、直接的な中和作用以外にも、オプソニン分子としてインフルエンザウイルスに結合し、好中球やマクロファージに対してウイルスの貪食を誘導してウイルス消去する機構も明らかになっている26(図5)。
一方、肺コレクチンSP-Dでも、MBLと同じメカニズムで抗インフルエンザ作用のあることが報告されている27。また、MBL やSP-Dは、インフルエンザAウイルス亜型H1N1とH3N2に対して中和活性を有することが明らかになっているが、それは、これらの亜型HAにはhigh mannose型、hybrid型の糖鎖修飾が複数あるために、コレクチンとウイルスの結合性が高く、ウイルスの細胞へのattachmentを強力に阻害すること、さらに亜型H2N2にはこれらの糖鎖修飾がほとんどないために、コレクチンへの結合性が低い事実と良く合致する25, 28。さらに、KaseとKawaiらは、MBLがNAに結合することによって、ウイルス粒子のbudding阻害による中和活性をもつことを明らかにしている29。一方NAへの結合能をもたないSP-Dは、budding阻害による中和活性を示さない。さらに、Kaseらの疫学的な調査では、1990〜1995年のインフルエンザウイルス亜型H3N2新鮮分離株67株において、MBLの感染中和活性値としてHI活性濃度(0.31±0.67μg/ml)を報告しているが、その中和値はヒトMBL血中濃度1-2μg/mlよりも低く、新鮮分離株がMBLに対して感受性があることを示している。しかしながら、HI活性濃度が2.5μg/ml以上の新鮮分離株も2%程度認められることより、少数のコレクチン耐性のインフルエンザウイルスが、季節性インフルエンザウイルスの中に存在する可能性を示している25。2009年は、亜型H1N1のインフルエンザウイルス (A/H1N1/pdm) が猛威を振るい、世界中で16,000人以上の人が亡くなったとWHOから報告されている。このA/H1N1/pdm株は、過去50年流行したことがなく、ほとんどの人が抗体を保有しないために、大流行を起こしたと考えられている。このように獲得免疫が効果を示さないインフルエンザウイルス株が出現した場合には、通常は自然免疫が抵抗性に寄与すると考えられるが、このウイルス株は、MBLやSP-Dなどのコレクチンに対する感受性を喪失していたことが報告されている28。現在流行している、季節性インフルエンザウイルスH1N1はHA内部に3〜5個のhigh mannose型やhybrid型糖鎖をもつが、A/H1N1/pdmウイルスはHA に1個の糖鎖しか無くHAの糖鎖が減少した為に、コレクチンがHAに結合できなくなり、中和抗体の機能を果たせなくなったことを示唆している28。つまり2009年当時出現したインフルエンザウイルス(A/H1N1/pdm)に対して、世界中の人々が獲得免疫(抗体による免疫記憶)と自然免疫(コレクチン)を発揮できず、そのため世界中で本ウイルスの大流行が起こったのではないかと推測されている。
細菌、ウイルスに比べてカビ、原虫、寄生虫等の真核生物の病原体に対するコレクチンの感染制御に関する報告はそれほど多くない。とくにマラリアにおいてはMBLの血中濃度およびMBL遺伝子のSNPによる 54、57番目のアミノ酸置換と病状の重篤さに相関性のあることが報告されている30。その他、肺炎を起こすアスペルギルス31、下痢を起こすクリプトスポリジウム等による感染の防御にコレクチンが重要な役割を果たしている可能性を示す報告も発表されている32。
このように生命を脅かす可能性の高い重篤な微生物感染症では、微生物の総数を減少させることが宿主の最優先事項であり、コレクチンではこのオプソニン活性による微生物の消去システムが原始的であるが、まず一番目に着実に機能する。その際に、コレクチンのオプソニン活性だけでは間に合わない場合に、同時に補体系を活性化させる仕組みが生命予後保護のために体内に仕込まれている。つまり、コレクチンでは、単なる微生物の感染中和やオプソニン化による貪食誘導だけでなく同時にレクチン経路などを使って補体活性化を惹起する能力が備わっている(図6)。この補体活性化が時に高いレベルで起こると、その場での微生物の排除だけでなく、局所や全身に過度の炎症を起こし、組織傷害や宿主に大きなダメージを及ぼす分子メカニズムが考えられている。Lingらによるインフルエンザウイルスを用いたマウス感染実験における報告では、A/H1N1/pdmとAvian H9N2において、MBLは両ウイルスに結合活性はあるが、ウイルス肺感染による肺損傷には効果のないことが示されている33。ここでは、MBL野生型マウスのほうが、MBL KO(knock out)マウスよりも、肺の組織損傷の強いことが示されている。このMBL野生型マウスはKOマウスと比較して、インフルエンザウイルス感染によるサイトカイン産生が著しく高く、炎症性サイトカインによる全身状態の悪化、体重減少、重篤な組織傷害の可能性が示唆されている。
一方、移植時におけるMBLの機能についても、上記の補体活性化という観点で注目すべき報告がされている。現在、世界で肺移植は毎年2,000例以上施行されており、末期肺疾患の一般的な治療となっている。肺移植後の生存に関しては、移植後1年間が最も重要で、外科的処置と免疫抑制剤の進歩が、生存率を著しく上昇させてきた。移植後初期には、虚血-再灌流症候群、急性拒絶反応、細菌感染などによる肺機能不全が起こり、移植後3か月後からは、閉塞性細気管支炎症候群(BOS)や慢性拒絶反応とともに、真菌やウイルス、マイコバクテリウムによる感染症が問題となる。Munsterらは、MBLの濃度を規定するプロモーター領域、コラーゲン様領域のSNPsと肺移植生着、肺移植後BOS発症についての相関性を解析した34。肺移植において、X-対立遺伝子をもつドナーの肺を提供された患者のみが、移植片生着と肺移植後BOSについて良い予後を示した。ここでは、血中MBL量を規定するレシピエントのMBL遺伝子型が移植結果と全く相関性を認めず、移植されたドナー肺が産生するMBL量が少ないほうが、移植の予後を決定する因子である肺組織の傷害と炎症を抑制する可能性を示唆している34。つまり、移植された肺組織において、MBLの補体活性化機能が、肺移植片にとって有益でない可能性が考えられている。同様に、腎移植の際にも、ドナーのMBL低値が移植にとって有益であるデータがマウスモデルやヒトの疫学的調査で明らかになっている35。しかしながら、肝臓移植や心臓移植においては、低MBL患者は重篤な感染症や移植後冠動脈疾患による急性拒絶へ進展しやすく、MBL低値により、逆に不利な影響を及ぼす可能性も報告されている36, 37。一般にコレクチンは、病原体や微生物に対して自然免疫作用では感染防御に働いて生体を元の健常な状態へ導こうとするが、特殊な状況下で補体活性化が過剰に誘導されると、逆にその反応が組織や宿主に著しい損害を与え、却って危険因子になる可能性があると推測される。
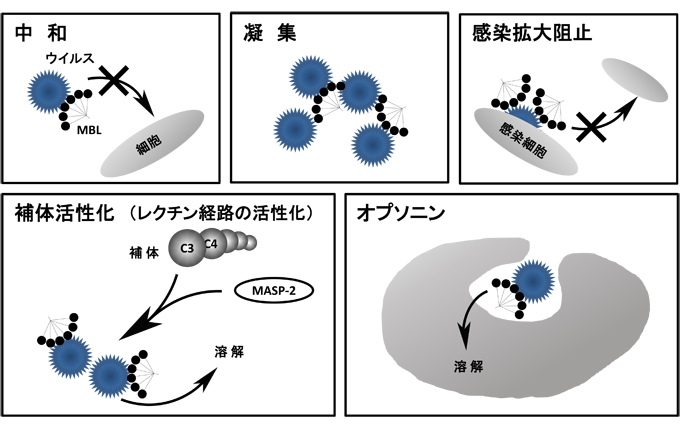
図 5 コレクチンの多様なウイルス感染制御作用
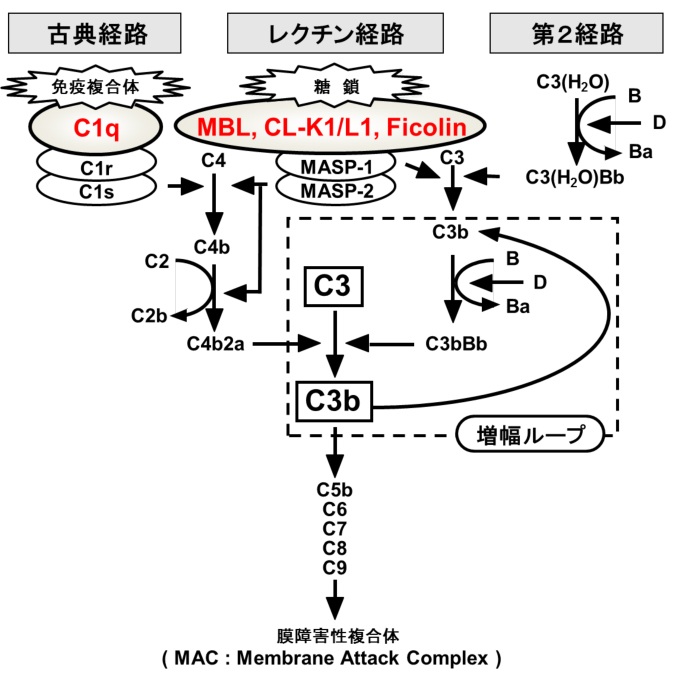
図 6 補体活性化経路
CL-P1は、コレクチングループの中では唯一の膜タンパク質で、FukudaらはゼブラフィッシュCL-P1遺伝子をクローニングし、個体レベルでのCL-P1の機能について検討を行った38。ゼブラフィッシュCL-P1は、マウスやヒトの組織発現と同様、成魚では主に血管組織に存在する。次にモルフォリノオリゴヌクレオチド(morpholino oligonucleotide)を用いたCL-P1遺伝子ノックダウンゼブラフィッシュ胚では、背部大動脈、体節血管の欠損、心嚢浮腫を伴う、体幹形成の著しい異常形質が観察され、CL-P1発現が魚類胚の形態形成に関与する可能性が明らかにされている38。さらに、CL-P1遺伝子ノックダウン胚では、血管内皮増殖因子(VEGF)mRNA低下が観察され、VEGF mRNAの同時投与による形態異常の回復が見られることで、CL-P1分子が初期発生において血管構築に何らかの重要な役割を果たし、その経路には、CL-P1が関与する経路とVEGFを介する経路があることが示唆されている。
一方CL-K1については、Rooryckらにより、3MC(Carnevale, Mingarelli, Malpuech, and Michels syndromes)症候群と呼ばれる常染色体劣性遺伝病における研究で、本疾患がCL-K1もしくはMASP-3(MBL associated serine protease-3)のどちらかの遺伝子異常で起こる研究結果が報告された39(図7)。3MC症候群は全身の様々な形態異常(両眼隔離、眼裂狭小、眼瞼下垂、頭蓋骨癒合症、口蓋裂、精神遅滞、性器形成不全等)を特徴とする症候群である。患者の多くは血族結婚によりおこり、本遺伝子疾患の出現頻度は極めて低いが、コレクチンCL-K1とMASP3から発動される補体活性化そのものが、ヒトの全身の形態形成に重要な関与をする可能性を示している。本疾患において、CL-K1遺伝子異常による血中CL-K1の欠損が確認されている。CL-K1分子の多くは血液中でCL-LKとして存在するので本症例ではCL-LKが存在しないと考えられる。しかしながら、本疾患においてCL-L1自身の遺伝子異常の報告はなく、現時点で、胎児の形態形成時にCL-LKが関与するのか、CL-K1が単独でMASP3タンパク質と結合して関与するのかは不明である。また、CL-K1について、Takahashiらは、アメリカ人の播種性血管内血液凝固(DIC)患者で、有意なCL-K1上昇を見出している40。DICは、多臓器機能障害と高い死亡率を示す非常に重篤な疾患であり、早期の治療が重要だが現在のところ有用なバイオマーカーが存在しない。本報告は、血中CL-K1濃度とDICの間の関係を示した初めての報告であるが、このメカニズム等については不明であり、さらなる研究が必要であると考えられる。このように新規発見された3つのコレクチンCL-P1、CL-K1、CL-L1については、従来の微生物に対する感染防御や生体防御機構とは異なる、補体系、凝固線溶系などがリンクした複雑系のようなシステムのなかでの役割が考えられており、組織の恒常性維持に重要な機能を果たしていることが推測されている。
コレクチンの中では、肺コレクチンであるSP-AとSP-Dは、補体系を活性化しない例外的な非補体活性化コレクチンである。肺は、常に外界にさらされているので、ここで過度の免疫反応が起こると、肺全体に大きなダメージを与えて呼吸不全に陥るので、あえて補体活性化能を喪失させて、直接的なオプソニンや中和作用がメインに働くように、機能を限定させた可能性が考えられる。しかしながら、これら以外の補体関連レクチンは、局所において補体活性化が常に一義的に働くことにセットされているように思える。膜型コレクチンCL-P1もその例外でなく、仮想的であるが分泌型CL-P1が直接微生物表面に結合して代替経路を活性化すること41やごく最近RoyらによりCL-P1が細胞膜表面で急性炎症タンパクであるCRPをトラップして古典経路を起動させて増幅経路をも活性化する新たな補体活性化経路を明らかにしている42。従来スカベンジャー受容体の機能が注目されていたCL-P1が、やはり補体系に関与していることが明らかになり、コレクチンと補体系がさらに複雑に絡み合っている可能性が示唆されている(図8)。ようやくコレクチン研究が、補体関連レクチンとして、生体での真の役割解明に向かい始めている。
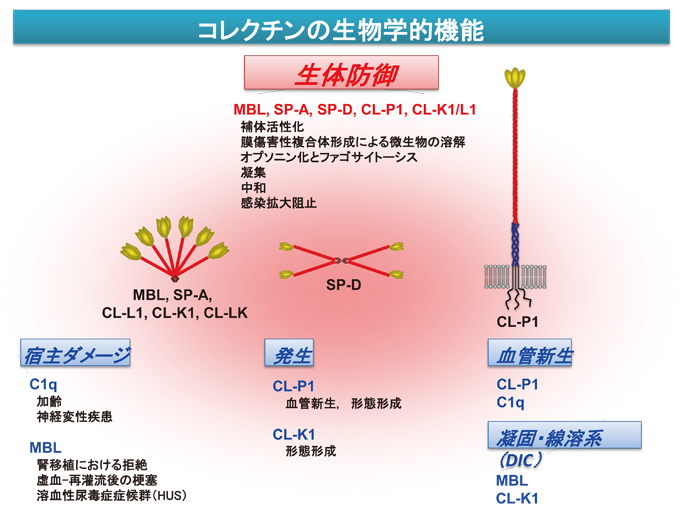
図 8 コレクチンの生物学的機能
謝辞
本研究は、大阪大学微生物病研究所、大阪府立公衆衛生研究所、および旭川医科大学で行ったもので、本研究に参加していただいた、多くの関係諸氏に感謝いたします。また、糖鎖生物学の研究にお導きいただき、ご指導を賜りました、故 加藤四郎先生、故 内貴正治先生、故 山科郁男先生に、深く感謝いたします。