
氏名:渡邊 洋平
京都府立医科大学 大学院医学研究科 感染病態学 講師
大阪大学大学院医学系研究科博士課程修了(2007)。医学博士。大阪大学微生物病研究所ウイルス免疫分野特任研究員(2006−2011)、同所附属難治感染症対策研究センター助教(2011−2014)、京都府立医科大学大学院医学研究科学内講師(2015)を経て、2015年10月より京都府立医科大学大学院医学研究科感染病態学講師を務める。主として、新興感染症ウイルスの宿主適応機構について研究を推進している。
鳥インフルエンザウイルス感染症は、H5N1亜型高病原性鳥インフルエンザウイルスが1997年にヒトに感染して以来、発生地域において深刻な社会問題となっている。近年では、H5亜型以外の鳥インフルエンザウイルス感染事例が相次いでヒトで報告されており、鳥インフルエンザ感染症は継続的な監視が必要な新興感染症である。これまでのヒト感染事例のほとんどが鳥−ヒト間の偶発的なウイルス伝播が原因であり、ウイルスは未だ十分なヒト適応性を獲得していない。一方で、繰り返されるウイルス伝播過程で、インフルエンザウイルスが遺伝子変異やリアソータントによって宿主適応性を獲得する可能性がある。インフルエンザウイルスの宿主適応機構は、未だその詳細が不明な点が多い。本稿では、H5N1亜型高病原性鳥インフルエンザウイルスを中心に、ウイルスの宿主細胞への吸着・侵入過程に与るHemagglutinin(HA)と受容体であるシアロ糖鎖との相互作用に焦点を当て、インフルエンザウイルスのヒト適応機構と迅速診断法について筆者らの知見を含めた最新の知見を紹介する。
インフルエンザAウイルスは、ウイルス粒子のスパイク蛋白質であるHAとNeuraminidase (NA)の抗原性によって亜型に分類される。現在までに18 HA亜型と11 NA亜型が確認されている。HAは主にGroup 1(H1, H2, H5, H6, H8, H9, H11, H12, H13, H16, H17, H18)とGroup2(H3, H4, H7, H10, H14, H15)に分類される1-3。ほとんどのインフルエンザウイルスは、水生野鳥を自然宿主する鳥インフルエンザウイルスを起源とし、宿主適応性を獲得することでヒトを含む新たな宿主に伝播・定着する4。
ユーラシア・アフリカ大陸において現在蔓延しているH5N1亜型高病原性鳥インフルエンザウイルス(以下、H5N1ウイルス)は、1996年頃に中国で出現した2 H5N1ウイルスは、2003年に東南アジア地域、2006年にヨーロッパ・アフリカ地域に感染拡大し、現在までに、中国、インドネシア、ベトナム、エジプトにおいて、鳥類において流行を繰り返す感染流行域を獲得している5。当該地域では、感染鳥との濃厚接触によるヒト感染事例が継続的に報告されている。現在までに、累計で844人が感染し、死亡率は53%である(WHOによる2015年11月13日の報告)。H5N1ウイルス感染者は、これまで東南アジアを中心に報告されていたが、2009年以降、特にエジプトにおいて感染者数が急増しており、国別の累計感染者数が最多となった。異なる地域におけるH5N1ウイルス定着化は、ウイルス系統発生の多様化を誘発し、現在までにclade 0−9に属するウイルスが分類されている。これらの遺伝的な多様化に伴い、抗原性や感染性などのウイルス性状が異なる様々なウイルスが出現している2。
加えて、2013年に中国で出現したH7N9亜型鳥インフルエンザウイルスは、これまでに累計440人のヒト感染事例(致死率=27%)を引き起こし(WHOによる2014年5月16日の報告)、世界的に重大な懸案事項となった6。さらに、H5N6、H6N1、H9N2、H10N8亜型鳥インフルエンザウイルスのヒト感染事例がそれぞれ中国(2014年)、台湾(2013 年)、香港(1992年)、中国(2013)において初めて報告された1, 2)。H7N2(2003年)、H7N7(2003年)およびH7N3(2004年)亜型鳥インフルエンザウイルスのヒト感染事例も報告されている状況にある。
インフルエンザウイルスは細胞表面に発現するシアロ糖鎖を受容体とし、HAとシアロ糖鎖の結合を介して細胞表面に吸着する7。シアロ糖鎖は、生体内において主にシアロ糖鎖含有糖蛋白質(N-グリカン、O-グリカン)やスフィンゴ糖脂質などの複合糖質として発現される。シアル酸の種類は自然界で50以上確認されており、一般にN-グリカンやO-グリカンの末端に存在する7)。中でもN-アセチルノイラミン酸(Neu5Ac)とN-グリコリルノイラミン酸(Neu5Gc)がHA結合に重要である(Fig. 1A-I)。インフルエンザウイルスが結合するシアロ糖鎖の最小単位は、シアロ糖鎖末端配列として一般的なNeu5Acα2,3(6)Galβ1-4GlcNAcである7)。インフルエンザウイルスは、特にNeu5Acα2,3(6)Galβ結合様式を識別して結合する(Fig. 1A-II)。
季節性インフルエンザウイルスはNeu5Acα2,6Galをもつ糖鎖(α2,6 Sia)に優先的に結合するのに対し、鳥インフルエンザウイルスはNeu5Acα2,3Galをもつ糖鎖(α2,3 Sia)に優先的に結合する1, 2, 7。このシアロ糖鎖結合親和性の相違は、両ウイルスの標的臓器特異性を規定する。すなわち、ヒト上部呼吸器上皮にはα2,6 Siaが豊富に発現するのに対し、鳥腸管上皮にはα2,3 Siaが豊富に発現する(Fig. 1A-V)。このことは、種の壁として作用する。α2,3 Sia結合特異性からα2,6 Sia結合特異性への変化は、鳥インフルエンザウイルスのヒト適応性獲得の第一段階として重要である8。1918年のスペイン風邪(H1N1)、1957年のアジア風邪(H2N2)、1968年のホンコン風邪(H3N2)、2009年のH1N1pdmを引き起こしたパンデミックウイルスは、全てヒト以外の動物種を由来とするにも関わらずα2,6 Sia特異性を獲得していた。また、過去のパンデミック発生初期に、α2,3 Siaおよびα2,6 Siaのどちらにも結合する両親和性ウイルスが出現していた9。これまでに野外で検出された多くのHA変異は、H5N1ウイルスのシアロ糖鎖特異性を鳥型からヒト型に部分的にしか変化させなかった10-12。一方で、人工的に変異ウイルスを作出した最近の研究において、幾つかの変異がH5N1ウイルスのシアロ糖鎖特異性を完全に置換させた13-16。
ブタ呼吸器上皮と同様に、鶏やウズラなどの陸生家禽の呼吸器上皮にはα2,3 Siaとα2,6 Siaの両方が発現している17, 18。当該種において、鳥インフルエンザウイルス感染が繰り返されることで、鳥からヒトへの適応性変異が導入される可能性がある。これまでに、H5N1ウイルス流行地域であるエジプトにおいて、継続的なウイルスの鳥類間伝播の過程で両親和性H5N1ウイルス群が出現した報告されている11。また、同じくH5N1ウイルス流行地域であるインドネシアにおいて、ブタから両親和性H5N1ウイルスが孤発性に分離された10。H7亜型鳥インフルエンザウイルスにおいては、2002−2004年に北米東北部の陸生家禽で流行したH7N2亜型ウイルス群が両親和性を獲得していた19。
ヒト生体内では、下部呼吸器上皮においてα2,6 Siaとα2,3 Siaの両方が発現している20。これらのシアロ糖鎖の発現分布は、α2,3 Sia指向性の鳥インフルエンザウイルスが濃厚接触によって下部呼吸器に感染し、ヒトに重度の肺炎や呼吸器障害を引き起こす1つの要因となっている。一方で、ヒト呼吸器上皮におけるα2,6 Siaおよびα2,3 Siaの発現動態は、疾患、炎症や年齢によって変動する2。そのため、鳥インフルエンザウイルスがヒト呼吸器に感染する潜在性はこれまで推定されてきた以上に高いと推定されている。H5N1ウイルス感染患者の臨床サンプルを遺伝子解析したタイの研究において、感染患者体内で能動的に選択された多様なHA遺伝子変異が検出されている21。また、ベトナムにおいて、感染患者由来H5N1ウイルス株が両親和性を獲得していた12。さらに、2003年に北米東北部のH7N3亜型ウイルス感染患者から、シアロ糖鎖特異性が鳥型からヒト型に部分的に置換したウイルス株が分離されている19。これらの知見は、鳥インフルエンザウイルスが、感染染患者体内においてα2,6 Sia結合親和性を獲得する可能性を示している。
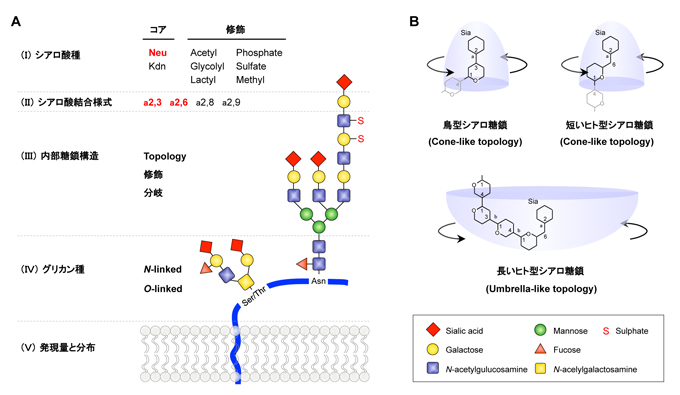
Fig. 1 インフルエンザウイルスが認識するシアロ糖鎖構造の複雑性
(A)生体に発現するシアロ糖鎖構造。インフルエンザウイルスは、末端のシアル酸(I)とガラクトースの結合様式(II)に加えて、内部糖鎖構造の修飾、分岐やtopologyを認識していることが分かりつつある(III) 。また、ウイルスの感染性は、シアロ糖鎖が発現するグリカン種(IV)および発現レベルと分布(V)に大きく影響を受ける。(B)鳥インフルエンザウイルスのHAがヒト適応性を獲得するために必要なシアロ糖鎖構造モデル。ヒト上部呼吸器上皮への結合性を獲得するためには、優勢に発現する長いヒト型シアロ糖鎖に特徴的なumbrella-like topologyを認識する必要があると推定されている。(Watanabe et al., Trends Microbiol 2012 より一部改変)
鳥インフルエンザウイルスが感染患者体内で獲得するヒト適応機構の詳細はこれまで不明であった。そこで筆者らは、データベースに蓄積されたウイルス遺伝子配列を用いて、エジプトで蔓延するH5N1ウイルスが感染患者体内で獲得したHA遺伝子変異を網羅的に探索し、変異ウイルスが獲得するウイルス性状を解析した22。その結果、ほとんどのHA変異がα2,6 Sia親和性を高める効果を示した。変異ウイルスのシアロ糖鎖結合特異性を算出すると、季節性インフルエンザウイルスと比較すると部分的であるが、一部においてシアロ糖鎖結合が鳥型からヒト型に部分的に置換していた(Fig. 2A−C vs D−F)。Lactosamine(LN: Galβ1,4GlcNAc) repeat数が異なるsialylglycopolymerを用いたsolid-phase receptor binding assayによって、変異がシアロ糖鎖結合親和性に与える効果を解析すると、その効果はより長いα2,6 Sialylglycanに対して顕著であった(α2,6 SLN1<α2,6 SLN2<α2,6 SLN3)(Fig. 2D−F)。一方で、変異が長さの異なるα2,3 Sia親和性に与える影響は僅かであった(α2,3 SLN1= α2,3 SLN2= α2,3 SLN3)。ヒト呼吸器上皮には、末端2糖の結合様式(Neu5Acα2,3(6)Galβ)以外に、分岐、長さや修飾が異なる多様なシアロ糖鎖が発現しており、特に2つ以上のLN repeatの分岐構造をもつ長いシアロ糖鎖が優勢に存在することが最近明らかとなった23, 24。また、シアロ糖鎖−HA共結晶解析により、鳥インフルエンザウイルスのHAがヒト上部呼吸器に発現するα2,6 Siaに結合する適応性を獲得するためには、Neu5Acα2,6Galの認識に加えて、長いα2,6 sialylglycanに特徴的な“umbrella-like” topologyを認識する変化が必要であると予測されている23 (Fig. 1B)。対照的に、α2,3 sialylglycanまたは短いα2,6 sialylglycanとの結合には、両糖鎖に共通する“cone-like” topologyの認識が必要である。これらの知見は、H5N1ウイルスが、ヒト生体内において、より長いα2,6 sialylglycanに対する特異性を高めるにように急速に変化することを示唆している。さらにインフルエンザウイルスが、Sia linkageやLN repeatに加えて、フコシル化などの修飾基を認識すると最近報告されている25, 26 (Fig. 1A-III)。α2,3 Sia指向性のH5N1ウイルスがex vivo培養したヒト鼻咽頭組織(上部呼吸器)にも感染するとも報告されている。これらの知見は、インフルエンザウイルスが、生体内で発現するより複雑なシアロ糖鎖構造を認識する可能性を示している。
一方で、筆者らの解析において、感染患者体内で選択されたHA変異ウイルス群を初代ヒト呼吸器上皮細胞に感染させると、効率的に増殖したウイルスは僅かであった22。このことは、ヒト呼吸器におけるH5N1ウイルス増殖性がα2,6 Sia特異性のみで規定されないことを示唆する。HAの主な機能は、シアロ糖鎖との結合を介した標的細胞への吸着とウイルス膜−細胞膜間の融合である4。細胞表面に吸着したウイルスは、エンドゾームによって取り込まれ、後期エンドゾームにおいてlate endosomal pH値が閾値以下に低下することで、HA構造変化が誘導されて膜融合が起こる。そこで筆者らは、当該HA変異が膜融合を起こすpH閾値に与える影響を解析した。その結果、ヒト呼吸器上皮細胞で効率的に増殖する変異ウイルスは、α2,6 Sia結合親和性を獲得すると同時に、膜融合を起こすpH閾値を高く変化させていた22。HA膜融合を起こすpH閾値がインフルエンザウイルスの亜型やウイルス株間で異なることが古くから知られている27。また、鳥インフルエンザウイルス間で異なる膜融合活性がウイルス感染性と関連すると報告されている28。一方で、宿主細胞のendosomal pH値は細胞ごとに異なり、細胞種によってはlate endosomal pH値がHA構造変化を誘起する程に低下しない29。また、ヒト呼吸器上皮細胞のlate endosomal pH値は比較的高く、H5亜型ウイルスの膜融合にとって必ずしも至適環境にないと指摘されている30。これらの知見は、H5N1ウイルスがヒト呼吸器上皮で効率的に増殖するためには、α2,6 Sia結合親和性の獲得と同時に、より僅かなpH変化で膜融合を引き起こすHA構造の不安定性を獲得する必要があることを示唆する。
感染患者体内で選択されたHA変異のほとんどがα2,6 Sia特異性を高めたのに対し、膜融合を起こすpH閾値を高めた変異数は限定的であった。すなわち、pH閾値変化は、α2,6 Sia結合親和性を獲得するために選択されたアミノ酸置換が、HA構造安定性に与える付随的な効果を反映している。これらの結果は、H5N1ウイルスが、ヒト生体内において、α2,6 Sia結合親和性を高める選択圧を一義的に受けることを示している。H5N1ウイルスは、感染患者体内において、α2,6 Sia結合親和性を高める適応性を獲得することを契機に、より僅かなendosomal pH値低下によって膜融合する特性を同時に獲得することで、合理的にヒト適応すると考えられる。興味深いことに、シアロ糖鎖特異性と膜融合を起こすpH閾値の同時変化は、飛沫伝播するH5N1ウイルスを作出する研究において、フェレットへの適応過程でも確認されている15, 16。一方で、H5N1ウイルスが飛沫伝播能を獲得するためには、HA構造を相補的に安定化させる変異が付加される必要があると報告されている8。感染患者体内においてHA構造を安定化させる変異が付加されうるのか、より詳細なウイルスのヒト適応機構の解明が緊要である。
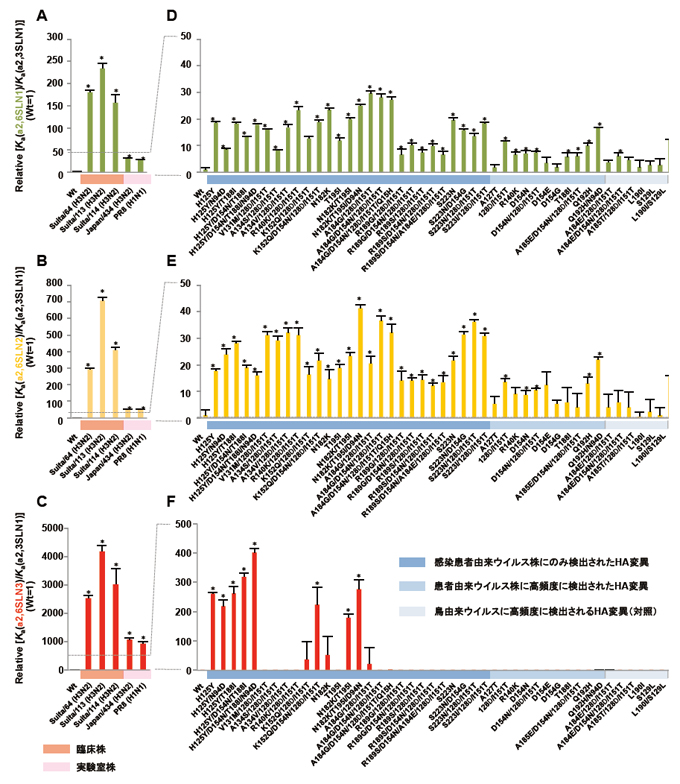
Fig. 2 感染患者において選択されたHA変異がシアロ糖鎖結合特異性に与える影響
インフルエンザウイルスのシアロ糖鎖に対する結合定数(Ka)をsolid-phase receptor binding assayデータを非線形回帰フィッティングすることで算出した。短いヒト型糖鎖であるa2,6 SLN1(A、D)および長いヒト型糖鎖に分類されるa2,6 SLN2(B、E)とa2,6 SLN3(C、F)に対する結合特異性をそれぞれ Ka(a2,6 SLN1)/Ka(a2,3 SLN1)、 Ka(a2,6 SLN2)/Ka(a2,3 SLN1)およびKa(a2,6 SLN3)/Ka(a2,3 SLN1)として示した。結果は、独立した3回の試験結果の平均±標準偏差であり、wild-type (Wt)に対する相対値である。(A、B、C)季節性インフルエンザウイルスの結合特異性。(D、E、F)HA変異ウイルスの結合特異性。*P < 0.01 (Student’s t test)。(Watanabe et al., MBio 2015より一部改変)
近年の遺伝子解析技術の進展は、ウイルス性状を遺伝子配列から予測することを容易にした。しかしながら、インフルエンザウイルスの変異を繰り返す特性を鑑みると、ウイルスの特性を直接的に評価することは防疫上重要である。鳥インフルエンザウイルスのサーベイランスにおける重点項目の1つは、ウイルスのシアロ糖鎖特異性の評価である。野外で伝播する鳥インフルエンザウイルスの中から、シアロ糖鎖特異性を変化させた変異ウイルスの出現を迅速に検知することは、的確なパンデミック対応を開始するために極めて重要である。これまでに、solid-phase receptor binding assay10-12, 15, 21, 22やglycan micro assay31などのシアロ糖鎖結合親和性測定法が開発され、それぞれウイルスのシアロ糖鎖結合親和性の定量性解析やハイスループット解析を飛躍的に向上させた。最近では、表面プラズモン共鳴や導波モードセンサーを用いたウイルスのシアロ糖鎖結合親和性の評価法が開発されている32。しかしながら、これらの測定方法は、熟練した解析手技と高額な解析機器を必要とすることから、世界的に限られた研究施設でしか実施されていない。一方で、鳥インフルエンザウイルスは、現在、東南アジアや中近東地域の農村部を中心に蔓延しており、より簡易かつ可搬性があるシアロ糖鎖結合親和性測定技術の開発が求められている2)。
このような状況にあって、筆者らは、アビジン−ビオチン増幅系を介したイムノクロマトの原理を基に、インフルエンザウイルスのシアロ糖鎖特異性を簡便かつ短時間に識別する簡易デバイスを開発した33。本デバイスは、溶液(展開液・抗体液)とテストストリップから構成される(Fig. 3A)。展開液には、ウイルスを不活化するために十分な界面活性剤が含まれている。抗体液には、インフルエンザウイルスGroup 1 に属するH1, H2, H5, H6, H9亜型のHAに広域反応性を示すモノクロ−ナル抗体C43が含まれている。テストストリップの構成は、ニトロセルロース基材に、サンプルパッド、コンジュゲートパッド、メンブレン、吸収パッドが取り付けられている。コンジュゲードパッドには、ヒト型シアロ糖鎖を模した赤色ラテックス粒子を架橋したα2,6 sialylglycopolymerまたは鳥型シアロ糖鎖を模した青色ラテックス粒子を架橋したα2,3 sialylglycopolymerが含まれる(それぞれα2,6 Siaストリップとα2,3 Siaストリップ)。メンブレンには、アビジンと糖鎖結合性のレクチンを固相させ、それぞれtest lineとcontrol lineとしている。
検出原理は以下の通りである(Fig. 3A)。まず、ウイルスサンプル(30ml)、展開液(90 ml)と抗体液(30 ml)を混合して15分反応させ、ウイルス粒子を不活化すると共にビオチン化抗体で標識する。その後、混合液を2種類のSiaストリップのサンブルパッドに滴下してメンブレン上を展開させる。コンジュゲートパットを通過する際にsialylglycopolymer−ビオチン化抗体−ウイルス複合体が形成されると、アビジン−ビオチン相互作用によってtest lineに捕獲される。三量体がtest lineに集積するに従い、ウイルスのシアロ糖鎖結合親和性に依存して、赤色または青色のバンドが目視される。過剰量の三量体またはウイルスと結合しなかったsialylglycopolymerは、レクチンと結合することで、control lineにtest lineと同色バンドを形成する。測定結果は、混合液をテストストリップに添加して15分後にバンドを目視し、次のように判定する。① α2,6またはα2,3 Siaストリップのtest lineとcontrol lineの両方にバンドが検出された場合、それぞれα2,6 Siaまたはα2,3 Sia結合親和性があると判定する。② α2,6またはα2,3 Siaストリップのcontrol lineにのみバンドが検出された場合、それぞれα2,6 Siaまたはα2,3 Sia結合親和性が無いか検出感度以下と判定する。③ control lineが検出されない場合は、試験無効と判定する。
過去のパンデミックにおいては、その発生初期に両親和性を獲得した中間型の変異ウイルスが出現し、その後シアロ糖鎖指向性が鳥型からヒト型に完全に置換することで、パンデミックウイルスとなったと報告されている。そこで、α2,6 およびα2,3 Siaストリップのtest lineに出現するバンドパターンにより、次のようにウイルスのシアロ糖鎖結合特異性を判定する(Fig. 3B)。① test lineに青色のみのバンド確認は、典型的な鳥型のシアロ糖鎖特異性と判定する。② test lineに青色と赤色の両方のバンド確認は、両親和性を示す中間型ウイルスと判定する。③ test lineに赤色のみのバンド確認は、高いパンデミック潜在性があるウイルスまたはパンデミックウイルスと判定する。当該測定法は、僅か30分で完了し、特別な測定機器や解析手技を必要としない。そのため、可搬性に優れ、簡易な実験施設において短時間にGroup1に属する広範なインフルエンザウイルスのシアロ糖鎖結合特異性を測定することが可能である。筆者らは、これまでにエジプト、ベトナム、インドネシアにおいて流行する様々なH5N1ウイルス株や季節性インフルエンザウイルス株を用いて、本デバイスの有用性を評価した。その結果、多様な臨床ウイルス株に対してウイルスのシアロ糖鎖特異性を識別することが可能であった(Fig. 4)。一方、測定には、128 HA力価と比較的多量のウイルスが必要であることから、検出感度をさらに改良する必要がある。
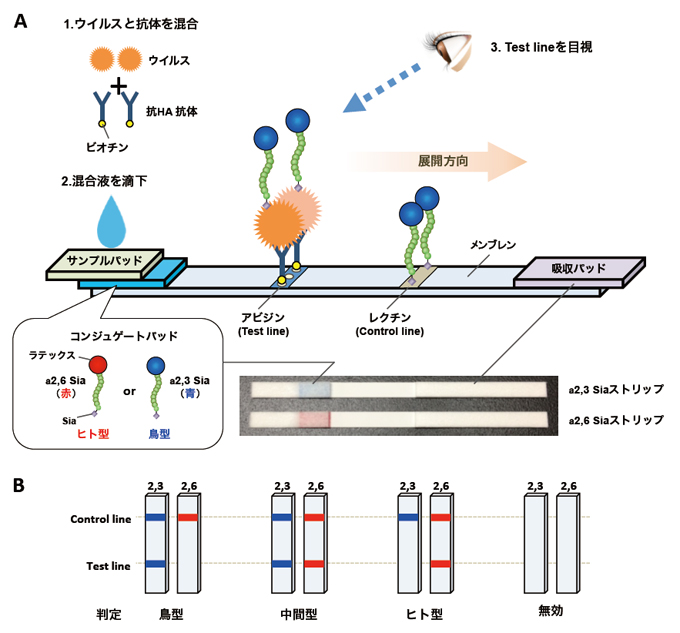
Fig. 3 インフルエンザウイルスのシアロ糖鎖特異性を迅速診断するキットの概略
(A)テストストリップの概要。ウイルスと抗HA抗体を15分反応することで、ウイルスービオチン化抗体複合体を形成させてサンプルパッドに滴下する。混合液がコンジュゲートパッドを移動する際、三量体(sialylglycopolymerーウイルスービオチン化抗体)が形成されて、test lineのアビジンに捕獲される。 三量体の集積によって、ウイルスのシアロ糖鎖結合親和性に依存して、test lineに目視可能な青色(a2,3 Sia)または赤色(a2,6 Sia)のバンドが目視される。過剰量の三量体および複合体を形成しなかったsialylglycopolymerは、control lineのレクチンに捕獲される。混合液を滴下して15分後にバンドを目視して結果判定する(テストストリップ写真:右下)。(B)テストストリップに現れるウイルスのシアロ糖鎖結合特異性パターンの概略。 a2,3およびa2,6 Siaストリップに目視されるtest lineのバンドパターンにより、ウイルスのシアロ糖鎖結合特異性を図のように判定する。(Watanabe et al., Biosens Bioelectron 2015より一部改変)
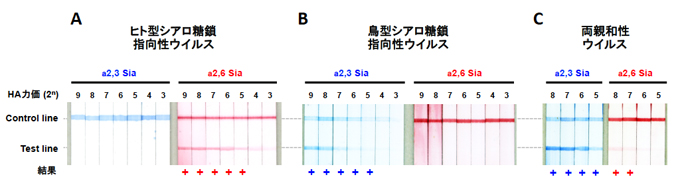
Fig. 4 シアロ糖鎖結合特異性迅速診断キットの感度および特異性
2倍段階希釈したウイルスを反応させた際のテストストリップの反応例。(A)季節性H1N1ウイルス株(A/Suita/117/2011)。(B)H5N1亜型鳥インフルエンザウイルス株(A/duck/Eygpt/D1Br/2007)。(C)両親和性を獲得したH5N1ウイルス変異株。変異ウイルスが獲得する弱いa2,6 Sia結合親和性を27=128HA力価のウイルスを用いて検出可能であった。(Watanabe et al., Biosens Bioelectron 2015より一部改変)
最近の研究によってウイルスが認識するシアロ糖鎖構造の複雑性が示唆されており、インフルエンザウイルスが未だ解明されていないより複雑なシアロ糖鎖構造を認識している可能性がある。また、インフルエンザウイルスの伝播性がHAとシアリダーゼであるNAの機能バランスによって規定されると報告されている34, 35。そのため、シアロ糖鎖を介したインフルエンザウイルスの宿主適応機構について、更なる解明が望まれる。また、インフルエンザウイルスのシアロ糖鎖特異性をより簡易に測定する解析方法の開発は、効果的なサーベイランスの実施に極めて有用となると考えられる。
謝辞
インフルエンザウイルスのシアロ糖鎖親和性についての研究において、多大なご助言とご協力を賜った中部大学の鈴木康夫博士に深く御礼申し上げます。本研究は、JSPS科研費15H05295、 15K08497、23406017の助成を受けたものです。