
氏名:森 一泰
国立感染症研究所 エイズ研究センター 主任研究官
京都大学大学院医学研究科修了。医学博士。ドイツ・ヴュルツブルク大学ウイルス免疫生物学研究所(1987-1990)、米国・ハーバード大学ニューイングランド霊長類研究センター(1990-1994年) においてHIV、SIVの研究に従事。1994年より現職。SIV/マカクザル動物モデルによるHIVの病原性・感染防御に関する研究を行っている。糖鎖修飾が病原性を規定し糖鎖変異ウイルスが生ワクチンの性質を示すことを発見した。現在はウイルス糖鎖の自然免疫における役割の解明からHIV感染症の治癒を目指す治療法の研究を行っている。
HIV感染症の治療は、優れた抗レトロウイルス薬の開発により飛躍的に改善された。多剤療法 (cART )により血液中のHIVは検出できないレベルになった。しかしHIVゲノムは細胞のDNAに組み込まれcARTを中断すると感染が再燃する。感染が起こらないレベルまでHIVを排除する、あるいは防御免疫によりcART の中止が可能となる「機能的治癒」を実現する治療法が喫緊の課題となっている1 。ワクチン開発においては、感染2-4週後に誘導される獲得免疫(液性免疫、細胞性免疫)による感染防御の研究が重点的に行われてきた。しかしながらHIVは高い変異性と多様性を示し獲得免疫から容易に逃れる。また感染防御に有効な抗体の誘導を妨げる性質を備えている。さらに免疫応答を利用して感染することが明らかになってきた。このようなHIVの性質において、糖鎖は重要な役割を担っている。一方、免疫学においては、感染初期における病原体に対する免疫の解明が進んでいる 2。本稿では、本来、感染の抑制に働く免疫がエイズウイルス感染においては感染の維持・促進に利用されていることについて、糖鎖修飾の視点から紹介する。
HIV/SIVはRNAをゲノムとするレトロウイルスである。主要標的細胞はCD4+T細胞である。感染は、ウイルスの表面の突起(ウイルススパイク: Env)と細胞表面の二つのレセプター:CD4とケモカインレセプター(CCR5, CXCR4)との結合を介して起こる(Fig. 1)。ウイルスは細胞膜と融合し、ウイルスゲノムを内包するcapsidが細胞質内に移行する。ウイルスRNAは逆転写酵素により2本鎖DNAに変換され、宿主細胞ゲノムに組み込まれる。ウイルス遺伝子は宿主遺伝子として発現される。生成されたウイルスタンパク、ウイルスゲノムRNAからウイルス粒子が形成され、細胞外に放出される。
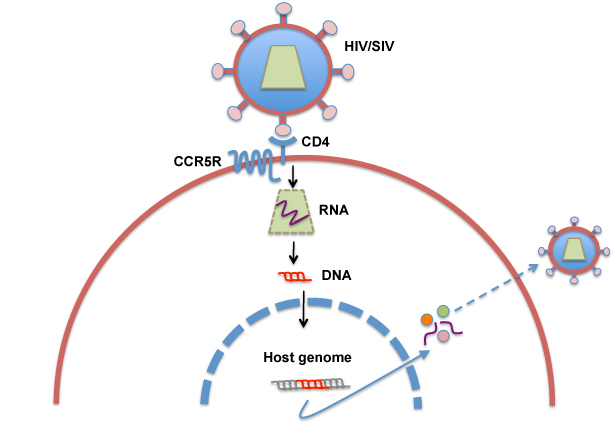
Fig. 1 エイズウイルスのCD4+T細胞における感染と複製
宿主は、免疫により病原体を非自己と認識し、感染から防御する。自然免疫では、免疫細胞は、病原体を構成する外膜・ゲノム等に存在する特徴(分子パターン)をレセプター(分子パターンと結合する)により検出、インターフェロン・サイトカイン・ケモカイン等を発現する。その結果、種々の免疫細胞が感染部位に集積し病原体を排除する3。自然免疫は同時に獲得免疫を誘導する。獲得免疫は、病原体の特異的構造(タンパク配列等)を認識するT細胞、B細胞を誘導し、抗体、細胞傷害性T細胞により病原体を排除する。さらに再感染を防ぐ免疫記憶を形成する。
通常HIV感染は制御されない。しかしHIV感染者の約1%では感染は制御される。通常の感染とは区別されるこれらの感染者はelite controllerと定義され、感染制御の例としてメカニズムの研究が行われている4。これまでHIV感染を抑制する免疫として、主に獲得免疫の研究が行われてきた。MHCの解析からelite controllerに高頻度に存在する希少MHCが同定された。これらのMHCは特定の細胞障害性T細胞(CTL)の誘導に働いていることが明らかとなった。CTLエピトープ(CTLが認識するウイルスタンパク配列)は変異が少ない領域に存在し、CTLによる感染抑制効果は高い。通常の感染では、CTLエピトープに変異を持つHIVが出現し、CTLによる感染抑制から逃れる。
一方、多くの病原体に対し、宿主は感染防御に有効な抗体を産生する。HIV/SIVに対しては、ウイルススパイクに対する抗体、特にウイルススパイクとレセプターとの相互作用に障害を与え、感染・増殖を抑制する抗体(中和抗体)は感染制御に重要である。しかしHIVの多様性と高い変異性により抗体によるHIV-1の感染制御は難しい。液性免疫から回避する変異ウイルスが容易に出現するからである。このようにHIVの多様性・変異性により獲得免疫(CTL、中和抗体)を誘導するHIVワクチン開発は難しい。さらに、通常、HIV感染者には強力な中和抗体が誘導されない。その原因はウイルススパイクの糖鎖修飾にある。
ウイルススパイクは、Env遺伝子にコードされる糖タンパクgp120とgp41によるヘテロダイマー3分子から成る(Glycoword: Infection and Sugar Chain参照)。HIV-1 Env遺伝子には25-29のN型糖鎖付加部位が存在する5。これら多数の糖鎖により、ウイルススパイクのタンパク表面の大部分は、糖鎖に覆われている6。ウイルスが標的細胞に選択的に感染するのは、ウイルススパイクが標的細胞表面のCD4、ケモカインレセプター(CCR5, CXCR4)と結合するためである。スパイクのCD4結合部位は露出しているが、ケモカインレセプター結合部位は、糖鎖修飾等により内部に隠されている(Fig. 2A)。CD4と結合するとウイルススパイクは構造変化を起こし、ケモカインレセプター結合部位は表面に露出する6(Fig. 2B)。ケモカインレセプターとの結合により、さらに構造変化を起こし、ウイルスは、標的細胞と融合し複製する(Fig. 1)。このように、糖鎖修飾は、HIVが標的細胞に感染するためのウイルススパイクと標的細胞と相互作用を調節している。糖鎖修飾はHIV/SIV感染において中和抗体誘導が低い原因となっている。ウイルススパイクのCD4、CCR5との結合と関わる領域は、中和抗体の標的となる。しかし糖鎖修飾により隠されていることから中和抗体が誘導される頻度は高くない。感染宿主においては多種多様なHIVが存在することから、多様なHIV感染を抑制する中和抗体は非常に低いと考えられていた。実際に希に感染者から同定された。ところが、抗体研究の技術の進展によりHIV感染者から多様なウイルス株を中和する抗体(広域中和抗体:broadly neutralizing antibodies: bNAbs)が次々に発見された7-10。bNAbsの共通する特徴が明らかとなった。1) ウイルススパイクのエピトープ (抗体結合部位)は、6カ所のいずれかに存在する。V2領域糖鎖、V3領域糖鎖、CD4結合領域、膜外近縁領域(MPER)等6(Fig. 2C)。2) 抗体には通常の抗体にはない特徴が存在する。抗体遺伝子には多数の体細胞変異が存在する。エピトープ結合領域 (CDR H3) が長い。3) bNAbsは慢性感染期に出現し、その頻度は、血中ウイルス量(ウイルス増殖)と比例する11。抗体遺伝子に検出された多数の体細胞変異は、次々に出現するHIVに対する免疫応答を反映する12。通常の抗体と比べ顕著に長いエピトープ結合領域は、糖鎖等の隙間に入り込み多数の分子との相互作用を持つことを可能とする13。しかしながら、感染者においてはbNAbsの感染抑制効果は小さい。bNAbsに対しても容易に変異ウイルスが出現するからである。一方、多様なHIVに対する感染阻害から、感染予防における効果が期待される。多くのbNAbsにおいて糖鎖が重要なエピトープとなっていることから(Fig. 2C)、エピトープを形成する糖鎖構造の解明はHIVワクチン開発における重要な課題となっている14。
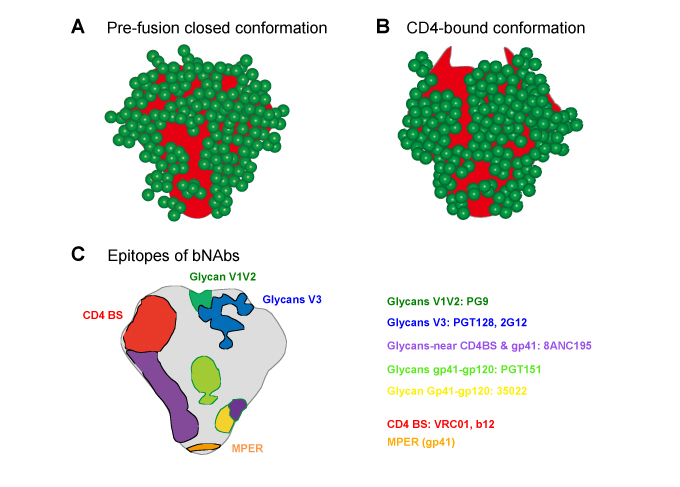
Fig. 2 HIV-1 spike における糖鎖修飾と広域中和抗体のエピトープ
SIVはマカクサルに感染し、HIVと同じ機序でAIDSを起こすことから、SIV感染アカゲザルAIDS発症モデルは、HIV病原性の研究、HIV感染症の治療法・ワクチン開発研究に用いられている。筆者らは、病原性分子クローン株SIVmac239とEnv gp120の5カ所のN型糖鎖を欠失させた変異株(Δ5G)を用い、糖鎖はSIVの病原性を決定していることを明らかにした(Glycoword: Infection and Sugar Chain)。Δ5GはSIVmac239と同様のウイルス増殖を示す初期感染を起こしたが、感染は抑制された15。さらに、Δ5Gは生ワクチンとして防御免疫を誘導した15, 16。ウイルス糖鎖の減少による中和抗体の誘導が推測されたが、中和抗体応答には個体差があり中和抗体の誘導に関係なく感染は制御された17。野生株と生ワクチン株は初期感染において感染レベルには違いがないことから、感染組織・標的細胞の違いについて解析を行った (Fig. 3A,B)18。その結果、SIVmac239は2次リンパ組織のCXCR3+CCR5+CD4+T細胞に感染し、感染2週には同細胞群を、感染前の10%以下に減少させた (Fig. 3C)。ところが、Δ5GはSIVmac239とは異なり、小腸の粘膜固有層 (lamina propria)のCD4+T細胞に感染していた (Fig. 3B)。糖鎖修飾は、感染標的となるCD4+T細胞サブセットを決定し、SIVmac239の病原性を変化させていた。CXCR3+CD4+T細胞は、2次リンパ組織においてTH1細胞に分化し、細胞性免疫誘導において重要な役割を持つことから、SIVmac239感染によるCXCR3+CD4+T細胞の消失は細胞性免疫に重大な障害を与えると推測される。一方、小腸粘膜固有層にはTH17 effector細胞が存在する。Δ5GによるTH17細胞感染は、感染防御に有効な獲得免疫の誘導を促進したと推測される。
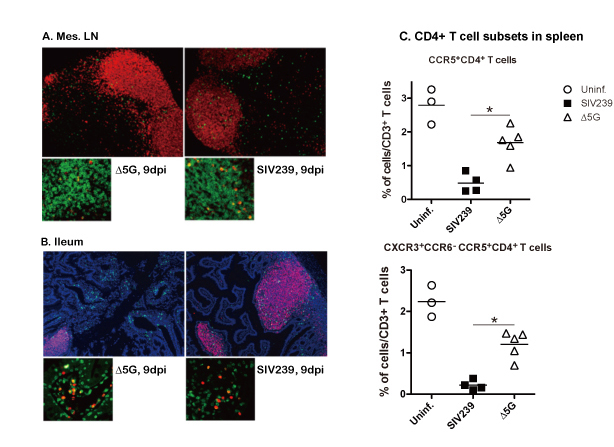
Fig. 3 SIVmac239とΔ5Gの標的CD4+T 細胞の違い
SIVmac239とΔ5Gの初期感染の違いはSIV感染に対する宿主応答によるのではないかと推測した。血液にはSIV、感染細胞、さらに感染を監視する種々の免疫細胞が存在する。そこで、マイクロアレイによる末梢血単核球遺伝子発現の網羅的解析を行い、SIV感染の違いと関連する宿主応答と関連する遺伝子を探索した。末梢血中のウイルス量は感染後10-12日に最大となることから、感染の調節に働く遺伝子を探索するために感染7日後の末梢単核球を用いた。 まずSIVmac239感染、Δ5G感染において、1型インターフェロン誘導遺伝子群(ISG)の高発現が認められた。RNA に存在する分子パターンを感知する遺伝子 (TLR7、TLR8、DDX58、IFIH1/MAD5)の発現も上昇していた。これらの遺伝子発現はSIV感染に対する自然免疫応答を反映する。多くの遺伝子は抗ウイルス宿主機能と関連する。しかしながら遺伝子発現レベルは、SIVmac239感染においてΔ5G感染と比べ高いことから、遺伝子発現レベルは、初期感染の制御とは相関しなかった。自然免疫のもう一つの重要な機能は炎症反応を起こし獲得免疫を誘導することである。実際、TH1型応答遺伝子、inflammasome の関連遺伝子の発現はSIVmac239感染においてΔ5G感染と比べ上昇していた。特に顕著であったのはCXCR3+細胞を2次リンパ組織に集積させるケモカインCXCL9、CXCL10、CXCL11の発現は、SIVmac239感染においてΔ5G感染と比べて高く、CXCL10の発現レベルは10倍以上高く、血漿のCXCL10測定により確認された。さらに血中のCXCR3+T細胞の頻度はSIVmac239感染において有意に減少していたことから、CXCR3ケモカインによるCXCR3+T細胞の2次リンパ組織への遊走によるSIV感染促進が示唆された。
末梢血単核球におけるCXCL10発現細胞は、種々のmonocyte (Mo)、樹状細胞(DC)であった。最も高い発現は、CD14+CD16+Moに認められ、血液中の頻度はCXCL10発現レベルと相関し、感染後7日にピーク値を示した。一方、2次リンパ組織においてはCD14+macrophageが最も高い発現を示した。2次リンパ組織でのCD14+macrophage におけるCXCL10の発現は、SIV感染レベルと相関していた。自然免疫細胞であるMo, DCはウイルスの糖鎖の違いを識別し、CXCL10発現を含む免疫応答によりCXCR3+T細胞を活性化し2次リンパ組織におけるTH1細胞の選択的感染を起こすと推測される(Fig. 4)。
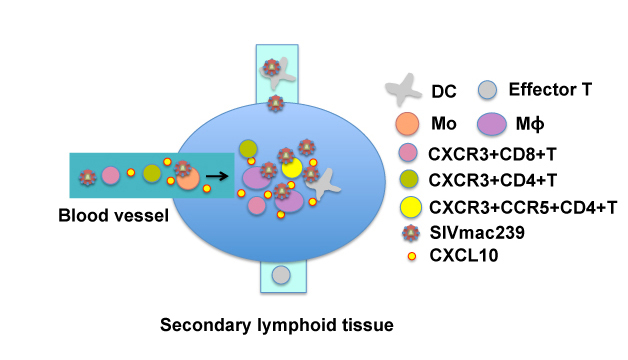
Fig. 4 SIVmac239によるCXCR3+CD4+T 細胞感染
エイズウイルスは、糖鎖に依存した性質・機能により、自然免疫を利用しウイルス増殖の条件に適した環境を作り、獲得免疫から回避する。関連する糖鎖構造の解明はbnAbsを誘導するワクチン開発研究の重要な課題となっている。治療研究においては、感染初期に形成される潜伏感染細胞(reservoirs)の排除、防御免疫の誘導が、HIV感染症の“治癒”を実現するための課題となっている。著者らは、異なるウイルスサブタイプに対する糖鎖変異生ワクチンの有効性16は、自然免疫、獲得免疫を含む多様な宿主免疫が関連していると考える。すなわち、糖鎖変異生ワクチンにおける糖鎖の役割・機能の解明は、HIVの病原性、HIVに対する防御免疫に新たな知見を与えるのみならず、感染免疫学の発展に貢献することが期待される。