Nov. 14, 2013
インフルエンザウイルスのレセプターと宿主域変異機構の研究フロンティア(2013 Vol.16, A2)
鈴木 康夫
氏名:鈴木 康夫
鈴木康夫教授は、静岡薬科大学大学院薬学研究科を修了し、1974年に薬学博士号を取得した。 1996年から2002年まで静岡県立大学の薬学部長および大学院薬学部長を務めた。また、日本糖質学会の副会長も務め、2004年には日本薬学会賞と中日文化賞を受賞した。現在は、中部大学生命健康科生命医科学科の教授である。専門分野は、生化学、ウイルス学と糖鎖生物学で、ウイルス感染における糖鎖機能の解明と創薬への応用に特に重点的に取り組んでいる。グリフィス大学(オーストラリア)および浙江省医学科学院(中国)の客員教授でもあり、2006年8月にはThe 5th International Sialoglycosceince 2006のオガナイザーを務めた。
1. はじめに
インフルエンザウイルス(Fig. 1)のレセプターに関する研究は古くて新しい。インフルエンザウイルスがノイラミニダーゼと呼ばれるレセプター破壊酵素(Receptor destroying enzyme) を持つことが分かったのは1940から1950年代のことである1-3。それ故、インフルエンザウイルスのレセプターは、シアル酸(Sia)を含む糖鎖であることが明らかになった。その精密化学構造は、Suzukiらにより明らかにされた4-6。
これまで、世界流行(Pandemic)を起こしてきたA型インフルエンザウイルスの自然宿主は野生の水鳥である。野生水鳥は地球規模の渡りにより、ウイルスをニワトリなどの家禽やブタなどの中間宿主へ伝播し、その過程で、ヒトヘの伝播能力を獲得した変異ウイルスがヒトの間で世界流行を起こしてきた。鳥からヒトヘのインフルエンザウイルスの宿主域の変異とウイルスの宿主レセプター結合特異性の変化は、深く関わっている。1997年には、高病原性鳥インフルエンザウイルス(H5N1)が、香港で発生した。このウイルスは、ニワトリに対して致死性であり、ヒトに対しても高い致死率(約60%)で伝播し続けている。2009年には鳥、ヒト、ブタインフルエンザウイルス遺伝子を持つ新型インフルエンザウイルス(H1N1)がメキシコから発生し、パンデミックとなった。さらに、2013年2月に、新しい型の鳥インフルエンザウイルス (H7N9)が上海で発生した。このウイルスは、ニワトリに対して低病原性であるが、ヒトに対してはこれまでのところ致死率25%を超える高い病原性を持ちつつ、感染が拡大しつつある。インフルエンザウイルスはどのような仕組みでヒト世界へ入り、さらにヒト間伝播能力を獲得するのだろうか?この機構解明にはウイルスの宿主レセプター(シアル酸含有糖鎖)結合特異性にかかわる変異が深く関連する。
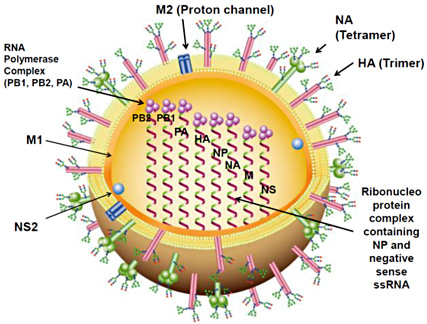
Fig. 1 A型インフルエンザ型ウイルスの模式図
ウイルス膜には2つの糖タンパク質、へマグルチニン(HA)およびノイラミニダーゼ(NA)の他にM2プロトンチャネルが存在する。ウイルス膜は宿主細胞膜に由来する。HAおよびNAに付加されたグリカンも宿主細胞が持つ糖鎖付加システムにより合成される。リボヌクレオプロテイン複合体はウイルスRNA、ヌクレオプロテインおよび3つのRNAポリメラーゼ(PA, PB1, PB2) から成る。マトリックス (M1) タンパク質は、ヌクレオプロテインとウイルスエンベロープと会合している。非構造タンパク質 (NS2) もウイルス粒子中に存在する。ウイルスが持つ8つのネガガティブ鎖RNA断片は12のタンパク質、PB1, PB1-F2, N40, PB2, PA, HA, NP, NA, M1, M2, NS1, NS2. を作る。
2. ウイルスへマグルチニン(HA)とレセプターシアロ糖鎖
A型インフルエンザは世界で最も広く分布する人獣共通感染症の一つである。インフルエンザウイルスの宿主域をFig. 2に示す。A型インフルエンザウイルスへマグルチニン (HA)には16種類の亜型(H1〜H16)が知られている。ウイルスと宿主であるヒト呼吸器との相関は、ウイルス側の HA糖タンパク質と宿主細胞側のシアロ糖鎖レセプターとの結合から始まる。様々なウイルス株は、シアロ糖鎖末端のSiaα-Gal(ガラクトース)結合を認識して結合する。
一方、宿主細胞に発現されているシアロ糖鎖は、シアル酸含有糖タンパク質(N-グリカン、O-グリカン)、スフィンゴ糖脂質(ガングリオシド)、GPIアンカー、ムチンなどに発現されている7-9。
シアル酸(Sia)の分子種は自然界で50を超えるが、その中でも、N-アセチルノイラミン酸(Neu5Ac) とN−グリコリルノイラミン酸 (Neu5Gc) は、A, B型インフルエンザウイルス感染にとって重要な位置を占める。米国、ロシア、ヨーロッパ, そして我々のグループにより、カモや高病原性鳥インフルエンザウイルスを含む鳥インフルエンザウイルスのHAはSiacα2-3Gal (以後、α2-3あるいは鳥型レセプターと略)を含む糖鎖と優先的に結合するが、ヒト間で流行しているウイルスのHAはSiaα2-6Gal (以後、α2-6またはヒト型レセプター)を含む糖鎖と結合することも明らかにされた8,9。
Siaα2-3Gal-結合性から Siaα2-6Gal-結合性への変異は、ヒトへの適応性獲得の最初のステップとして重要である。実際、パンデミックを起こした1918年のスペインインフルエンザ (H1N1), 1957年のアジア風邪 (H2N2), 1968年のホンコン風邪 (H3N2)ウイルスは、最近世界流行を起こした2009年のウイルスと同様に、これらのウイルスはヒト以外の動物種に由来しているにも関わらず、全て、ヒト型レセプターへの結合性を獲得していた10-13。
シアリル糖鎖特異的レクチン染色によりヒト上気道上皮細胞にはSiaα2-6Galが主に存在するが、ヒト下気道および肺にはヒト型および鳥型レセプターの両者が発現している14。ブタ気道にも鳥およびヒト型レセプターが検出されている15。カモやアヒルを含む水鳥の気道上皮には鳥型レセプターが主に存在する16-18。しかし、ニワトリ、七面鳥、ウズラなど、陸棲の鳥の上皮細胞には鳥型、ヒト型の両方のレセプターが存在し16, 19、これらの種では、鳥およびヒトインフルエンザウイルス両方の増殖が可能となり、ウイルスがこれらの種の中で伝播を繰り返す間に、鳥からヒトへの宿主適応性変異が起こる可能性を示している。注目すべき事に、ニワトリやウズラなどの陸棲鳥から分離されたH5N1やH9N2株の中には、ヒト型レセプターと結合するものが見出されている20, 21。
上記の様々なインフルエンザウイルスのレセプター結合特異性は、シアロ糖鎖を修飾した赤血球の凝集反応、固相化天然および化学合成シアロ糖鎖を用いる結合アッセイ、近年では、糖鎖マイクロアレイ8, 9, 12, 22アッセイ法により調べられた。質量分析法およびシアロ糖鎖特異的レクチンによる組織染色の組み合わせ技法により、宿主側のウイルス標的器官、すなわち、ブタ気道、肺 23, 24、ウズラ、ニワトリ25の腸管のN-シアログリカン糖鎖構造が明らかにされた。最近、ヒト肺、気管支、鼻咽頭におけるN-, O-グリカン組成も質量分析により明らかにされた26。
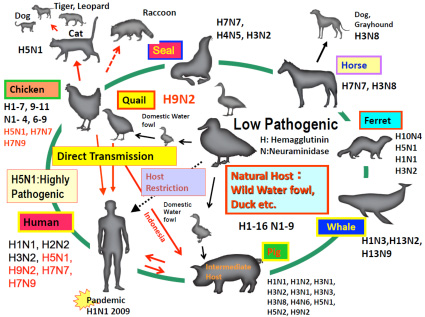
Fig. 2 A型インフルエンザウイルスの宿主域
A型インフルエンザウイルス(H1-H16, N1-N9亜型)の自然宿主はカモなどの野生水鳥であり、これらは、地球上の全てのA型インフルエンザウイルスの起源となっている。
ウイルスは、野生水鳥にいる間は低病原性であるが、ニワトリのような陸棲の家禽へ伝播し、その中で増殖を繰り返す過程で、高病原性となる場合がある。インフルエンザウイルスは、変異しやすく、高病原性を獲得し、宿主域を広げていく。既に、H5N1, H7N7, H7N9亜型ウイルスはニワトリからヒトへ伝播し、H9N2亜型ウイルスはウズラからヒトへ伝播しているが、ヒト間での効率的伝播は起こっていない。
3. 鳥インフルエンザウイルスのヒト型レセプター結合適応変異
我々は、これまで、ヒト型レセプターへの結合性を獲得した高病原性鳥インフルエンザウイルス(H5N1) 分離株を感染した“ヒト”から見いだしてきた。すなわち、ホンコン27、タイ 28、ベトナム29 において、H5N1に感染した“ヒト”から鳥型レセプターのみならず、ヒト型レセプターへの結合性を獲得した分離株を見いだした。Watanabeら30 は、最近、エジプトの“ニワトリ”から分離された高病原性鳥インフルエンザウイルスH5N1株から、世界ではじめて、鳥型レセプターのみならずヒト型レセプターにも結合できる株を見出した。Nidomら31 は、H5N1がインドネシアのブタにかなりの割合(調べたブタの13%)で伝播しており、分離株中の1つが鳥型、ヒト型両レセプターへの結合性を持つことを見出している。ニワトリおよび七面鳥から分離された高病原性のH7分離株32、ウズラから分離されたH9株21 においても鳥型、ヒト型レセプターへの結合性を獲得した株が報告されている。この結果は、高病原性鳥ウイルス(H5N1)や他の亜型の鳥インフルエンザウイルスがニワトリ、ウズラ、七面鳥、ブタなどの家禽、家畜の間で流行しているうちにヒト型レセプターへの適応性変異を獲得し得ることを示している。
ヒトの上気道には、ヒト型レセプターが存在し、ヒトの下気道や肺胞にはヒト型、鳥型両方のレセプターの存在が明らかにされている14。よって、鳥ウイルスがヒトの下気道あるいは肺胞にまで達した場合、鳥型レセプターを介した感染が成立し、重篤な肺炎を起こす可能性がある。この場合、ヒトの呼吸器でウイルスが増殖する過程で、ランダムに起こるHAの変異が、ヒト呼吸器に主に存在するヒト型レセプター(Neu5Acα2-6Gal)への適応性獲得である場合、その株が選択され、ヒトの体内で新たなヒト適応型変異株が生じる可能性がある。我々はニワトリ、ウズラなどの腸管、ブタの呼吸器におけるN-結合型シアロ糖鎖の精密構造解析を行い、これらの動物のウイルス標的器官に、鳥型の他にヒト型シアロ糖鎖レセプターの存在を確認した23, 25。これらの結果は、ヒトのみならず、ニワトリ、ウズラなどの家禽やブタ体内でもヒト型レセプター適応変異が起こり得ることを強く示唆するものである。鳥、ヒト型両方のレセプターへ結合できるH5N1株は、ヒトの喉や上気道に存在するヒト型レセプターへ結合できるため、ヒトーヒト感染が容易になる可能性が高くなると考えられる。
1918年スペインインフルエンザウイルス (H1N1) の場合、へマグルチニン分子内のわずか2個のアミノ酸変異が鳥型レセプターへの結合性をヒト型レセプター結合性へと変化させたことが明らかとなっている。すなわち、第1波 (first wave) のウイルスのHAはE190D, 225Gであり、このウイルスは鳥、ヒト型レセプターの両方へ結合したが、第2波のウイルスHAはさらに190D, G225Dとなり、ヒト型レセプターのみへ結合する性質を獲得した。この変異がヒトーヒト上気道感染を容易にしたと考えられる。同じ亜型である、2009年pandemic H1N1も速やかに全ヒト世界へ広がったが、このウイルスのHAも190D, 225Dでありヒト型レセプターのみに結合できる性質を獲得していた33-35。
1957年に発生したパンデミックアジア風邪ウイルス(H2N2亜型)の場合も、流行初期のヒト分離株HAは鳥型 (226Q, 228G)、ヒト型 (226L, 228S)、中間型(226L, 228S)の3種のレセプター結合特異性を持つ株が混在したが、しだいに全てのH2ウイルスはヒト型レセプターのみに結合するヒト特異的な226L, 228Sの変異を獲得した36。
2013年、2月に発生した鳥インフルエンザウイルス(H7N9)は、5月までに132人に感染し、内37人が死亡しており、H5N1に比べて速やかなヒトヘの感染が見られた。しかし、本ウイルスのヒト間伝播はこれまでのところ確認されていない。このウイルスのレセプター結合特異性が発表された37-39。調べられたヒトから分離されたウイルスは、いずれも鳥型レセプターおよびヒト型レセプターいずれにも結合性を示し、ヒト呼吸器に存在が認められている長いN-グリカンへの結合性40も獲得していた。対照に用いたヒト季節性ウイルス (H1N1) や2009年pandemic H1N1ウイルスはヒト型レセプターへ、カモウイルスや高病原性鳥インフルエンザウイルスH5N1は鳥型レセプターへ優先的に結合した。本ウイルスは、ニワトリに対しては低病原性であるがヒトには高い病原性を持つ。
H7N9ウイルスは、ヒト型および鳥型レセプターの両者へ結合でき、ヒト下気道上皮細胞とII型肺細胞での増殖も観察された。ウイルスがII型肺細胞で増殖可能であることは、ヒトにおける症状の重症化と関連付けられ、気管でも増殖することからヒト-ヒト感染の可能性があることが示唆された38。
Kawaokaら、Fouchierら, および彼らの共同研究者ら41-44 は、高病原性鳥インフルエンザウイルスH5へマグルチニンのアミノ酸が数個置換変異するだけで、ウイルスは、ヒト型レセプターへの結合性とフェレット間飛沫感染を引き起こすことが可能になることを実験的に明らかにした。フェレットは、ヒトインフルエンザウイルスの感染モデル動物として用いられる。Imaiら 41は、人工的に作出した遺伝子交雑ウイルス「H5HA/H1N1:へマグルチニン分節は4つのアミノ酸変異(N224K, Q226L, N158D, T318I)を持つ高病原性鳥インフルエンザウイルスH5由来、その他の7分節は2009年パンデミックインフルエンザウイルス由来」は、ヒト型レセプターシアロ糖鎖への結合性とフェレット間飛沫感染能力をしめすことを明らかにした。一方、Herfstら43 は、天然のH5N1ウイルスをsite-directed mutagenesisにより複数のアミノ酸を変異させ、さらにフェレットで継代したところ、ヒト型レセプターへの結合性とフェレット間飛沫感染を起こす能力を獲得したウイルスを分離できた。このウイルスのHA分子は、河岡グループの場合と同様に4つのアミノ酸置換(Q226L, G228S, T160A, H107Y) が見られた。両研究から高病原性鳥インフルエンザウイルスH5へマグルチニンにおけるレセプター結合ポケット近傍の220-loopにおけるアミノ酸置換変異(N224K, Q226L, 41, およびN224K, G228S, 43 ならびにアミノ酸158-161における糖鎖付加欠落、さらに、H5 HAスパイク分子の軸部位におけるアミノ酸置換 (T318, 41; H107Y, 43)がヒト型レセプター結合特異性ならびにフェレット間の飛沫感染性の付与に重要である事がわかる。H5 HAのレセプター結合ポケットから離れている軸部位における置換変異, T318I または H107YはH5分子の構造安定性に重要であるかもしれない 41,43。
鳥H5N1ウイルスへマグルチニン糖タンパク質HA 158-161 (H3番号)における糖鎖欠落は、ヒトへの適応性獲得に重要であると思われる。エジプトで分離されたH5N1ウイルス株では、HA158-161における糖鎖欠落ウイルスは、糖鎖付加ウイルスに比べてヒトヘの伝播はより容易になっているように見える。両研究および他の研究45-47 から、H5N1ウイルスがヒトヘ適応性を獲得するには、ヒト型レセプターへの結合性獲得は必要であるが、充分ではないことを示している。
4. 展望
これまでパンデミックとなったインフルエンザウイルス株は、例外なく最終的にヒト型レセプター(Neu5Acα2-6Gal)への優先的結合性を獲得している。発生初期には鳥、ヒト型の両方のレセプターへ結合できる中間型のウイルスが現われることがある。現在、鳥インフルエンザウイルスH5N1, H7N9が多くのヒトへ伝播しており、ヒト型レセプターへの結合性を獲得したウイルス株も見つかっている。特にH7N9は高いヒト型レセプターへの結合性を獲得し、弱いながらもフェレット間飛沫感染も確認されている。しかし、ランダムなヒト間伝播は起こっていない。
Newmannら48は、データベース検索により、2つのH5N1分離株、A/Muscovy/duck/Vietnam/NCVD-11/2007 および A/duck/Egypt/10185SS/2010は、既に、HA-220KおよびHA158-161糖鎖欠落の変異を獲得しており、あと2つのアミノ酸置換が付加されれば、河岡グループが明らかにしたフェレット間飛沫感染可能な変異 (N224K, Q226L, N158D, T318I)と同じ変異を持つウイルスとなる可能性を指摘している。
今後は、1)シアロ糖鎖レセプターの末端の2糖、Neu5Acα2-6Galへの結合性のみならず、ヒトの上気道にあるかもしれないより複雑な長いヒト型レセプター(長いシアリルラクトサミン糖鎖、Neu5Acα2-6(Galβ1-4GlcNAc)nβ1-: n=1-3)への結合性の監視49、2)HAの変異のみならず、ウイルス増殖や出芽にかかわるノイラミニダーゼとの活性バランスの監視50 など、さらなる監視、研究が必要である。野外で分離される鳥インフルエンザウイルス、特にH5N1, H7N9のヒト型レセプター結合性変異を高精度、高感度、簡便、高速にアッセイ出来る監視システムの構築が重要となる。
References
- Hirst G.K.: Adsorption of influenza hemagglutinins and virus by red blood cells. J. Exp. Med., 76, 195-209, 1942.
- Burnet, F.M., Stone, J.D.: The receptor destroying enzyme of V. cholerae. Aust. J. Exp.
Biol. Med. Sci., 25, 227-233, 1947.
- Gottschalk A. (ed): "The Chemistry and Biology of sialic acids and related substances” University Press, Cambridge, 1960.
- Suzuki, Y., Matsunaga, M., Matsumoto, M.: N-Acetylneuraminyllactosylceramide, GM3-NeuAc, a new influenza A virus receptor which mediates the adsorption-fusion process of viral infection. Binding specificity of influenza virus A/Aichi/2/68 (H3N2) to membrane-associated GM3 with different molecular species of sialic acid. J. Biol. Chem.,260 (3), 1362-1365, 1985.
- Suzuki, Y., Nagao, Y., Kato, H., Matsumoto, M,, Nerome, K., Nakajima, K., Nobusawa, E.: Human influenza A virus hemagglutinin distinguishes sialyloligosaccharides in membrane-associated gangliosides as its receptor which mediates the adsorption and fusion processes of virus infection. Specificity for oligosaccharides and sialic acids and the sequence to which sialic acid is attached. J. Biol. Chem., 261(36), 17057-17061, 1986.
- Suzuki, Y., Nakao, T., Ito, T., Watanabe, N., Toda, Y., Xu, G., Suzuki, T., Kobayashi, T., Kimura, Y., Yamada, A.: Structural determination of gangliosides that bind to influenza A, B, and C viruses by an improved binding assay: strain-specific receptor epitopes in sialo-sugar chains. Virology, 189 (1), 121-131, 1992.
- Suzuki, Y.: Highly pathogenic avian influenza. J. Disaster Res. (Review), 6, 398-403, 2011.
- Suzuki, Y.: The highly pathogenic avian influenza H5N1 – Initial molecular signals for the next influenza pandemic. Chang Gung Med. J. (Review), 32: 258-263, 2009.
- Suzuki, Y.: Sialobiology of influenza Molecular mechanism of host range variation of influenza viruses. Biol. Pharm. Bull. 28, 399-408, 2005.
- Matrosovich, M., Tuzikov, A., Bovin, N., Gambaryan, A., Klimov, A., Castrucci, M.R., Donatelli, I., Kawaoka, Y.: Early alterations of the receptor-binding properties of H1, H2, and H3 avian influenza virus hemagglutinins after their introduction into mammals. J. Virol., 74, 8502-8512, 2000.
- Connor, R.J., Kawaoka, Y., Webster, R.G., Paulson, J.C.: Receptor specificity in human, avian, and equine H2 and H3 influenza virus isolates. Virology, 205, 17-23, 1994.
- Stevens, J., Blixt, O., Glaser, L., Taubenberger, J.K., Palese, P., Paulson, J.C., Wilson, I.A.: Glycan microarray analysis of the hemagglutinins from modern and pandemic influenza viruses reveals different receptor specificities. J. Mol. Biol., 355, 1143-1155, 2006.
- Childs, R.A., Palma, A.S., Wharton, S., Matrosovich, T., Liu, Y., Chai, W., Campanero-Rhodes, M.A., Zhang, Y., Eickmann, M., Kiso, M., Hay, A., Matrosovich, M., Feizi, T.: Receptor-binding specificity of pandemic influenza A (H1N1) 2009 virus determined by carbohydrate microarray. Nat. Biotechnol., 27, 797-799, 2009.
- Shinya, K., Ebina, M., Yamada, S., Ono, M., Kasai, N., Kawaoka, Y.: Avian flu: influenza virus receptors in the human airway. Nature, 440, 435-436, 2006.
- Ito, T., Couceiro, J.N., Kelm, S., Baum, L.G., Krauss, S., Castrucci, M.R., Donatelli, I., Kida, H., Paulson, J.C., Webster, R.G., Kawaoka, Y.: Molecular basis for the generation in pigs of influenza A viruses with pandemic potential. J. Virol., 72, 7367-7373, 1998.
- Kimble, B., Nieto, G.R., Perez, D.R.: Characterization of influenza virus sialic acid receptors in minor poultry species. Virol. J., 7, 365, 2010.
- Kuchipudi, S.V., Nelli, R., White, G.A., Bain M., Chang, K.C., Dunham, S.: Differences in influenza virus receptors in chickens and ducks: Implications for interspecies transmission. J. Mol. Genet. Med., 3, 143-151, 2009.
- Yu, J.E., Yoon, H., Lee, J.H., Chang, B.J., Song, C.S., Nahm, S.S.: Expression patterns of influenza virus receptors in the respiratory tracts of four species of poultry. J. Vet. Sci., 12, 7-13, 2011.
- Yamada, S., Shinya, K., Takada, A., Ito, T., Suzuki, T., Suzuki, Y., Le, Q.M., Ebina, M., Kasai, N., Kida, H., Horimoto, T., Rivailler, P., Chen, L.M., Donis, R.O., Kawaoka, Y.: Adaptation of a duck influenza A virus in quail. J. Virol., 86, 1411-1420, 2012.
- Matrosovich, M.N., Krauss, S., Webster, R.G.: H9N2 influenza A viruses from poultry in Asia have human virus-like receptor specificity. J. Virol., 281, 156-162, 2001.
- Saito, T., Lim, W., Suzuki, T., Suzuki, Y., Kida, H., Nishimura, S., Tashiro, M.: Characterization of a human H9N2 influenza virus isolated in Hong Kong. Vaccine, 20, 125-133, 2001.
- Blixt, O., Head, S., Mondala, T., Scanlan, C., Huflejt, M.E., Alvarez, R., Bryan, M.C., Fazio, F., Calarese, D., Stevens, J., Razi, N., Stevens, D.J., Skehel, J.J., van Die, I., Burton, D.R., Wilson, I.A., Cummings, R., Bovin, N., Wong, C.H., Paulson, J.C.: Printed covalent glycan array for ligand profiling of diverse glycan binding proteins. Proc. Natl. Acad. Sci. U S A, 101, 17033-17038, 2004.
- Sriwilaijaroen, N., Kondo, S., Yagi, H., Takemae, N., Saito, T., Hiamatsu, H., Kato, K., Suzuki, Y.: N-Glycans from Porcine Trachea and Lung: Predominant NeuAcα2-6Gal Could Be a Selective Pressure for Influenza Variants in Favor of Human-Type Receptor. PLoS One 6(2): e-16302, 2011.
- Bateman A.C., Karamanska, R., Busch, M.G., Dell, A., Olsen, C.W., Haslam, S.M.: Glycan analysis and influenza A virus infection of primary swine respiratory epithelial cells: the importance of NeuAcα2-6 glycans. J. Biol. Chem., 285, 34016-3426, 2010.
- Guo, C.T., Takahashi, N., Yagi, H., Kato, K., Takahashi, T., Yi, S.Q., Chen, Y., Ito T., Otsuki, K., Kida, H., Kawaoka, Y., Hidari, K.I., Miyamoto, D., Suzuki, T., Suzuki, Y.: The quail and chicken intestine have sialyl-Gal sugar chains responsible for the binding of influenza A viruses to human type receptors. Glycobiology, 17, 713-724, 2007.
- Walther, T, Karamanska、R., Chan, R.W.Y., Chan, M.C.W., , Jia N., Air, G., Hopton, C., Wong, M.P., Dell, A., Malik Peiris, J.S., Haslam, S.M., Nicholls, J.M.: Glycomic analysis of human respiratory tract tissues and correlation with influenza virus infection. PLoS Pathog., 9(3): e1003223, 2013.
- Shinya, K., Hatta, M., Yamada, S., Takada, A., Watanabe, S., Halfman, P., Horimoto, T., Neumann, G., Lim, W., Guan, Y., Peiris, M., Kiso, M., Suzuki, T., Suzuki, Y., Kawaoka, Y.: Characterization of a Human H5N1 Influenza A Virus Isolated in 2003. J. Virol., 79, 9926-9932, 2005.
- Auewarakul, P., Suptawiwat, O., Kongchanagul, A., Sangma, C., Suzuki, Y., Ungchusak, K., Louisirirotchanakul, S., Lerdsamran, H., Pooruk, P., Thitithanyanont, A., Pittayawonganon, C., Guo, C.T., Hiramatsu, H., Jampangern, W., Chunsutthiwat, S., Puthavathana, P.: An avian influenza H5N1 virus that binds to a human-type receptor. J. Virol., 81, 9950-9955, 2007.
- Le, Q.M., Kiso, M., Someya, K., Sakai, Y.T., Nguyen, T.H., Nguyen, K.H., Pham, N.D., Ngyen, H.H., Yamada, S., Muramoto, Y., Horimoto, T., Takada, A., Goto, H., Suzuki, T., Suzuki, Y., Kawaoka, Y.: Avian flu: isolation of drug-resistant H5N1 virus. Nature, 437, 1108, 2005.
- Watanabe, Y., Ibrahim, M.S., Ellakany, H.F., Kawashita, N., Mizuike, R., Hiramatsu, H., Sriwilaijaroen, N., Takagi, T., Suzuki, Y., Ikuta, K.: Acquisition of Human-Type Receptor Binding Specificity by New H5N1 Influenza Virus Sublineages during Their Emergence in Birds in Egypt. PLoS Pathog., 7 (5), e-1002068, 2011.
- Nidom, C.A., Takano, R., Yamada, S., Sakai-Tagawa, Y., Daulay, S., Aswadi, D., Suzuki, T., Suzuki, Y., Iwatsuki-Horimoto, K., Shinya, K., Muramoto, Y., Kawaoka, Y.: Influenza A(H5N1) viruses from pigs, Indonesia. Emerg. Infect. Dis., 16, 1515-1523, 2010.
- Belser, J.A., Blixt, O., Chen, L.M., Pappas, C., Maines, T.R., Van Hoeven, N., Donis, R., Busch, J., McBride, R., Paulson, J.C., Katz, J.M., Tumpey, T.M..: Contemporary North American influenza H7 viruses possess human receptor specificity: Implications for virus transmissibility. Proc. Natl. Acad. Sci. U S A, 105, 7558-7563, 2008.
- Kobasa, D., Takada, A., Shinya, K., Halfman, P., Hatta, M., Theriault, S., Suzuki, H., Nishimura, H., Mitamura, K., Sugaya, N., Usui, T., Murata, T., Maeda, Y., Watanabe, S., Suresh, M., Suzuki, T., Suzuki, Y., Feldmann, H., Kawaoka, Y.: Enhanced virulence of influenza A viruses with the haemagglutinin of the 1918 pandemic virus. Nature, 431, 703-707, 2004.
- Glaser, L., Stevens, J., Zamarin, D., Wilson, I.A., García-Sastre, A., Tumpey, T.M., Basler, C.F., Taubenberger, J.K., Palese, P.:A single amino acid substitution in 1918 influenza virus hemagglutinin changes receptor binding specificity. J. Virol., 79, 11533-11536, 2005.
- Tumpey, T.M., Maines, T.R., Van Hoeven, N., Glaser, L., Solórzano, A., Pappas, C., Cox, N.J., Swayne, D.E., Palese, P., Katz, J.M., García-Sastre, A.: A two-amino acid change in the hemagglutinin of the 1918 influenza virus abolishes transmission. Science, 315, 655-659, 2007.
- Xu, R., McBride, R., Paulson, J.C., Basler, C.F., Wilson, I.A.,: Structure, receptor binding, and antigenicity of influenza virus hemagglutinins from the 1957 H2N2 pandemic. J. Virol., 84, 1715-1721, 2010.
- Watanabe T, Kiso M, Fukuyama S, Nakajima N, Imai M, Yamada S, Murakami S, Yamayoshi S, Iwatsuki-Horimoto K., Sakoda Y, Takashita E, McBride, R., Noda, T., Hatta, M., Imai, H., Zhao, D., Kishida, N., Shirakura, M., de Vries, R.P., Shichinohe, S., Okamatsu, M., Tamura, T., Tomita, Y., Fujimoto, N., Goto, K., Katsura, H., Kawakami, E., Ishikawa, I., Watanabe, S., Ito, M., Sakai-Tagawa, Y., Sugita, Y., Uraki, R., Yamaji, R., Eisfeld, A.J., Zhong, G., Fan, S., Ping, J., Maher, E.A., Hanson, A., Uchida, Y., Saito, T., Ozawa, M., Neumann, G., Kida, H., Odagiri, T., Paulson, J.C., Hasegawa, H., Tashiro, M., Kawaoka, Y.: Characterization of H7N9 influenza A viruses isolated from humans. Nature, Published online 10 July, 2013.
- Zhou, J., Wang, D., Gao, R., Zhao, B., Song, J., Qi, X., Zhang, Y., Shi, Y., Yang, L., Zhu, W., Bai, T., Qin, K., Lan, Y., Zou, S., Guo, J., Dong, J., Dong, L., Zhang, Y., Wei, H., Li, X., Lu, J., Liu, L., Zhao, X., Li, X., Huang, W., Wen, L., Bo, H., Xin, L., Chen, Y., Xu, C., Pei, Y., Yang, Y., Zhang, X., Wang, S., Feng, Z., Han, J., Yang, W., Gao, G.F., Wu, G., Li, D., Wang, Y., Shu, Y.: Biological features of novel avian influenza A (H7N9) virus. Nature, 499 (7459), 500-503, 2013.
- Xiong, X., Martin, S.R., Haire, L.F., Wharton, S.A., Daniels, R.S., Bennett, M.S., McCauley, J.W., Collins, P.J., Walker, P.A., Skehel, J.J., Gamblin, S.J.: Receptor binding by an H7N9 influenza virus from humans. Nature, 499, 496-499, 2013.
- Tharakaraman, K., Jayaraman, A., Raman, R., Viswanathan, K., Stebbins, N.W., Johnson, D., Shriver, Z., Sasisekharan, V., Sasisekharan, R.: Glycan receptor binding of the influenza A virus H7N9 hemagglutinin. Cell, 153, 1485-1493, 2013.
- Imai, M., Watanabe, T., Hatta, M., Das, S.C., Ozawa, M., Shinya, K., Zhong, G., Hanson, A., Katsura, H., Watanabe, S., Li, C., Kawakami, E., Yamada, S., Kiso, M., Suzuki, Y., Maher, E.A., Neumann, G., Kawaoka, Y.: Experimental adaptation of an influenza H5 HA confers respiratory droplet transmission to a reassortant H5 HA/H1N1 virus in ferrets. Nature, 486, 420-428, 2012.
- Xiong, X., Coombs, P.J., Martin, S.R., Liu, J., Xiao, H., McCauley, J.W., Locher, K., Walker, P.A., Collins, P.J., Kawaoka, Y., Skehel, J.J., Gamblin, S.J. : Receptor binding by a ferret-transmissible H5 avian influenza virus. Nature, 499, 496-499, 2013.
- Herfst, S., Schrauwen, E.J., Linster, M., Chutinimitkul, S., de Wit, E., Munster, V.J., Sorrell, E.M., Bestebroer, T.M., Burke, D.F., Smith, D.J., Rimmelzwaan, G.F., Osterhaus, A.D., Fouchier, R.A.: Airborne transmission of influenza A/H5N1 virus between ferrets. Science, 336, 1534-1541, 2012.
- Zhang, W., Shi, Y., Lu, X., Shu, Y., Qi, J., Gao, G.F.: An airborne transmissible avian influenza H5 hemagglutinin seen at the atomic level. Science, 340, 1463-1367, 2013.
- Maines, T.R., Chen, L.M., Matsuoka, Y., Chen, H., Rowe, T., Ortin, J., Falcón, A., Nguyen, T.H., Mai le, Q., Sedyaningsih, E.R., Harun ,S., Tumpey, T.M., Donis, R.O., Cox, N.J., Subbarao, K., Katz, J.M.: Lack of transmission of H5N1 avian-human reassortant influenza viruses in a ferret model. Proc. Natl. Acad. Sci. U S A, 103, 12121-12126, 2006.
- Mainers, T.R., Chen, L.M., Van Hoeven, N., Tumpey, T.M., Blixt, O., Belser, J.A., Gustin, K.M., Pearce, M.B., Pappas, C., Stevens, J., Cox, N.J., Paulson, J.C., Raman, R., Sasisekharan, R., Katz, J.M., Donis, R.O.: Effect of receptor binding domain mutations on receptor binding and transmissibility of avian influenza H5N1 viruses. Virology, 413, 139-147, 2011.
- Chen, L.M., Blixt, O., Stevens, J., Lipatov, A.S., Davis, C.T., Collins, B.E., Cox, N.J., Paulson, J.C., Donis, R.O.: In vitro evolution of H5N1 avian influenza virus toward human-type receptor specificity. Virology, 422, 105-113, 2012.
- Newmann., G., Macken, C.A., Karasin, A.I., Fouchier, R.A.M., Kawaoka, Y.: Egyptian H5N1 influenza viruses-Cause for concern? PLoS Pathog, 8(11), e1002932, 2012.
- Chandrasekaran, A., Srinivasan, A., Raman, R., Viswanathan, K., Raguram, S., Tumpey, T.M., Sasisekharan, V., Sasisekharan, R.: Glycan topology determines human adaptation of avian H5N1 virus hemagglutinin. Nat. Biotechnol., 26, 107-113, 2008.
- Yen, H.L., Liang, C.H., Wu, C.Y., Forrest, H.L., Ferguson, A., Choy, K.T., Jones, J., Wong, D.D., Cheung, P.P., Hsu, C.H., Li, O.T., Yuen, K.M., Chan, R.W., Poon, L.L., Chan, M.C., Nicholls, J.M., Krauss, S., Wong, C.H., Guan, Y., Webster, R.G., Webby, R.J., Peiris, M.: Hemagglutinin-neuraminidase balance confers respiratory-droplet transmissibility of the pandemic H1N1 influenza virus in ferrets. Proc. Natl. Acad. Sci. U S A, 108, 14264-14269, 2011.


