
氏名:安形 高志
理化学研究所 基幹研究所
安形高志氏は1993年に東京大学理学部生物化学科を卒業し、1998年に東京大学大学院理学系研究科生物化学専攻から博士号を授与された。博士号取得後はカリフォルニア大学サンディエゴ校にてAjit Varki教授のもとでポストドクトラルフェロー(1998〜2003年)、(独)産業技術総合研究所にて若手任期付研究員/研究員(2003〜2009年)、大阪大学にて特任准教授(2009〜2011年)を務め、現在は(独)理化学研究所にてチームリーダーを務める(2011年〜)。
安形氏はシアル酸認識タンパク質群であるシグレックファミリーの全容の解明に貢献し、またいくつかの重要な発見(例えば活性化型と抑制型のシグレックの協調的進化の発見)に寄与した。現在は活性化型シグレックが自然免疫と免疫関連疾患において果たす役割の解明に重点を置いて研究を進めている。
全ての細胞は複合糖質で覆われており、糖鎖は細胞の最外層を成す。この位置づけの故に、糖鎖は多細胞生物の体内および体外からの様々な因子との相互作用に極めて適している。このシリーズの他の記事を見れば分かるように、様々な分類に属する病原体(すなわちウイルス、細菌、真核生物に属する病原体)が、我々の体内の糖鎖を利用するために、様々な方法を編み出してきた。
本稿では、脊椎動物におけるシアル酸認識タンパク質の一群であるシグレックと病原体との相互作用に関する、発展途上の研究分野について紹介する。最初にシグレックとその本来の機能について簡潔に紹介し、続いてシグレックと病原体の相互作用に関するいくつかの例を挙げ(Table 1)、活性化タイプのシグレックの起源について考察し、最後に将来展望を述べる。
シグレックは免疫グロブリンスーパーファミリーに属するシアル酸認識タンパク質の一群である1, 2。シグレックのほとんどは免疫系の細胞に発現しており、これらを発現する細胞の制御シグナルに関わっている(Fig. 1)。(i)大多数のシグレックが自然免疫系の細胞(すなわち免疫反応の初期に「非自己」を認識して反応する細胞群)に発現していること、(ii)多くのシグレックが抑制性のシグナル伝達能を持つこと、(iii)シアル酸(すなわちシグレックのリガンド)の発現がほぼ後口動物(脊椎動物や棘皮動物を含む動物の系統)に限られていることなどから、免疫系のシグレックの主な機能はシアル酸を「自己」の識別サイン(SAMP = "self-associated molecular pattern";対義語はPAMP = "pathogen-associated molecular pattern")として認識し、自分の細胞に対する自己免疫反応を抑制することであると考えられてきた3。もしこの仮説が正しいならば、シグレックの持つこの性質を悪用して、宿主の免疫反応を抑制しようとする病原体が現れることが予想される。事実、以下に説明するように、病原体の中にはまさにこのようなものが見受けられる。
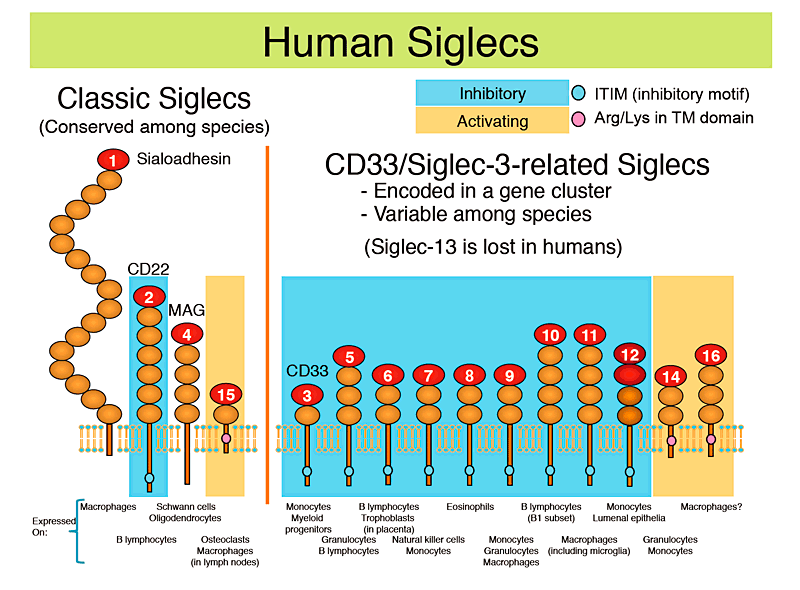
Fig.1 ヒトのシグレック
ヒトのシグレックを図式で示し(個々の楕円形は免疫グロブリン様ドメインを表す)、それぞれを発現する代表的な細胞種をそれぞれの下に記した。抑制型シグレック(細胞質領域にimmunoreceptor tyrosine-based inhibitory motif [ITIM]を持ち、チロシンホスファターゼSHP-1と相互作用する)には空色の背景を、活性化型シグレック(膜貫通領域に正に荷電したアミノ酸残基を持ち、アダプタータンパク質DAP12を介してチロシンキナーゼSykと相互作用する)にはオレンジ色の背景を施した。
ヒトのシグレックは進化のパターンに基づいて二群に分けることができる。一方の群は「古典的シグレック」と呼ばれ、種を越えて比較的よく保存されている。他方の群は「CD33類縁シグレック」と呼ばれ、遺伝子クラスターを形成して相互に高い配列相似性を示すが、種間の保存度は低い。
シアル酸の生合成は複雑な一連の反応を必要とするため、代謝的なコストが高くつく。にもかかわらず、少数の細菌(その多くはヒトの疾患に関わっている)はシアル酸を発現する4。ならばこれらの細菌によるシアル酸の発現は、シアル酸を発現しない細菌と較べて何らかの利益をもたらすはずである。補体因子Hはシアル酸またはヘパラン硫酸で覆われた表面に結合し、副経路(Alternative Pathway)による補体系の活性化を負に制御することで「自己」の細胞と組織を保護するため、従来シアル酸を発現する細菌に比較優位を与えるのは補体因子Hであると考えられてきた5。またシアル酸が細菌の糖鎖の末端をマスクすることにより、抗体反応を抑制する可能性も考えられる。これらに加え、「シグレックとの相互作用」もまた細菌がシアル酸を発現する利点に含まれるようである。
細菌がシグレックと相互作用する機構として、以下のような複数の異なる機構が見出されてきた(Table 1及びFig. 2を参照):(I)自力でシアル酸を合成し、シグレックと相互作用する。(II)宿主から拝借したシアル酸を利用してシグレックと相互作用する。(III)シグレックと直接相互作用するタンパク質を発現する。
第一のカテゴリーに含まれる細菌(Neisseria meningitidis、Campylobacter jejuni、group B Streptococcus type IIIを含む)はもっとも高くつく(すなわち自力でシアル酸を合成するという)戦略を取るが、その結果は様々なようだ。N. Meningitidis(脳髄膜炎の原因となるグラム陰性菌)の場合、sialoadhesin/Siglec-1およびSiglec-5と相互作用するが、これによりマクロファージによる貪食が亢進するため、細菌にとっては不利益になるかもしれない6。C. jejuni(食中毒の原因となるグラム陰性菌で、まれにGuillain-Barré症候群と呼ばれる神経系の疾患を引き起こす)はリポオリゴ糖(lipooligosaccharide, LOS)の末端構造によりSiglec-7 7またはsialoadhesin/Siglec-1 8と相互作用する。C. jejuniのLOSはNeu5Acα2-3またはNeu5Acα2-8を末端構造に持つが、Neu5Acα2-8構造を持つ細菌は未熟な樹状細胞に発現するSiglec-7と選択的に相互作用し、ヘルパーT細胞の分化方向制御に関わる樹状細胞上の分子の発現に影響を及ぼす9。B群連鎖球菌(group B Streptococcus, GBS;まれに新生児の脳髄膜炎や敗血症を引き起こすグラム陽性菌)III型の場合は、シアル酸依存的なSiglec-9との相互作用により、好中球による抗菌反応が抑制されると報告されている10。
第二のカテゴリーに属する細菌(Pseudomonas aeruginosaを含む)はシアル酸を宿主の体液から拝借する。P. aeruginosa(緑膿菌;免疫力の低下したヒトに各種の疾患を起こすグラム陰性菌)はヒトの血液からシアル酸を含む糖タンパク質を吸着し、好中球のSiglec-9と相互作用することによって炎症性反応を抑制する11。我々は最近、宿主の体液からシアル酸を取り込んで自らのLOSの修飾に用いるHaemophilus influenzae(まれに中耳炎や肺炎を起こすグラム陰性菌)12がいくつかのシグレックと相互作用することを見出した(未発表)。これは宿主のシアル酸を拝借してシグレックと相互作用する細菌の例と言えるかもしれないが、その結果として免疫制御にどのような影響が及ぶか、その重要性については明らかではない。
第三のカテゴリーに属する細菌(GBS Ia型を含む)はタンパク質間相互作用によって直接シグレックに結合するタンパク質を発現する。GBS Ia型はβ proteinを介してシアル酸非依存的にSiglec-5と相互作用し、顆粒球による免疫反応を弱める13。
もちろんここに挙げた例はごく一部であり、シグレックと細菌の相互作用とその帰結の多くについては今後の研究によって明らかになると考えられる。
Table 1 Pathogens reported to interact with Siglecs
| Pathogen | Siglec involved*1 | Pathogen molecule involved | Outcome | Ref. | |
| Virus | |||||
| Porcine reproductive and respiratory syndrome virus (PRRSV) | Sialoadhesin/Siglec-1 (pig) | Sialic acids on GP5 envelope glycoprotein | Enhanced infection | (15, 29) |
|
| Human immunodeficiency virus (HIV) | Sialoadhesin/Siglec-1 | Sialic acids on gp120 envelope glycoprotein | Enhanced infection | (16, 17) |
|
| Varicella zoster virus (VZV), herpes simplex virus (HSV) | Myelin-associated glycoprotein/Siglec-4 | Glycoprotein B (involvement of sialic acids is not reported) | Enhanced infection | (20) |
|
| Bacteria | |||||
| Neisseria meningitidis | Sialoadhesin/Siglec-1 Siglec-5 | Sialic acids on LPS | Enhanced binding and phagocytosis | (6) |
|
| Campylobacter jejuni | Sialoadhesin/Siglec-1 Siglec-7 | Sialic acids on LPS | Modulation of factors affecting helper T-cell differentiation | (7-9) |
|
| Group B Streptococcus type III | Siglec-9 | Sialic acids on LPS | Attenuated immune responses | (10) |
|
| Pseudomonas aeruginosa | Siglec-9 | Sialic acids on glycoproteins adsorbed from human bodily fluid | Attenuated immune responses | (11) |
|
| Group B Streptococcus type Ia | Siglec-5 Siglec-13 (chimpanzee) | β protein (independent of sialic acid) | Attenuated immune responses | (13, 23) |
|
| Eukaryotes | |||||
| Trypanosoma cruzi | Siglec-E (mouse) | Sialic acids acquired from human glycoproteins by trans-sialidase | Attenuated immune responses | (14) |
|
| Candida albicans | Siglec-7 | zymosan (?) | Enhanced immune responses | (25) |
|
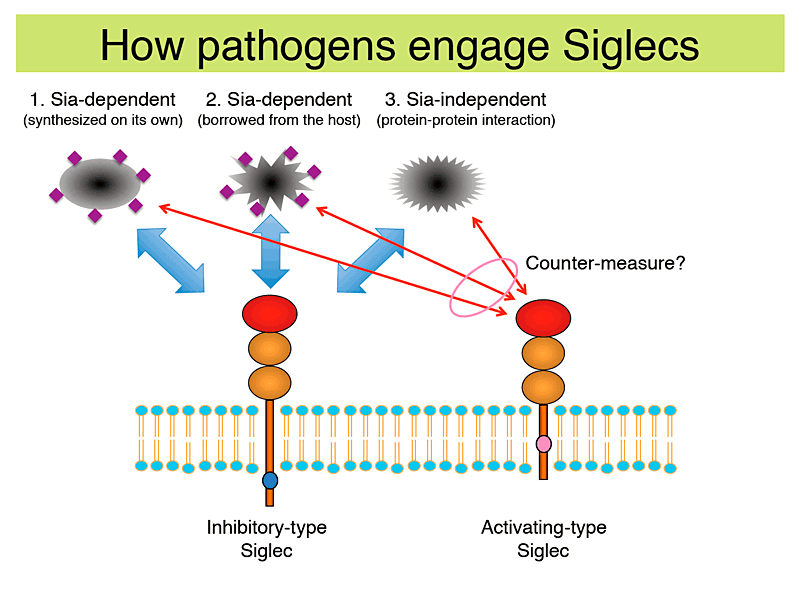
Fig.2 病原体による抑制型シグレックの利用と、活性化型シグレックによる病原体への対抗
病原体が抑制型シグレックと相互作用する方法は以下の3通りが見つかっている。すなわち(I)自らシアル酸(Sia)を合成する、(II)宿主のシアル酸を拝借する、(III)シグレックに直接結合するタンパク質を発現する、である。これらの相互作用は概して免疫反応の抑制につながり、病原体に有利に働く。活性化型シグレックはこれらの病原体を認識し、免疫反応を増強することで、これらの病原体に対抗するのではないかと考えられる。
シアル酸を利用した「分子レベルでの宿主の模倣」のもう一つの例として、中南米でChagas病と呼ばれる人獣共通感染症を起こす真核生物Trypanosoma cruziが挙げられる。T. cruziはトランスシアリダーゼ(trans-sialidase)と呼ばれる酵素を持つが、この酵素はシアル酸を宿主の複合糖質から自らの細胞上のムチン様の糖タンパク質に転移する。病原体が纏ったシアル酸は補体因子Hと結合して補体系からのカモフラージュに役立つと考えられてきたが、最近の研究ではシアル酸依存的な抑制性シグレックとの相互作用もまた、免疫反応の抑制を通じてこの病原体の生存に役立つのではないかとの知見が得られている14。
上記に挙げたような細胞性の生命体に加え、数種類のウイルスもまたシグレックと相互作用すると報告されている。最初に報告された例は、養豚業における大きな脅威の一つであるブタ繁殖・呼吸障害症候群ウイルス(porcine reproductive and respiratory syndrome virus, PRRSV)である。シアル酸依存的なブタsialoadhesin/Siglec-1との相互作用がウイルスのマクロファージへの感染を増強すると報告されている15。
ヒト免疫不全ウイルス(human immunodeficiency virus, HIV)もまた、ヒトのマクロファージ16または単球17に発現するsialoadhesin/Siglec-1と相互作用すると報告されている(単球上のsialoadhesin/Siglec-1の発現はインターフェロンにより誘導される)。このような相互作用はマクロファージ感染の増強16あるいはT細胞へのトランス感染の増強17につながる。これらの知見は、HIVの主要なエンベロープタンパク質であるgp120が主に高マンノース型のN型糖鎖で高度に修飾されており、mannose-binding lectins(MBL)やdendritic cell-specific intercellular adhesion molecule-3-grabbing non-integrin(DC-SIGN)などの自然免疫系のC型レクチンと相互作用するという従来の知見18と一見相反するように見えるが、HIVのgp120はシアル酸を含む複合型のN型糖鎖も持つと報告されている19。
シグレックと相互作用するウイルスの例としては、他に水痘・帯状疱疹ウイルス(varicella zoster virus, VZV)と単純ヘルペスウイルス1型(herpes simplex virus, HSV)が挙げられる。これらのウイルスはヘルペスウイルス科に属する近縁のウイルスである。これらのウイルスは感染後に感覚神経節に潜伏するが(潜伏感染)、神経細胞への潜伏にはこれらのウイルスがmyelin-associated glycoprotein (MAG)/Siglec-4(神経細胞を取り巻くSchwann細胞(末梢神経系)やオリゴデンドロサイト(中枢神経系)に発現するシグレック)と相互作用することが関与しているのかもしれない20。ウイルスの糖タンパク質であるglycoprotein BがMAG/Siglec-4と相互作用することが示されているが、この相互作用にシアル酸が関わるか否かについては証明されていない。
ウイルスゲノムにコードされるエンベロープタンパク質が宿主細胞のゴルジ体で糖鎖修飾されることを考えれば、エンベロープウイルスがシアル酸を持ち、シグレックのいくつかと相互作用すること(少なくともin vitroで)は当然なのかもしれない。よってシグレックと相互作用するウイルスの例は今後更に増えると予想される。
ここまでに示した例では、シグレックはしばしば病原体に悪用されている。このような悪用に対抗する手段はないのだろうか?一つの対抗手段としては、例えば病原体と相互作用して炎症抑制ではなく好炎症性の反応を誘導するシグレックのような「罠」を仕掛けることが考えられる(Fig. 2)。活性化シグナル伝達能を持つ少数のシグレックのうち、Siglec-14はこのような「罠」に適任のようである。Siglec-14の細胞外領域はSiglec-5のそれと極めて良く似ており、同様な構造の糖鎖を認識するが、Siglec-5(抑制性)とは異なり炎症増強性のシグナル伝達能を持つ。さらにSiglec-5とSiglec-14をコードする遺伝子は、複数の霊長類の系統において異様に高い配列相同性を示す21。互いに極めて高い配列相同性を示し、かつ拮抗するシグナル伝達能を持つ免疫受容体のペアは他にも多数見つかっており、これらのペアのうち活性化タイプのものは抑制タイプの受容体を悪用する病原体に対する対抗手段として生じたのではないかとの仮説が提唱されている22。
しかしながら、シグレックの進化が常にこのようなパターンを取ると考えるのは単純すぎるかもしれない。最近の論文では、Siglec-13(ヒトでは欠損しているが他の霊長類では保存されている活性化タイプのシグレック)はGBS Ia型とシアル酸非依存的(β protein依存的)に相互作用すると報告されたが、その結果として炎症性反応はむしろ抑制されることが示唆されている23。この事実は活性化型シグレックの病原体に対する対抗手段としての効果は長持ちしないことを示唆しているのかもしれない。活性化型受容体の弱いクラスタリングが抑制性シグナルにつながることがあり(活性化型受容体とキナーゼの相互作用に関わる配列モチーフが、抑制型受容体とホスファターゼの相互作用に関わる配列モチーフと良く似ているため)24、病原体は活性化型シグレックと結合しても害が及ばないように、シグレックリガンドの密度を微調整できるのかもしれない。我々は活性化型シグレックの進化上の「賞味期限」が抑制型シグレックと較べて概してはるかに短く、活性化型シグレックの多くは進化の過程で失われていること(例えば偽遺伝子になったり、ゲノムから完全に抹消されたりしていること)を見出した。さらに、Siglec-7(抑制性のシグナル伝達能を持つと考えられている)とザイモサン(酵母由来の多糖であり、シアル酸を持たない)との結合により、単球による炎症反応が増強されるとの報告もある25。このように、病原体とシグレックの相互作用とその帰結は、我々が当初想像していたよりも遥かに複雑なのかもしれない。
病原体(というより病原体や共生微生物、有益微生物を含む微生物一般)と内在性レクチンの相互作用は極めて興味深い研究分野であり、将来にわたって糖鎖とレクチンに関わる生物学の根本的な知見を生み出し続けるに違いない。ヒトシグレックの遺伝的多型(例えばSiglec-12, -14, -16のように、シグレックの欠損をもたらすヌル型アリルも存在する;文献26-28参照)の中には、病原体との相互作用に関連するものもあるかもしれない。シグレックと病原体の相互作用が実際に生体内で起こっていることを証明するには、より厳密な証明(例えば動物モデルを用いた実験的研究や、ヒトの遺伝的多型との相関を調べる疫学的研究)が必要な例もあると思われるが、これらの相互作用は治療標的にもなりうる。このように、シグレックと様々な微生物の相互作用は、今後より注目に値すると思われる。
謝辞
本稿の作成にあたって助言を頂いたAjit Varki教授(カリフォルニア大学サンディエゴ校)に感謝します。